高活性抗菌、抗逆芽孢杆菌的筛选及其紫外诱变育种
2019-12-19张文举刘孟健郑新霞卢奇成
姚 峻 张文举 刘孟健 郑新霞 卢奇成
(石河子大学动物科技学院,新疆石河子832000)
近年来由于使用抗生素等药物性饲料添加剂的弊端日益凸显,人们将目光投向了无毒、无残留及无抗药性的益生菌制剂的研究与利用。目前,益生菌作为绿色饲料添加剂已被广泛使用,菌种主要有乳酸菌、芽孢杆菌和酵母菌[1]。其中,芽孢杆菌是一类能在逆境下形成休眠体芽孢以抵抗不良环境的革兰氏阳性杆菌[2]。芽孢杆菌具有抗逆性强、营养要求简单等优点,同时在应用的安全性、广谱抗菌活性、稳定性及分子加工易操作性等方面具有独特的应用优势[3-5]。本试验主要根据益生菌的生物学特性,以7株芽孢杆菌为研究对象,通过抑制大肠杆菌能力为主要评价指标,辅以产酶特性及对人工胃液、人工肠液的耐受性进行综合评价,筛选出效果最优的芽孢杆菌,并进一步通过紫外诱变的方法提高其抑制大肠杆菌的能力[6-8],以期获得生产性能更佳的菌株,为芽孢杆菌的新型饲料微生态制剂产品的开发提供理论依据。
1 材料与方法
1.1 材料
供试菌种:大肠杆菌K99由石河子大学动物科技学院提供。枯草芽孢杆菌、地衣芽孢杆菌、纳豆芽孢杆菌、蜡样芽孢杆菌、凝结芽孢杆菌、巨大芽孢杆菌、侧孢芽孢杆菌由中粮(昌吉)粮油工业有限公司研发中心馈赠。
1.2 主要仪器与设备
立式高压蒸汽灭菌器、超净工作台、pH 计、菌落计数仪、高速离心机、恒温水浴锅、紫外分光光度计、磁力搅拌器、分析天平。
1.3 培养基
LB 培养基(g/l):NaCl 10,酵母粉5,蛋白胨10,pH值7.0~7.2。
发酵培养基(g/l):豆粕20、玉米粉30、葡萄糖5、蛋白胨2、NaCl 2、KH2PO41.5、K2HPO41.5、(NH4)2SO40.3、CaCl20.3、MnSO40.1、吐温-80 0.3、MgSO40.6,pH值8.0。
1.4 试验方法
1.4.1 芽孢杆菌发酵液的制备
将7株芽孢杆菌的菌种分别接种到液体LB 培养基中进化活化,调整摇床温度至37 ℃,180 r/min摇床培养24 h,活化后的芽孢杆菌按3%(V/V)接种入发酵培养基内,在37 ℃,180 r/min 条件下摇床培养24 h后,取培养液10 ml,4 000 r/min 离心15 min,将上清液用0.2 μm无菌滤膜过滤得到无菌体发酵液。
1.4.2 体外抑菌试验
芽孢杆菌对大肠杆菌K99体外抑菌定性实验(抑菌圈试验):往已冷却至50 ℃左右的300 ml 的LB 琼脂培养基中加入活化后的5 ml大肠杆菌菌液,迅速混匀,然后倾注无菌平板,水平静置待凝固后备用,每个处理分别重复3 次。将固体LB 平板分为均匀的8 块区域,用1 ml 枪头在试验平板上打8 个孔,孔直径约10 mm。用镊子小心挑去培养基小块以做成圆孔,往孔中注入7株芽孢杆菌的200 μl无菌体发酵液(对照组加等量灭菌发酵培养基),放置37 ℃培养24 h。如果芽孢杆菌的无菌体发酵液对大肠杆菌有抑制作用,将在接种发酵液周围出现无大肠杆菌生长的现象,出现明显的抑菌圈,统计抑菌圈的直径[9]。
芽孢杆菌对大肠杆菌K99体外抑菌定量实验:往已冷却至50 ℃左右的300 ml 的LB 琼脂培养基中加入活化后的5 ml大肠杆菌菌液及30 ml的无菌体发酵液(对照组加等量的灭菌发酵培养基),迅速混匀,37 ℃静置培养24 h,在菌落计数仪上计数,每个处理分别重复3次。
抑制率(%)=(芽孢组菌落数-对照组菌落数)/对照组菌落数×100
1.4.3 粗酶液的制备
7 株芽孢杆菌的菌种分别接种到液体LB 培养基中进化活化,调整摇床温度至37 ℃,180 r/min摇床培养24 h,活化后的芽孢杆菌按3%(v/v)接种入发酵培养基内,调整摇床温度至37 ℃,180 r/min 摇床培养48 h 后,取培养液5 000 r/min,4 ℃离心20 min,离心取上清液,再用pH 值6.7 磷酸缓冲液稀释适当倍数,6 500 r/min,4 ℃离心5 min,吸取上清液待测酶活。
1.4.4 蛋白酶活力的测定
参照国标GB/T 23527—2009《蛋白酶制剂》中附录B《蛋白酶活力的测定福林法》[10]。
1.4.5 淀粉酶活力、脂肪酶的测定
按照淀粉酶、脂肪酶检测试剂盒(购自南京建成生物工程研究所,中国)的使用说明检测。
1.4.6 纤维素酶活力的测定
参照NY/T 912—2004《纤维素酶制剂》中CMCNa DNS法纤维素酶活的检测方法[11]。
1.4.7 耐人工胃液能力测定
从7株芽孢杆菌的LB斜面,接种一环于装有50 ml的LB培养液的250 ml三角瓶中,于pH=3的人工胃液中,摇匀后,放入37 ℃的恒温培养箱中,于120 min后取出相应试管,摇匀后10倍梯度稀释,从适当梯度的稀释液中,吸20 μl 涂板于培养基,放置15 min,于37 ℃培养箱中培养24 h。用菌落计数仪进行计数。
1.4.8 耐人工肠液能力测定
从7株芽孢杆菌的LB斜面,接种一环于装有50 ml的LB培养液的250 ml三角瓶中,于37 ℃下180 r/min培养24 h。取各个菌株培养液各3 ml,加入到pH=6.8的人工肠液中,摇匀后,放入37 ℃的恒温培养箱中,于120 min 后取出相应试管,摇匀后10 倍梯度稀释,从适当梯度的稀释液中,吸20 μl涂板于培养基,放置15 min,于37 ℃培养箱中培养24 h。用菌落计数仪进行计数。
1.4.9 紫外诱变育种
取培养24 h的出发菌株斜面,用接种环调取1环置于含有100 ml无菌生理盐水的三角瓶中,180 r/min振荡30 min,将其稀释至1×108个/ml,备用。先打开超净工作台中20 W紫外灯预照30 min,以稳定光线;取0.1 ml 菌悬液均匀涂布于LB 营养琼脂平板上;然后取各组平板依次放在紫外灯垂直下方20 cm 处进行紫外线诱变,照射时间为0、20、40、60、80、100、120、140 s。取紫外诱变后的菌液用无菌生理盐水以10倍稀释法进行梯度稀释,并取三个连续梯度10-3、10-4、10-5的菌液各0.1 ml涂布于LB琼脂培养基,将涂布好的培养基用灭菌后的牛皮纸包好并装在黑色塑料袋中,避免光照,置37 ℃条件下培养24 h。以未经照射的菌液涂布的平板为对照,测定细胞的致死率。选择致死率在70%~80%左右的照射时间作为诱变处理时间。以最佳诱变处理时间对巨大芽孢杆菌进行紫外诱变后,取稀释后的菌液0.1 ml 涂布于LB 琼脂培养基,将涂布好的LB 营养琼脂培养基用灭菌后的牛皮纸包好并装在黑色塑料袋中,避免光照,置37 ℃培养箱中培养24 h。待菌落长出后,将所有平板上所有菌株转接到LB 斜面培养基,置37 ℃培养箱中培养24 h。从培养后的斜面上取菌苔一环接入LB液体培养基中,活化两代。将活化后的菌株接种到发酵培养基管(20 ml/管),接种量为3%(V/V)。将发酵试管置于37 ℃摇床中180 r/min 培养24 h。发酵结束后,离心过滤后获取无菌体体发酵液,再进行大肠杆菌K99体外抑菌定量实验,获得对大肠杆菌K99抑制率最高的诱变菌株。
由于经过紫外线诱变的菌株会在自身的修复作用下产生回复突变,所以为保证筛选的突变菌株有很好的稳定性,要进行传代实验以检验其性能。将筛选出的突变菌株连续培养5代进行抑菌试验,测定对大肠杆菌K99的抑菌率,评价突变菌株的遗传性状稳定性。
2 结果与分析
2.1 芽孢杆菌体外抑菌试验结果
芽孢杆菌对大肠杆菌K99 抑菌试验结果如图1所示。7株芽孢杆菌的发酵液对大肠菌K99的抑菌圈直径的大小依次排序为:巨大芽孢杆菌>侧孢芽孢杆菌>枯草芽孢杆菌>地衣芽孢杆菌>纳豆芽孢杆菌>凝结芽孢杆菌、蜡样芽孢杆菌,其中巨大芽孢杆菌抑菌圈直径最大,达到17.68 mm,侧孢芽孢杆菌次之,达到17.02 mm,而凝结芽孢杆菌、蜡样芽孢杆菌组并未出现明显的抑菌圈,可能是由于这2株菌产生的抗菌物质过少或者产生的抗菌物质对大肠杆菌K99 无显著抑制作用,导致未产生明显的抑菌圈。
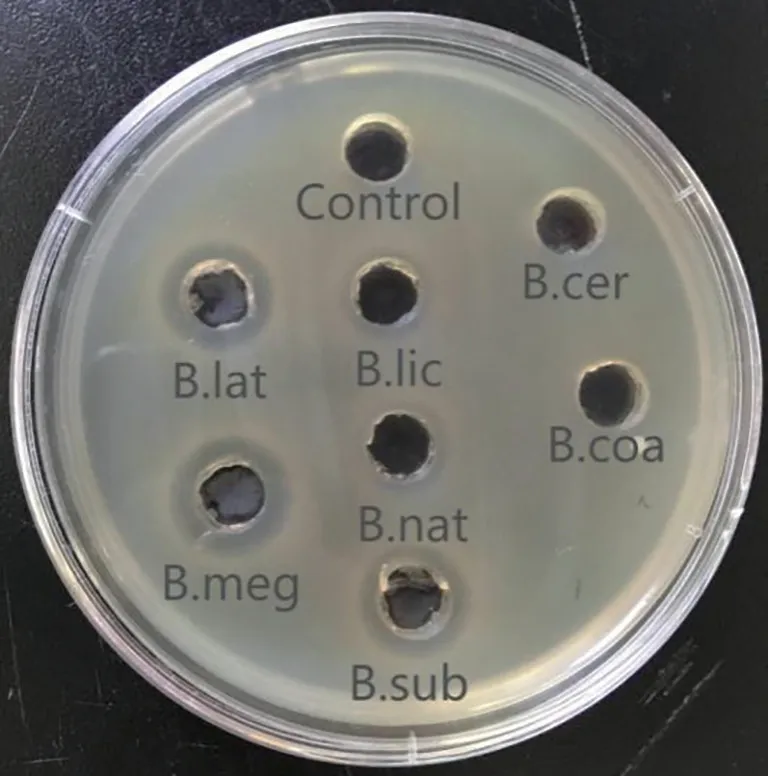
图1 芽孢杆菌发酵液抑菌试验效果
表1结果显示:芽孢杆菌对大肠杆菌K99的抑菌圈直径与抑菌率成正比,说明抑菌圈法与抑菌率检测法都能较准确的反应芽孢杆菌的抑菌性能,并且2种检测方法相关性较强。
2.2 芽孢杆菌产蛋白酶试验结果
芽孢杆菌产蛋白酶的能力如表2所示。7株芽孢杆菌均能产生一定的蛋白酶,但产生的蛋白酶的种类和数量有所不同,总蛋白酶活力从大到小依次为:枯草芽孢杆菌>巨大芽孢杆菌>地衣芽孢杆菌>凝结芽孢杆菌>蜡样芽孢杆菌>侧孢芽孢杆菌,总酶活力最高的为枯草芽孢杆菌,达到305.99 U/ml,其次为巨大芽孢杆菌,达到278.76 U/ml,总蛋白酶活力较低的是纳豆芽孢杆菌、侧孢芽孢杆菌。有趣的是,巨大芽孢杆菌并不产生碱性蛋白酶,但却能产生大量的酸性蛋白酶、中性蛋白酶,使得其总酶活力较高。

表1 芽孢杆菌发酵液的抑菌圈直径统计
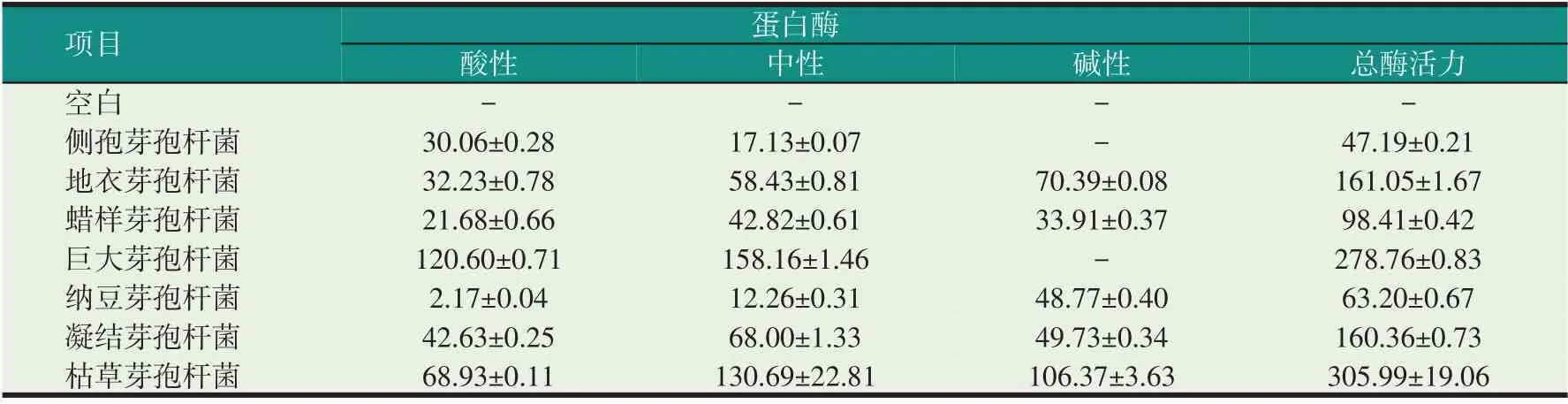
表2 芽孢杆菌的产蛋白酶能力统计(U/ml)
2.3 芽孢杆菌产淀粉酶、产脂肪酶、产纤维素酶试验结果
芽孢杆菌产淀粉酶、产脂肪酶、纤维素酶的能力如表3 所示。7 株芽孢杆菌的淀粉酶活力从大到小依次为:巨大芽孢杆菌>枯草芽孢杆菌>蜡样芽孢杆菌>凝结芽孢杆菌>侧孢芽孢杆菌>地衣芽孢杆菌>纳豆芽孢杆菌,淀粉酶活力最高的为巨大芽孢杆菌,达到45.28 U/ml,其次为枯草芽孢杆菌,达到42.96 U/ml,淀粉酶活力较低的是地衣芽孢杆菌、纳豆芽孢杆菌。
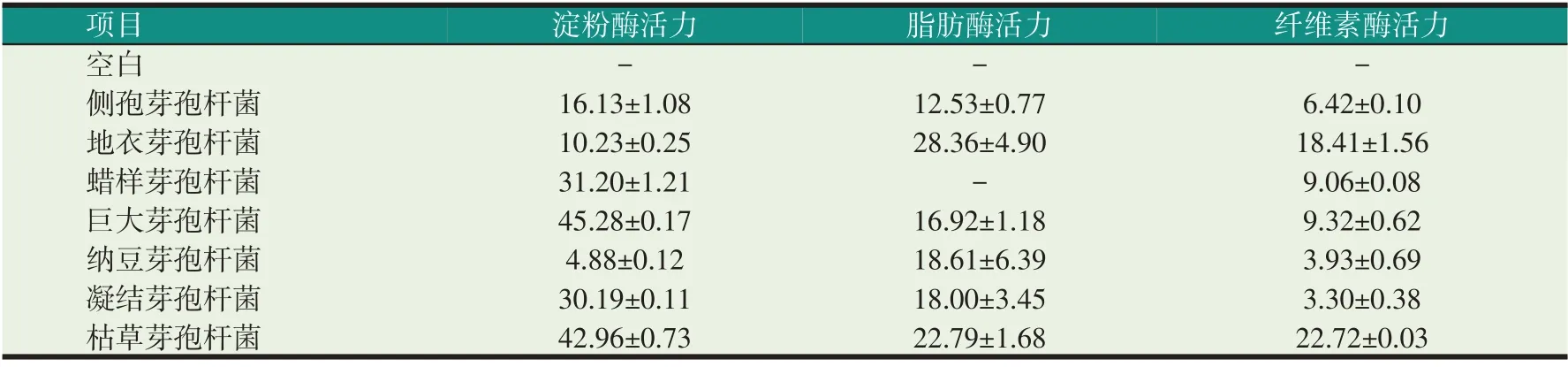
表3 芽孢杆菌的产淀粉酶、产脂肪酶、产纤维素酶能力统计(U/ml)
芽孢杆菌的脂肪酶活力从大到小依次为:地衣芽孢杆菌>枯草芽孢杆菌>纳豆芽孢杆菌>凝结芽孢杆菌>巨大芽孢杆菌>侧孢芽孢杆菌>蜡样芽孢杆菌,脂肪酶活力最高的为地衣芽孢杆菌,达到28.36 U/ml,其次为枯草芽孢杆菌,达到22.79 U/ml,脂肪酶活力较低的是蜡样芽孢杆菌,其几乎不产脂肪酶。
芽孢杆菌的纤维素酶活力从大到小依次为:枯草芽孢杆菌>地衣芽孢杆菌>巨大芽孢杆菌>蜡样芽孢杆菌>侧孢芽孢杆菌>纳豆芽孢杆菌>凝结芽孢杆菌,纤维素酶活力最高的为枯草芽孢杆菌,达到22.72 U/ml,其次为地衣芽孢杆菌,达到18.41 U/ml,纤维素活力较低的是纳豆芽孢杆菌、凝结芽孢杆菌。
2.4 芽孢杆菌对人工胃液的耐受性
芽孢杆菌的人工胃液耐受能力如图2 所示。地衣芽孢杆菌、蜡样芽孢杆菌、巨大芽孢杆菌、凝结芽孢杆菌在pH=3的人工胃液中不但不致死,还能够繁殖,说明这几株芽孢杆菌具有极强的耐酸能力;纳豆芽孢杆菌、枯草芽孢杆菌的耐酸性也比较强,达到了90%以上;耐酸性最弱的为侧孢芽孢杆菌,存活率为85.26%。

图2 芽孢杆菌对人工胃液的耐受能力统计
2.5 芽孢杆菌对人工肠液的耐受性
芽孢杆菌的人工肠液耐受能力如图3 所示。巨大芽孢杆菌、凝结芽孢杆菌在pH=6.9 的人工肠液中存活率达到90%以上。蜡样芽孢杆菌、纳豆芽孢杆菌、枯草芽孢杆菌的人工肠液中存活率达到80%以上。人工肠液耐受性最差的是侧孢芽孢杆菌、地衣芽孢杆菌,两者的存活率不足70%。
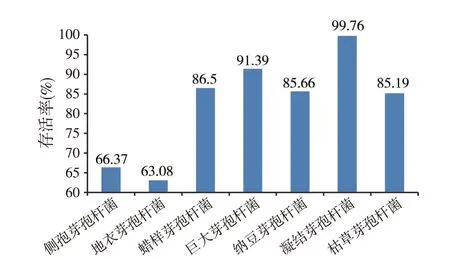
图3 芽孢杆菌对人工肠液的耐受能力统计
根据检测结果综合分析,在本次研究的7 株菌中,巨大芽孢杆菌表现出最强的抑制大肠杆菌能力与较强的产酶特性及人工胃液、人工肠液的耐受性,其作为新型饲料微生态制剂的开发潜力较大,所以最终选择巨大芽孢杆菌作为紫外诱变育种的研究对象,对其主要评价指标抑制大肠杆菌的能力进行优化。
2.6 紫外诱变结果
2.6.1 紫外照射时间对巨大芽孢杆菌致死率的影响

图4 紫外照射时间与巨大芽孢杆菌致死率曲线
由图4 可知,当紫外照射时间为80 s 时,巨大芽孢杆菌的致死率为78.15%,由于菌体致死率在70%至80%之间可能获得较高的正向突变率。所以,选择照射时间80 s为最佳诱变时间。
2.6.2 紫外诱变后菌株的筛选
由表4可知,巨大芽孢杆菌紫外诱变后获得的28株菌中有2 株菌的抑菌率高于原始菌株,正突变率为7.14%。这两株菌分别是UV-9和UV-26。菌株UV-9的抑菌率为88.39%,比原始菌株巨大芽孢杆菌的抑菌率提高了3.63个百分点,菌株UV-26的抑菌率为90.92%,比原始巨大芽孢杆菌的抑菌率提高了6.16个百分点。
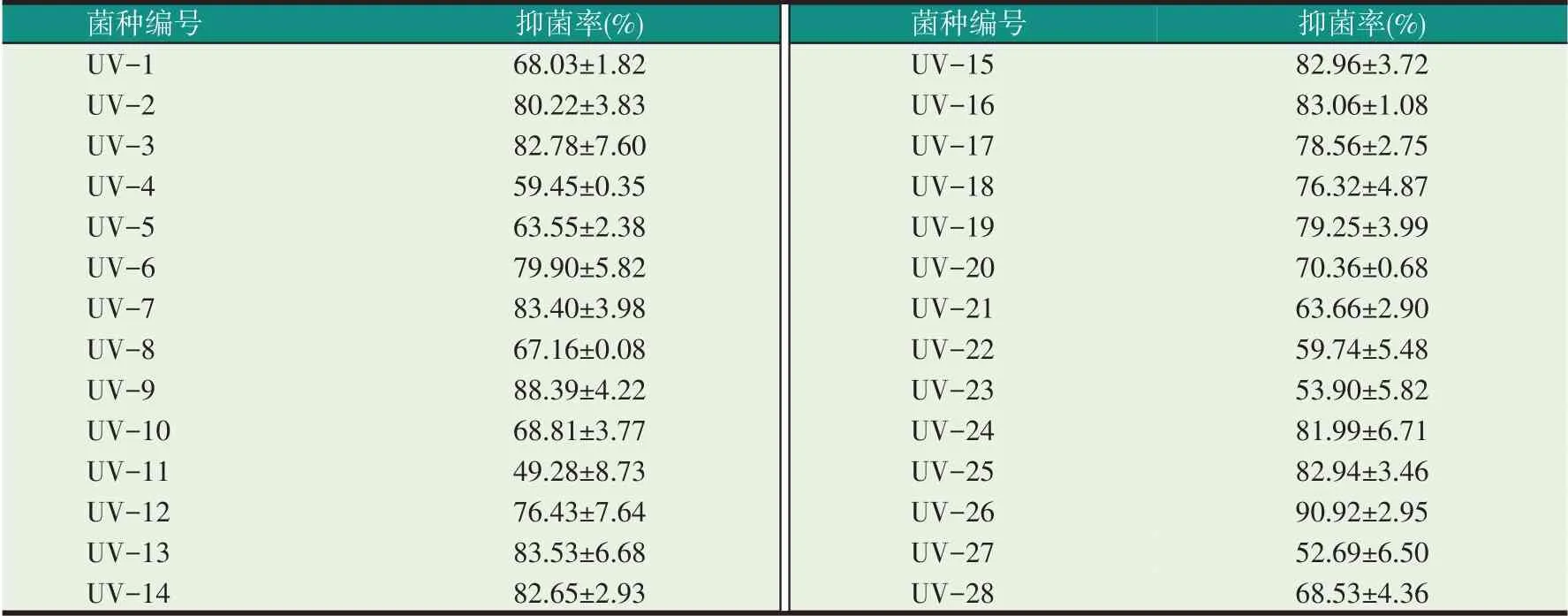
表4 紫外诱变后各菌株的抑菌率
2.6.3 稳定性试验
由表5 可知,传代5 次后UV-26 菌株抑制大肠杆菌K99的能力基本保持稳定,同时UV-26菌株除了产纤维素酶能力比出发菌株略有降低外,其产蛋白酶能力、产淀粉酶能力、产脂肪酶能力、耐人工胃液、耐人工肠液的能力相比出发菌株都略有提高,且基本保持稳定。由此可见,紫外诱变后突变菌株UV-26获得的优良性状基本可稳定遗传。

表5 菌株UV-26的传代稳定性试验结果
3 讨论
本研究结果表明,7 种芽孢杆菌各自具有不同的生物学特性:巨大芽孢杆菌、侧孢芽孢杆菌具有较强的抑制大肠杆菌的能力,蛋白酶总活力最高的是枯草芽孢杆菌,淀粉酶活力最高的是巨大芽孢杆菌,脂肪酶活力最高的是地衣芽孢杆菌,纤维素酶活力最高的是枯草芽孢杆菌,耐人工胃酸能力最强的是地衣芽孢杆菌,耐人工肠液能力最强的是凝结芽孢杆菌。因此要根据芽孢杆菌的不同特性,在生产应用上各有侧重。在应用芽孢杆菌制剂时,可以根据实际生产中的不同要求,选育具有不同优良特性的芽孢杆菌菌株,如强抑制病原菌芽孢杆菌株、高产蛋白酶菌株、高产淀粉酶菌株、高产脂肪酶菌株、高产纤维素酶菌株、耐人工胃酸菌株及耐人工肠液菌株等。通过本次研究综合分析,巨大芽孢杆菌在7 株菌中,抑制大肠杆菌能力最强,产酶特性及耐人工胃液、肠液的能力也较强,具有作为新型饲料微生态制剂产品的开发潜力。今后,除了继续在高产菌株筛选、诱变育种方面深入研究外,还应利用基因工程技术,有针对性的对芽孢杆菌的抗菌基因进行克隆,使巨大芽孢杆菌菌株抑制病原菌的能力得到最大幅度的突破和提高。
4 结论
①巨大芽孢杆菌在7株菌中,抑制大肠杆菌K99的能力最强,产酶特性及耐人工胃液、肠液的能力也较强,综合评定生物学特性最优。
②进一步对此株巨大芽孢杆菌进行紫外线诱变处理,在处理时间为80 s时筛选得到1株抑制大肠杆菌效果最好的菌株UV-26,其抑菌率可达90.92%,比出发菌的抑菌率提高了6.16 个百分点,经传代、发酵试验证明其遗传性状稳定,适合用于新型微生态制剂产品的研发。
