串联质谱检测和高通量测序对青海地区新生儿出生缺陷筛查和诊断的横断面调查
2019-12-19赵得雄吴梦圆吴冰冰孙卫华彭小敏吴弘疆海妤婷王生兰周文浩王慧君
赵得雄 吴梦圆 吴冰冰 孙卫华 彭小敏 吴弘疆 海妤婷 王生兰 周文浩,3 王慧君 陆 炜
高灵敏性、高特异性、高性价比的串联质谱检测技术目前已广泛应用于新生儿遗传代谢病(IMD)筛查及临床高危患儿的检测[1],因其检测范围存在一定的局限性,近几年迅速发展起来的二代测序技术正越来越广泛地被应用于IMD的临床诊断中[2]。本课题组前期以高通量测序(NGS)作为金标准,以质谱检测作为待测标准,对2 000例疑似IMD的高危新生儿人群行IMD筛查,质谱检测+NGS较单纯质谱检测可以更加快速且全面确诊临床表现疑似IMD的高危新生儿,尽早实施个体化治疗,改善患儿预后。但基于普通新生儿人群,较大规模的质谱检测+NGS筛查IMD是否有更好的价值值得探讨。有研究通过对青海省西宁地区388例高危患儿行血尿质谱检测,发现该地区IMD的阳性病明显高于国内其他地区[3],本研究以青海省红十字医院为牵头单位,以“基于高通量测序技术的新生儿出生缺陷筛查技术研究与示范”项目为研究背景,对青海地区普通新生儿人群行质谱检测并对高危新生儿人群行NGS筛查,为IMD等新生儿出生缺陷类疾病早筛查、早诊疗政策提供证据。
1 方法
1.1 研究设计 本文为横断面调查,对青海部分地区活产新生儿足跟血行串联质谱IMD筛查,对串联质谱筛查结果异常的新生儿人群,串联质谱筛查人群中具有特殊面容、结构畸形新生儿和母亲有不良孕产史的新生儿行NGS检测,考察串联质谱+NGS筛查新生儿遗传性疾病的作用和价值。
1.2 筛查时间 2018年1月8日至10月18日。
1.3 筛查现场 青海省红十字医院,青海省交通医院,西宁市第二人民医院,海南州贵德县医院,黄南州医院,海东市民和县人民医院,民和县第二人民医院,民和县中医院。
1.4 筛查人群和血标本采集 在征得新生儿父母知情同意后,①生后即刻采集新生儿脐静脉血和可能采集到的父母静脉血(1~2 mL,EDTA抗凝管中),②生后72 h采集新生儿足跟血,滴于新生儿疾病筛查专用干血滴滤纸片,行串联质谱IMD筛查。青海省西宁市以外的筛查现场,由青海省红十字医院派员协助所在医院采集脐静脉血和足跟血,并低温转运标本至青海省红十字医院。
1.5 筛查人群信息登记 ①一般信息:父母的年龄,民族,文化程度,职业,吸烟史,饮酒史,家族疾病史,近亲结婚,晚近三代遗传病史;母亲孕次,分娩年龄,孕周,不良孕产史,分娩方式,孕期疾病(糖尿病、贫血、妊娠期高血压、胎儿生长受限、感染),孕期服药史,先兆流产史,接触放射线,接触有毒物质,孕期电脑使用情况,孕期和产后相关疾病及事件(情绪抑郁、焦虑、负性生活事件)。②新生儿信息:出生体重、身长、头围;产前和围生期情况(羊水、颈部水囊瘤/NT增厚、心脏和肠管强回声),五官和四肢特征异常,皮肤异常表现,查体,实验室和影像学检查提示的心血管、神经、消化、骨骼、泌尿和血液系统异常。
1.6 筛查高危人群的遴选 复旦大学附属儿科医院(我院)儿科研究所分子医学中心从筛查人群信息登记表中遴选特殊面容、结构畸形的新生儿,母亲有不良孕产史、家族疾病史、近亲结婚、晚近三代遗传病史的新生儿作为NGS检测对象。
1.7 新生遗传代谢病串联质谱筛查及异常判断 足跟采血干血滴滤纸片标本均统一在我院儿科研究所质谱室行血氨基酸和肉碱谱分析和判断。应用Waters公司Acquity UPLC H-class xevo TQD串联四极杆液相色谱-串联质谱仪,筛查指标共52个,包括18种氨基酸、游离肉碱、25种酰基肉碱及8种氨基酸或酰基肉碱相互间比值。串联质谱筛查病种共49种,包括氨基酸代谢病、脂肪酸代谢病和有机酸代谢病[4]。由质谱室专业技术人员根据血中特异性氨基酸或酰基肉碱以及相关参数比值的异常程度[5-7]并结合筛查人群信息登记表的信息综合判断,将质谱检测异常结果分为IMD可能和提示继发性改变可能。鉴于串联质谱筛查非严格的定量判断,IMD可能是指:疾病特异性的代谢标志物高于正常范围2倍以上,或低于正常范围1倍左右,需要召回复查并随访监测。继发性改变是指:检测值略高于或低于正常范围,或者代谢谱的改变不符合疾病特征性,考虑由早产儿肝酶活性低、出生后的应激状态、进食奶量等因素引起的继发性改变。
1.8 基于NGS的新生儿基因Panel检测 我院分子医学中心根据采集的脐静脉血抽提基因组DNA行NGS检测。
1.8.1 检测方法 抽提自愿受检者脐静脉血基因组DNA,使用Agilent ClearSeq Inherited Disease试剂盒(包含2 742个已知致病基因)进行外显子捕获,采用Illumina HiSeq平台进行测序,目标区域平均测序深度180-200X,其中目标序列的98%深度>20X。
1.8.2 基因变异分析及结果解读 采用我院高通量测序数据分析流程(复旦流程2.0)筛选遗传疾病候选变异[8],原始图像文件经碱基识别(base calling)、去除接头以及低质量的读序后,采用Burrows-Wheeler Aligner(BWA)软件将其定位到人类基因组的参考序列上,去除冗余信息后用GATK检测变异。通过ANNOVAR和VEP(Variant Effect Predictor)等软件从不同层面对变异进行注释。参阅ACMG对变异的分类标准以及基因是否在ClinVar/OMIM/HGMD中被报道为致病基因,同时采用多种工具预测错义变异的功能以及非编码调控序列的注释等。拷贝数变异分析则从同一测序批次的BAM文件开始,经过外显子覆盖深度的计算、质控筛选、CANOES计算CNVs评分并提供候选CNVs,再从基因和区域水平对CNVs进行注释和筛选[9]。结合突变频率、类型,使用明码开发验证过的临床序列分析软件(CSA)评估变异,依据美国医学遗传学与基因组学学会(ACMG)发布的《序列变异解读标准和指南》对变异进行分类,再进一步结合相关疾病的遗传模式综合判断阳性病例[10],采用Sanger测序验证阳性变异。
1.9 数据统计方法 采用SPSS 21.0软件进行数据分析,计量资料采用均数±标准差描述。组间比较,当方差齐时采用单因素方差分析(one-way ANOVA),方差不齐的样本采用非参数Kruskal-Wallis检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 研究期间共收集青海地区新生儿干血滴滤纸片4 016份(例),男性2 125例(51.6%),女性1 991例;汉族2 332例(58.1%),藏族755例(18.8%),回族659例(16.4%),其他民族270例(6.7%)。4 016例来自青海8个市和州,其中西宁市2 180例(54.3%),海东市1 073例(26.7%),海北州121例(3%),黄南州102例(2.5%),海南州290例(7.2%),果洛州48例(1.2%),玉树州92例(2.3%)、海西州110例(2.7%)。
2.2 串联质谱检测结果 4 016例新生儿中串联质谱筛查提示代谢异常共59例(1.47%);①提示IMD可能5例(0.12%):氨基酸代谢病可能2例(均为苯丙氨酸、苯丙氨酸/酪氨酸均显著高于正常参考范围),有机酸代谢病可能1例(异戊酰肉碱,异戊酰肉碱/乙酰肉碱均高于正常参考范围),脂肪酸代谢病可能2例(游离肉碱明显低于正常参考范围);②提示继发性改变可能54例(1.35%):丙氨酸、甘氨酸、苯丙氨酸、丁酰肉碱多种氨基酸均高于正常参考范围2例,丙氨酸、甘氨酸高于正常参考范围各1例,瓜氨酸高于正常参考范围5例,酪氨酸高于正常参考范围8例,游离肉碱低于正常参考范围12例,丙酰肉碱及丙酰肉碱/乙酰肉碱高于正常参考范围5例,丁酰肉碱高于正常参考范围8例,羟戊酰肉碱高于正常参考范围2例,癸酰肉碱高于正常参考范围2例,肉豆蔻烯酰肉碱高于正常参考范围1例,棕榈酰肉碱、棕榈烯酰肉碱、硬酯酰肉碱、硬酯烯酰肉碱均高于正常参考范围7例。
2.3 NGS检测
2.3.1 质谱筛查提示代谢异常人群 本文2.2部分的59例新生儿。
2.3.2 高危人群 4 016例串联质谱筛查人群中通过筛查人群信息登记遴选出709例高危新生儿,①母亲因素:羊水过多11例、羊水过少95例、妊娠合并贫血84例、瘢痕子宫30例、胎膜早破61例、先天性心脏病3例、胎儿生长受限43例、血小板减少19例、乙肝27例、妊娠期糖尿病91例、妊娠期高血压47例、甲状腺功能异常115例、胆汁淤积25例;不良孕产史:流产126例、死胎39例、异位妊娠5例、宫外孕5例;有遗传病家族史19例。②新生儿因素:早产儿63例,先天性心脏病等心血管异常13例,指趾或其他畸形12例,五官异常8例,皮肤异常3例,消化系统异常1例,多囊肾等泌尿系统异常19例,贫血等血液系统异常2例。
2.4 NGS检测结果
2.4.1 IMD 5例IMD可能NGS,确诊为IMD 3例,IMD阳性率1∶1 339(0.075%),表1中,例1和2为高苯丙氨酸血症,例3为原发性肉碱缺乏症;2例NGS未明确质谱检测到的肉碱异常结果,结合临床及随访复查结果考虑为假阳性;54例提示继发性改变可能,NGS检测均未发现质谱筛查疾病谱范围内IMD,提示质谱筛查未发现假阴性情况。
2.4.2 基因变异分析 54例提示继发性改变NGS检测到致病/可疑致病变异1例(例4);709例高危儿NGS检测到致病/可疑致病变异4例(例5~8)。例4~8均非串联质谱所能筛查的49种病种。
2.4.3 拷贝数变异 表1显示,768例行拷贝数变异分析,6例评级为致病变异。质谱筛查提示继发性改变,NGS检测到致病1例(例9),质谱筛查阴性NGS检测到致病/可疑致病变异5例(例10~14)。上述疾病均非串联质谱所能筛查的49种病种。
2.5 青海地区汉、藏、回族质谱检测血代谢物水平
2.5.1 血氨基酸水平 表3显示,汉藏回民族丙氨酸、天冬氨酸、甘氨酸、丝氨酸、色氨酸、亮/异亮氨酸、缬氨酸、苯丙氨酸、瓜氨酸、谷氨酸、脯氨酸、酪氨酸和精氨酸水平差异均有统计学意义(P<0.05)。两两比较显示,汉与回族丙氨酸、丝氨酸、亮/异亮氨酸、缬氨酸、苯丙氨酸、瓜氨酸、谷氨酸、脯氨酸、酪氨酸差异有统计学意义(P<0.016),丙氨酸、天冬氨酸、甘氨酸、色氨酸、亮/异亮氨酸,缬氨酸以及脯氨酸和酪氨酸与藏族之间差异有统计学意义(P<0.016),藏族新生儿亮/异亮氨酸与精氨酸水平与回族之间差异有统计学意义(P<0.016)。
2.5.2 血肉碱水平 血肉碱浓度中,汉族新生儿游离肉碱C0与藏族差异有统计学意义(P<0.016),与回族差异有统计学意义(P<0.016),藏族新生儿与回族差异无统计学意义(P>0.016);酰基肉碱中,汉、藏、回民族乙酰肉碱、丙酰肉碱、C3/C2、汉族新生儿乙酰肉碱C2,丙酰肉碱C3,C3/C2、丙二酰肉碱C3DC、丁酰肉碱C4、丁二酰肉碱C4DC、异戊酰肉碱C5、羟戊酰肉碱C5-OH、C5/C2、C5/C3、己酰肉碱C6、癸烯酰肉碱C10∶1、月桂酰肉碱C12、肉豆蔻酰肉碱C14、肉豆蔻烯酰肉碱C14∶1、棕榈酰肉碱C16、棕榈烯酰肉碱C16∶1、硬酯酰肉碱C18、硬酯烯酰肉碱C18∶1及C0/(C16+C18)水平差异均有统计学意义(P<0.05)。两两比较显示,汉族与回族丙二酰肉碱C3DC、羟戊酰肉碱C5-OH、C5/C2、C5/C3、癸烯酰肉碱C10∶1、肉豆蔻酰肉碱C14、硬酯烯酰肉碱C18∶1及C0/(C16+C18)差异有统计学意义(P<0.016),与藏族乙酰肉碱C2,丙酰肉碱C3,C3/C2、丁酰肉碱C4、丁二酰肉碱C4DC、羟戊酰肉碱C5-OH、C5/C2、己酰肉碱C6、肉豆蔻酰肉碱C14、棕榈酰肉碱C16、棕榈烯酰肉碱C16∶1、硬酯酰肉碱C18、硬酯烯酰肉碱C18∶1差异有统计学意义(P<0.016),而藏族新生儿乙酰肉碱C2,丙酰肉碱C3,C3/C2、丙二酰肉碱C3DC、丁酰肉碱C4、C5/C3、己酰肉碱C6、月桂酰肉碱C12、肉豆蔻烯酰肉碱C14∶1、棕榈烯酰肉碱C16∶1与回族差异有统计学意义(P<0.016)。

3 讨论
新生儿疾病筛查是提高人口素质,降低出生缺陷、减少残疾儿童发生的一项重要措施,也是集健康教育、实验检测、诊断、治疗、随访为一体的一项庞大的系统工程。青海位于青藏高原东北部,平均海拔>3 000 m(西宁市境内最高海拔4 394 m,市区中心海拔2 261 m),紫外线强、氧分压低(含氧量仅占平原的75%左右)。青海境内有汉、藏、回等多民族聚居,不同民族饮食习惯、生活习性之间存在明显差异。近亲婚配、孕妇依从率较低及围生期保健的缺乏均可影响新生儿死亡率及遗传性疾病的发生率,2017年《青海省儿童健康状况通报》显示,青海地区新生儿死亡率显著高于全国平均水平。青海省的新生儿筛查工作起步较晚,自2001年成立青海省新生儿筛查中心以来,新生儿筛查工作逐走步向规范化,筛查范围逐渐扩大,筛查率逐渐提高。本研究样本来自青海全省8个市州(以西宁市为主),有别于其他地处平原、民族以汉族为主的地区,着眼于青海地区高海拔多民族的地域民族特色,在新生儿人群首次开展串联质谱IMD筛查并对高危新生儿人群行NGS筛查,进一步对汉、藏和回民族血中氨基酸及肉碱代谢物水平差异做统计分析,为了解高海拔地区新生儿IMD发病率情况、疾病谱特点及其他遗传相关性出生缺陷类疾病的发生情况提供依据。
本研究中4 016例新生儿质谱初筛阳性率为1.47%,与2018年徐州地区165 262例新生儿质谱筛查阳性率2.0%和2017年陕西地区27 217例新生儿质谱筛查阳性率1.69%相仿[11-12]。59例初筛阳性者经数据评估后,其中5例提示IMD可能,结合NGS检测结果,最终确诊3例(2例为高苯丙氨酸血症,1例为原发性肉碱缺乏症),阳性率为1/1 339,高于美国、加拿大、澳大利亚及西欧部分国家报道的筛查阳性率(1/2 000~1/5 000)[13],也高于上海、浙江等报道的阳性率(1/3 528~1/7 371)[6,14],但与2018年宁夏地区新生儿IMD串联质谱筛查报道的阳性率相仿(1/1 472)[15]。分析原因如下:①本研究中确诊的3例IMD有2例为高苯丙氨酸血症,而青海地区高苯丙氨酸血症的发生率明显高于全国的平均水平[16];②本次研究统计年限相对较短,筛查数目较小,随着样本数目的扩充,IMD质谱检测阳性率可能会下降;③本研究使用的串联质谱血氨基酸及肉碱检测的切值(cut-off值),是我院质谱室前期根据上海平原地区数万例正常新生儿检测值的0.5%~99.5%CI计算得出,而青海高海拔地区多民族聚居,两者人群基线存在较大差异,而cut-off值设定标准的不同,可能会对筛查结果的判断产生影响。

表3 青海地区汉藏回新生儿血串联质谱筛查数据比较
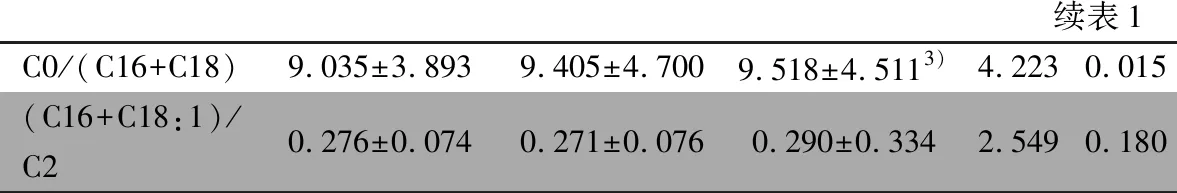
续表1 C0/(C16+C18)9.035±3.8939.405±4.7009.518±4.5113)4.2230.015(C16+C18:1)/C20.276±0.0740.271±0.0760.290±0.3342.5490.180
注 1):汉族与藏族比较P<0.016;2):藏族与回族比较P<0.016;3):汉族与回族比较P<0.016;Ala:丙氨酸;Asp:天冬氨酸;Phe:苯丙氨酸;Tyr:酪氨酸;Leu:亮氨酸;Val:缬氨酸;Met:甲硫氨酸;Cit:瓜氨酸;Arg:精氨酸;Orn:鸟氨酸;Gly:甘氨酸;GAA:胍基乙酸;Cr:肌酸;Pro:脯氨酸;Lys:赖氨酸;Xle:氧代脯氨;Tsp:色氨酸;Glu:谷氨酸;C0:游离肉碱;C2:乙酰肉碱;C3:丙酰肉碱;C3DC:丙二酰肉碱;C4:丁酰肉碱;C4DC:丁二酰肉碱;C4-OH:羟基丁酰肉碱;C5:异戊酰肉碱;C5DC:戊二酰肉碱;C5∶1:戊烯酰肉碱;C5-OH:羟戊酰肉碱;C6:己酰肉碱;C6DC:己二酰肉碱;C8:辛酰肉碱;C10:癸酰肉碱;C10∶1癸烯酰肉碱;C10∶2:癸二烯肉碱;C12:月桂酰肉碱;C14:肉豆蔻酰肉碱;C14∶1:肉豆蔻烯酰肉碱;C14-OH:羟十四酰肉碱;C16:棕榈酰肉碱;C16∶1棕榈烯酰肉碱;C16-OH:羟棕榈酰肉碱;C18:硬酯酰肉碱;C18∶1:硬酯烯酰肉碱;C18-OH:羟硬酯酰肉碱
本研究也发现,青海地区汉、藏、回族新生儿的血氨基酸和肉碱水平存在差异,除精氨酸外,其余代谢指标水平均表现为少数民族高于汉族,考虑与少数民族人群喜食牛、羊肉等饮食习惯有关。目前国内有关串联质谱IMD筛查的cut-off值尚未建立统一的实验室标准,不同地区人群的遗传及环境背景存在差异,应建立适合本地区人群的正常参考范围,以最大程度的降低假阳性率、提高阳性预测值。
新生儿机体代谢谱的变化受到环境、饮食、药物、生理状态、代谢等因素的影响,因此串联质谱技术诊断需定期随访检测代谢物的变化,并结合基因手段或尿气相色谱质谱等技术确诊。基于NGS的新生儿基因Panel检测技术,覆盖面广、不完全依赖于典型的临床表现,可以避免新生儿喂养、代谢及疾病等状况的干扰,通过明确致病基因,可以对疾病进行分子分型。质谱检测+NGS较单纯质谱检测可以更加快速全面确诊临床表现疑似IMD的高危新生儿,尽早实施个体化治疗,改善患儿预后[4]。本研究中,NGS最终确诊3例IMD。3例IMD在新生儿期均无明显临床症状,高苯丙氨酸血症如果能在新生儿期开始通过饮食控制治疗智能发育可接近正常人,而原发性肉碱缺乏症若早期治疗预后较好,可以逆转大部分症状,能避免给患儿家庭及社会带来不幸。
串联质谱检测技术只能对数十种IMD进行筛查,而目前已知IMD有数千种,大部分IMD不能通过质谱技术进行早期筛查。NGS不仅可以检测到串联质谱筛查疾病谱以外的单基因遗传病,而且通过算法优化,还能分析由基因组拷贝数异常导致的疾病,为出生缺陷患儿早诊断、早干预、早治疗提供临床依据。本研究中,NGS除了确诊了质谱筛查阳性的3例IMD,另检测到5例单基因突变及6例染色体拷贝数变异引起的遗传病,涉及耳聋、多发畸形,精神发育迟缓等多种方面。以表1中SLC26A4基因复合杂合突变耳聋为例(例7),该基因突变所致的听力障碍可以表现为迟发性,在新生儿期听力筛查正常。因此早期基因诊断对改善这部分患儿预后尤为重要,通过佩戴助听器或植入人工耳蜗在1岁以内最佳干预期给予患儿足够的声音刺激,能促进其听觉和语言中枢发育,使存在听力障碍的儿童恢复部分听力,或者做到聋而不哑,提高生活质量。另一方面通过NGS明确致病基因,可对家族中其他成员是否发生同样的病症做出风险评估,对于有再生育要求的夫妇可开展遗传咨询和产前诊断。
本研究串联质谱技术对正常新生儿进行普筛,联合NGS技术对筛查阳性及其他存在高危因素的新生儿进行基因诊断的模式,该模式不仅可以从基因水平确诊质谱筛查提示的阳性病例,还可以诊断质谱筛查阴性的其他新生儿遗传病,在疾病症状表现之前或表现轻微时,得以早发现、早控制、早治疗,对保障高海拔地区儿童健康、助力个性化治疗具有非常重要的意义,是现阶段在青海地区进行新生儿筛查的可行模式。在下一阶段工作中,可根据本研究中阳性患儿疾病谱特点,及其他遗传病基因致病位点携带情况,设计针对青海人群的基因检测小包,将检测基因数目控制在100个左右,降低检测成本,缩短报告周期,使NGS检测能得到更好的推广。另一方面还可利用该基因包对存在不良孕产史,或其他高危风险的夫妇开展携带者筛查,针对检测结果进行遗传咨询,加强孕前保健和宣教,进一步防止出生缺陷的发生,达到全面提高出生人口质量的目的。
本文不足与局限:①本研究筛查现场主要为青海省红十字医院,虽然还有西宁市的另外2家医院,海南州的3家,海东市的3家,虽然平均海拔3 000米以上,紫外线强、氧分压低(含氧量仅占平原的75%左右),但代表青海高海拔地区抽样不均衡;②筛查人群信息登记可能受不同医院信息采纳和收集能力所限会存在信息采集偏倚,如产前和围生期情况,查体、实验室和影像学检查等;③筛查高危人群的遴选是基于采集信息做出判断可能存在筛查高危人群判断偏倚;④本研究使用的串联质谱血氨基酸及肉碱检测的切值(cut-off值)是根据上海平原地区数万例正常新生儿检测值的0.5%~99.5%的CI计算得出,以此作为青海高海拔地区遗传代谢病筛查可能会更多出现假阳性病例。
