BDE-47对小鼠肝肾和脑氧化应激及炎症反应的影响
2019-12-16庄娟单群张子峰徐建明郑元林
庄娟 单群 张子峰 徐建明 郑元林

摘要:主要探讨了持续性有机环境污染物2,2′,4,4′-四溴联苯醚(2,2′,4,4′-tetrabromodiphenyl ether,BDE-47)对小鼠肝肾和脑组织氧化应激及炎症反应的毒性效应。将C57BL/6J小鼠分为4组,即对照组小鼠灌胃玉米油,低剂量组、中剂量组和高剂量组为对小鼠分别灌胃10、20、40 mg/kg BDE-47,每天处理1次,4、6、8周后称肝肾和脑组织湿质量并计算脏器系数,测定染毒8周后的小鼠肝肾和脑组织活性氧水平及炎症因子IL-6和TNF-α的表达情况。结果发现,BDE-47可造成肝脏脏器系数增大,肾脏和脑脏器系数减小,BDE-47可促进肝肾和脑组织活性氧堆积,炎症因子IL-6和TNF-α表达增强,这可能是造成这些组织损伤的重要机制。
关键词:BDE-47;肝脏;肾脏;脑;脏器系数;氧化应激;炎症反应;基因表达
中图分类号: X174文献标志码: A
文章编号:1002-1302(2019)19-0302-05
收稿日期:2018-07-09
基金项目:国家自然科学基金(编号:81171012、81570531、31200873);江苏高校品牌专业建设工程(编号:PPZY2015A018);江苏省高校自然科学基金(编号:18KJB330001)。
作者简介:庄 娟(1977—),女,江苏南通人,博士,讲师,主要从事环境毒理研究。E-mail:dajiangsky@163.com。
通信作者:郑元林,博士,教授,主要从事抗衰老的分子生物学机制研究。E-mail:zhengyl@jsnu.edu.cn。
多溴联苯醚(polybrominated diphenyl ethers,PBDEs)是一类重要的溴代阻燃物,广泛应用于电子设备、纺织品、塑料及建筑装潢材料中。PBDEs具有高脂溶性,降解周期长,生物蓄积性强,是一类潜在的持久性有机污染物(persistent organic pollutants,POPs)[1]。因为PBDEs与载体之间以非化学键相连,因此在使用和处置过程中,PBDEs会从产品中释放到环境介质中[2],可通过饮食、吸入和皮肤接触进入机体[3-4]。PBDEs含有209种同源物,其中BDE-47分布最广,在环境和人体样本中都有较高的检测水平[5-6]。毒理学研究发现,较其他PBDEs,BDE-47在体内代谢周期长,生物蓄积性更强[7],因此BDE-47的毒作用及毒性机制受到越来越多的关注。笔者之前的研究发现,BDE-47可造成肝肾和脑组织损伤[8-10],但具体的机制尚不清楚。
脏器系数是毒理学试验评价外源化学物对动物脏器受损的一项常用指标[8,11],氧化应激和炎症反应是造成组织损伤的重要机制[12-13],本试验采用10、20、40 mg/kg BDE-47对小鼠进行灌胃染毒,探究BDE-47对小鼠肝肾和脑组织脏器系数、氧化状态和炎症反应的影响。
1 材料与方法
1.1 试验动物
7周龄C57BL/6J小鼠40只,购于北京维通利华试验动物技术有限公司。小鼠饲养在温度为(22±1) ℃、湿度为(50±10)%、12 h光照/12 h黑暗的环境中,自由进水和食物。
1.2 试剂
BDE-47纯度大于99%,购于美国Chem. Service Inc.;活性氧测定试剂盒OxiSelectTM In Vitro ROS/RNS Assay Kit购于美国Cell Biolabs Inc.;Trizol试剂盒购至美国Invitrogen;TaKaRa反转录试剂盒和SYBR预混Ex Taq购于宝生物工程(大连)有限公司。
1.3 方法
BDE-47按相应染毒剂量溶解于玉米油。8周龄C57BL/6J小鼠分为4组,即玉米油对照组、低剂量组(10 mg/kg BDE-47)、中劑量组(20 mg/kg BDE-47)和高剂量组(40 mg/kg BDE-47),小鼠每天按相应剂量灌胃1次,连续灌胃4、6、8周,小鼠禁食过夜,于次日09:00—10:00间称体质量,麻醉并颈椎脱臼处死,迅速取出肝肾和脑组织并称质量,计算脏器系数(脏器系数=脏器质量/空腹体质量×100%,每组统计4~6个样本)。所有试验在2015—2016年于江苏师范大学江苏省药用植物生物技术重点实验室开展。
1.4 活性氧含量检测
活性氧(ROS)含量的测定方法按试剂盒说明书进行。小鼠在麻醉后冰上取出肝肾和脑组织,加入预冷的磷酸盐缓冲液(PBS,pH值7.2),低温超声匀浆后于4 ℃下以10 000 g转速离心10 min,取上清,测定活性氧含量。激发光波长 484 nm 和发射波长530 nm测定DCF的数量,根据DCF标准曲线进行样本ROS定量,表示为1 min 1 μg组织蛋白提取液生成的DCF量(nmol)。
1.5 定量实时聚合酶链反应
Trizol试剂盒购提取各组小鼠肝肾和脑组织总RNA,采用紫外分光光度法进行RNA定量。按照TaKaRa反转录试剂盒说明,取1 μg RNA为模板用于反转录互补DNA。TNF-α引物(5′-3′),CCAGACCCTCACACTCAGATCATC,引物(3′-5′),CCTTGAAGAGAACCTGGGAGTAGAC;IL-6引物(5′-3′),GTCCTTCCTACCCCAATTTCCAA,引物(3′-5′),GAATGTCCACAAACTGATATGCTTAGG。GAPDH为内参,均由生工生物(上海)股份有限公司合成。使用TaKaRa SYBR预混Ex Taq进行荧光定量实时PCR,每个样本设3个平行,检测mRNA含量。
1.6 统计方法
采用SPSS 11.5统计软件进行数据统计,试验数据采用One-Way ANOVA进行单因素方差分析,Tukeys显著性分析,其中P<0.05表示差异显著。
2 结果与分析
2.1 BDE-47对C57BL/6小鼠体质量及一般状况的影响
试验期间各组动物饮食、饮水等状况未见明显异常,动物无死亡。染毒4周,高剂量组小鼠活动性变差,皮毛凌乱,毛发无光泽;染毒6周,中剂量组小鼠皮毛光泽度变差。处理4、6、8周后对小鼠禁食后称质量,结果(表1)表明,BDE-47暴露对小鼠体质量无显著影响。
2.2 BDE-47对小鼠肝肾和脑组织质量的影响
处理4、6、8周后对小鼠进行解剖,各组小鼠肾脏和脑组织外观正常。染毒8周,高剂量组有3只小鼠肝脏表面可见灰白色斑点。随着BDE-47染毒剂量增大和染毒时间延长,解剖可见小鼠肝脏变大,双肾或单肾变小,脑组织变小。
2.2.1 肝脏湿质量及脏器系数
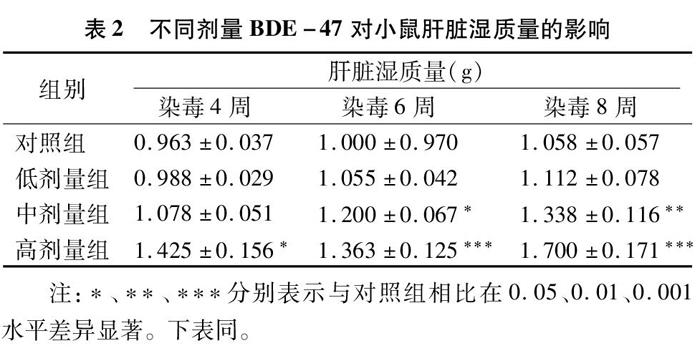
各组小鼠平均肝脏湿质量和脏器系数见表2和表3。染毒4周,与对照组相比,高剂量 BDE-47造成肝脏湿质量和脏器系数显著增加;染毒6周,与对照组相比,中剂量组、高剂量组小鼠肝脏质量和脏器系数分别在0.05、0.01水平上显著提高;随着染毒时间延长,肝脏增大现象更为严重,即染毒8周,中剂量组、高剂量组分别在0.01、0.001水平上显著提高。
2.2.2 肾脏湿质量及臟器系数
各组小鼠肾脏湿质量和脏器系数见表4和表5。染毒4周,BDE-47中剂量组小鼠双肾组织湿质量降低,高剂量组小鼠双肾组织湿质量增加,但与对照组相比差异均不显著;染毒8周,与对照组相比,BDE-
47高剂量组小鼠双肾组织湿质量和脏器系数分别在0.01、0.05水平上显著降低。
2.2.3 脑湿质量及脑脏器系数
表6显示,染毒4周,各组小鼠平均脑湿质量无显著差异。随着染毒时间延长和染毒剂量增加,小鼠脑平均湿质量降低。其中,与对照组相比,染毒6周的高剂量组小鼠脑湿质量在0.01水平上显著降低;染毒8[CM(25*8]周,中剂量组、高剂量组分别在0.05、0.001水平上显著降低。进一步统计脑脏器系数,其结果见表7。染毒6周,造成小鼠脑脏器系数下降,但与对照组相比差异不显著。染毒8周,与对照组相比,中剂量组、高剂量组小鼠脑脏器系数分别在0.05、0.01水平上显著降低。
2.3 BDE-47对小鼠肝肾和脑组织活性氧含量的影响
染毒8周后,检测各组小鼠肝脏、肾脏和脑组织活性氧(ROS)含量,结果见图1。与对照组相比,低剂量BDE-47对小鼠肝肾和脑组织ROS含量影响不显著;中剂量组小鼠肝脏和脑组织ROS显著堆积(P<0.001);高剂量组小鼠肝肾和脑组织ROS含量显著增加(P<0.001)。
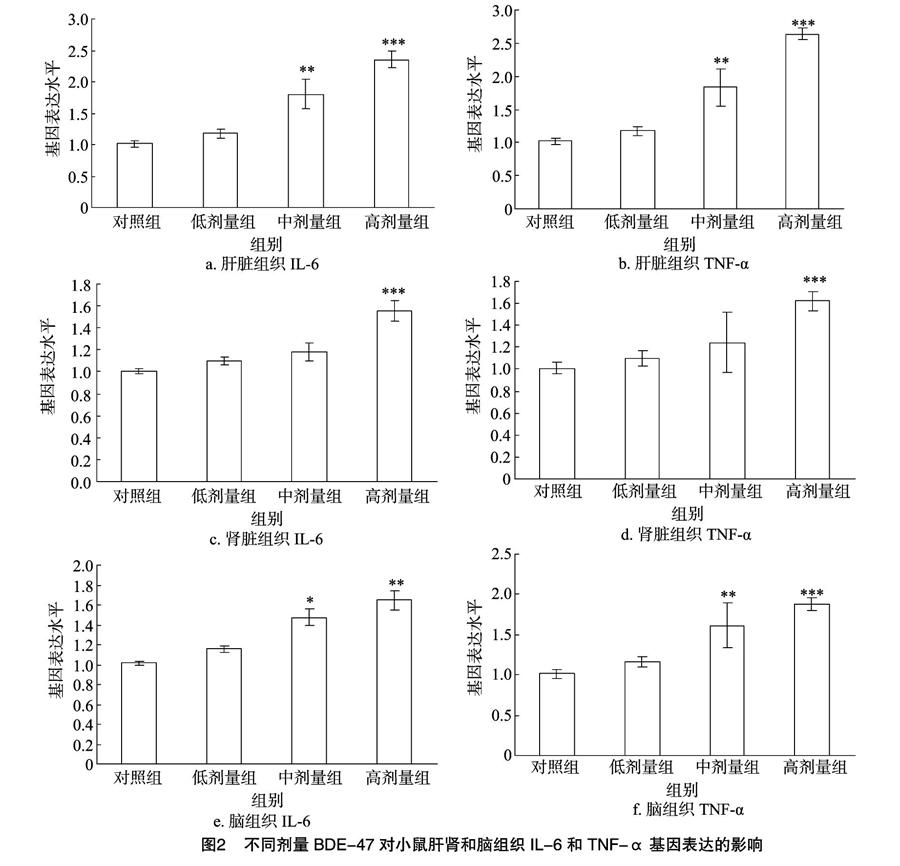
2.3 BDE-47对小鼠肝肾和脑组织IL-6和TNF-α基因表达的影响
染毒8周后,检测各组小鼠肝肾和脑组织进行IL-6和TNF-α基因表达情况,结果见图2。与对照组相比,低剂量BDE-47对小鼠肝肾和脑组织IL-6和TNF-α基因表达影响不显著。随着BDE-47暴露剂量增加,与对照组相比,IL-6和TNF-α基因在肝脏组织(中剂量组、高剂量组在 0.01 水平)、肾脏组织(高剂量组在0.001水平)和脑组织(IL-6,中剂量组、高剂量组在0.05、0.01水平;TNF-α,低剂量组、高剂量组在0.01)中表达显著增加。
3 讨论与结论
早期研究者使用 14C标记的方式检测了BDE-47灌胃后在小鼠和大鼠机体内的分布情况。结果显示,BDE-47主要分布于脂肪组织,其次是肝肾等组织。此外,BDE-47可以通过血脑屏障分布至脑[14-15]。经检测,浙江电子垃圾拆解区癌症患者肝肾组织中含有较高的BDE-47[16]。该地区居民肾损伤分子β2微球蛋白含量和BDE-47呈正相关[17]。此外,尸检脑样本中可检测出7种PBDEs,其中BDE-47含量最高[18]。这些试验结果说明BDE-47可影响肝肾和脑组织。
本试验结果表明,BDE-47可影响肝肾和脑组织。脏器系数常被用来评价外源化学物对动物脏器的损害[8]。慢性BDE-47暴露可造成小鼠肝脏质量增加,脏器系数增加;肾脏和脑组织质量减少,脏器系数减小。笔者之前的试验发现,8周龄ICR小鼠接受150 mg/kg BDE-47处理12周后出现肝脏氧化损伤,肝脏脏器系数增加[19]。与本试验结果相比,染毒剂量大,说明C57BL/6小鼠的肝脏对BDE-47影响的敏感性较强。目前还没有文献报道BDE-47对肾脏脏器系数的影响。笔者发现,40 mg/kg BDE-47处理8周后可引起小鼠双肾湿质量和脏器系数下降;但与肝脏相比,引起肾脏湿质量变化的BDE-47剂量大,作用时间长;此外,BDE-47导致脑组织湿质量减轻的有效剂量为20 mg/kg,且须处理8周,说明不同组织对BDE-47反应存在差异。
虽然BDE-47的毒性机理尚不清楚,氧化应激被认为是BDE-47引起组织损伤的一个重要原因[20]。氧化应激与细胞内ROS含量升高有关。Reistad等首次报道了BDE-47会引起人中性粒细胞ROS含量升高[21]。ROS是细胞有氧代谢的副产物,当ROS含量水平超过细胞抗氧化能力时就会对细胞产生毒害,造成细胞内DNA、蛋白质和膜脂损伤。本研究进一步的检测结果显示,BDE-47可造成肝肾和脑组织ROS堆积,肝脏和脑组织对BDE-47诱导的氧化压力较肾脏组织敏感。笔者之前发现,150 mg/kg BDE-47处理12周可造成ICR小鼠肝脏氧化损伤[8]。而本试验诱导肝脏氧化应激所需的BDE-47剂量小、时间短,该结果与BDE-47对小鼠脏器系数的影响一致,进一步说明了C57BL/6J小鼠肝脏对BDE-47具有较强的敏感性。之前的文献报道,小鼠出生后第10天接受10 mg/kg BDE-47灌胃处理后,脑组织会出现氧化应激[20]。代谢动力学的证据表明,乳鼠BDE-47的代谢能力较成年鼠差,并且发育中的脑组织对外源化学物的敏感性较强[7]。因此,本研究中引起脑组织氧化应激的BDE-47有效剂量相对较高,为20 mg/kg。
炎癥反应在外源化学物造成组织损伤中扮演重要角色[22],当氧化压力增强时会引发炎症反应[23]。体外试验证明,BDE-47可诱导人早孕绒毛外滋养细胞HTR-8/SVneo炎症因子IL-6释放[24],但关于BDE-47诱导机体炎症反应的研究较少。笔者之前用150 mg/kg BDE-47慢性处理ICR小鼠发现,可促进小鼠肝脏炎症因子表达,导致肝脏炎症损伤[19]。本试验结果与此一致,证明BDE-47可诱导小鼠肝脏组织炎症反应,但较ICR小鼠,C57BL/6J品系小鼠肝脏对BDE-47的炎症反应更为敏感。此外笔者还发现,BDE-47可引发肾脏和脑组织IL-6和TNF-α基因表达增强。相对于肝脏和脑组织,引发肾脏炎症反应的BDE-47有效剂量较高。
本试验以C57BL/6J小鼠为对象,评价了慢性BDE-47暴露对肝肾和脑组织脏器系数的影响,初步揭示了BDE-47对这些组织的毒性作用。BDE-47可能通过引发氧化应激,诱导炎症反应,毒害肝肾和脑组织,具体的毒作用机制有待进一步深入研究。
参考文献:
[1]Vorkamp K,Thomsen M,Frederiksen M A,et al. Polybrominated diphenyl ethers (PBDEs) in the indoor environment and associations with prenatal exposure[J]. Environment International,2011,37(1):1-10.
[2]Alaee M,Arias P,Sjdin A,et al. An overview of commercially used brominated flame retardants,their applications,their use patterns in different countries/regions and possible modes of release[J]. Environment International,2003,29(6):683-689.
[3]Lorber M.Exposure of americans to polybrominated diphenyl ethers[J]. Journal of Exposure Science and Environmental Epidemiology,2008,18(1):2-19.
[4]Jiang H,Lin Z,Wu Y,et al. Daily intake of polybrominated diphenyl ethers via dust and diet from an e-waste recycling area in China[J]. Journal of Hazardous Materials,2014,276:35-42.
[5]Lupton S J,McGarrigle B P,Olson J R,et al. Human liver microsome-mediated metabolism of brominated diphenyl ethers 47,99 and 153 and identification of their major metabolites[J]. Chemical Research in Toxicology,2009,22(11):1802-1809.
[6]Jiang H,Lin Z,Wu Y,et al. Daily intake of polybrominated diphenyl ethers via dust and diet from an e-waste recycling area in China[J]. Journal of hazardous materials,2014,276:35-42.
[7]Staskal D F,Diliberto J J,Birnbaum L S.Impact of repeated exposure on the toxicokinetics of BDE 47 in mice[J]. Toxicological Sciences,2006,89(2):380-385.
[8]Zhang Z F,Shan Q,Zhuang J,et al. Troxerutin inhibits 2,2′,4,4′-tetrabromodiphenyl ether (BDE-47)-induced hepatocyte apoptosis by restoring proteasome function[J]. Toxicology Letters,2015,233(3):246-257.
[9]Shan Q,Zhuang J,Zheng G H,et al. Troxerutin reduces kidney damage against BDE-47-induced apoptosis via inhibiting NOX2 activity and increasing Nrf2 activity[J/OL]. Oxidative Medicine and Cellular Longevity,2017:6034692. (2017-10-15)[2019-03-10]. http://europepmc.org/abstract/MED/29163754.
[10]Zhuang J,Wang S,Shan Q,et al. Adeno-associated virus vector-mediated expression of DJ-1 attenuates learning and memory deficits in 2,2′,4,4′-tetrabromodiphenyl ether (BDE-47)-treated mice[J]. Journal of Hazardous Materials,2018,347:390-402.
[11]Zhuang J,Wen X,Zhang Y Q,et al. TDP-43 upregulation mediated by the NLRP3 inflammasome induces cognitive impairment in 2 2′,4,4′-tetrabromodiphenyl ether (BDE-47)-treated mice[J]. Brain Behavior and Immunity,2017,65:99-110.
[12]Roy S,Benz F,Alder J,et al. Down-regulation of miR-192-5p protects from oxidative stress-induced acute liver injury[J]. Clinical Science,2016,130(14):1197-1207.
[13]Glass C K,Saijo K,Winner B,et al. Mechanisms underlying inflammation in neurodegeneration[J]. Cell,2010,140(6):918-934.
[14]Orn U,Klasson-Wehler E.Metabolism of 2,2′,4,4′-tetrabromodiphenyl ether in rat and mouse[J]. Xenobiotica,1998,28(2):199-211.
[15]Sanders J M,Chen L J,Lebetkin E H,et al. Metabolism and disposition of 2,2 ′,4,4 ′-tetrabromodiphenyl ether following administration of single or multiple doses to rats and mice[J]. Xenobiotica,2006,36(1):103-117.
[16]Zhao G F,Wang Z J,Zhou H D,et al. Burdens of PBBs,PBDEs,and PCBs in tissues of the cancer patients in the e-waste disassembly sites in Zhejiang,China[J]. Science of the Total Environment,2009,407(17):4831-4837.
[17]Xu P,Lou X,Ding G,et al. Effects of PCBs and PBDEs on thyroid hormone,lymphocyte proliferation,hematology and kidney injury markers in residents of an e-waste dismantling area in Zhejiang,China[J]. Science of the Total Environment,2015,536:215-222.
[18]Mitchell M M,Woods R,Chi L H,et al. Levels of select PCB and PBDE congeners in human postmortem brain reveal possible environmental involvement in 15q11-q13 duplication autism spectrum disorder[J]. Environmental and Molecular Mutagenesis,2012,53(8):589-598.
[19]Zhang Z F,Zhang Y Q,Fan S H,et al. Troxerutin protects against 2,2′,4,4′-tetrabromodiphenyl ether (BDE-47)-induced liver inflammation by attenuating oxidative stress-mediated NAD+-depletion[J]. Journal of Hazardous Materials,2015,283:98-109.
[20]Costa L G,Pellacani C,Dao K,et al. The brominated flame retardant BDE-47 causes oxidative stress and apoptotic cell death in vitro and in vivo in mice[J]. NeuroToxicology,2015,48:68-76.
[21]Reistad T,Mariussen E.A commercial mixture of the brominated flame retardant pentabrominated diphenyl ether (DE-71) induces respiratory burst in human neutrophil granulocytes in vitro[J]. Toxicological Sciences,2005,87(1):57-65.
[22]Phillips M C,Dheer R,Santaolalla R A,et al. Intestinal exposure to PCB 153 induces inflammation via the ATM/NEMO pathway[J]. Toxicology and Applied Pharmacology,2018,339:24-33.
[23]Mittal M,Siddiqui M R,Tran K,et al. Reactive oxygen species in inflammation and tissue injury[J]. Antioxidants and Redox Signaling,2014,20(7):1126-1167.
[24]Park H R,Kamau P W,Loch-Caruso R.Involvement of reactive oxygen species in brominated diphenyl ether-47-induced inflammatory cytokine release from human extravillous trophoblasts in vitro[J]. Toxicology and Applied Pharmacology,2014,274(2):283-292.
