猪日本乙型脑炎及猪细小病毒复合PCR检测方法的建立
2019-12-16吕玉金吴凤笋刘胜利李文刚
吕玉金 吴凤笋 刘胜利 李文刚


摘要:根据GenBank上登录的日本乙型脑炎病毒(Japanese encephalitis virus,JEV)与猪细小病毒(Porcine parvovirus,PPV)参考基因序列,设计合成2对特异性引物,在建立优化单项PCR检测方法的基础上,建立了PPV-JEV复合PCR检测方法,可扩增出预期的238 bp和152 bp特异性片段。该方法敏感性高、稳定性好、特异性强,临床样品检测结果与单项PCR检测结果符合率100%,该方法适合JEV和PPV的联合检测和鉴别诊断。
关键词:猪;日本乙型脑炎病毒;细小病毒;复合PCR
中图分类号:S852.65 文献标志码: A
文章编号:1002-1302(2019)19-0176-03
收稿日期:2018-07-20
基金项目:河南牧业经济学院预防兽医学重点学科建设项目(编号:MXK2016102)。
作者简介:吕玉金(1984—),女,河南商丘人,硕士,讲师,主要从事动物传染病发病机理及防制研究。E-mail:272166760@qq.com。
通信作者:李文刚,博士,教授,主要从事动物传染病防控研究。E-mail:wengang-li@126.com。
随着我国养猪业的发展,猪病呈现多病原混合感染或继发感染的现象[1]。流行性日本乙型脑炎(Japan eseencephalitis,JE)又叫日本乙型脑炎,简称乙脑,是由日本乙型脑炎病毒(JEV)引起的一种重要的人兽共患传染病,猪群最易感,妊娠母猪主要表现为流产、高热、死胎和木乃伊胎,公猪表现为睾丸炎,被世界卫生组织列为需要重点控制的传染病之一[2-3]。猪细小病毒病是由猪细小病毒(Porcine parvovirus,PPV)引起的猪繁殖障碍性疾病,该病主要感染初产母猪,临床表现为胎儿和胚胎的感染和死亡。血清学阴性的母猪主要在怀孕前半期通过口鼻感染病毒,病毒大量繁殖后可引发母猪的病毒血症并且随血液循环到达胎盘传染给胎儿,形成垂直传播[4]。该病在我国多发生于4—10月,猪感染后可终生带毒,全场猪在短时间内即可感染本病。猪在感染PPV后的1~6 d内会出现病毒血症现象,3~7 d内即可经粪便排毒,1周后可以检测到相应抗体[5]。母猪感染PPV后,病毒主要分布于机体内一些快速增生的组织(例如淋巴结生发中心、结肠固有层、肾间质等)[6]。研究表明,PPV仅会在活的猪胚胎中复制,感染胚胎一旦死亡就会被母体重吸收,病毒则无法在母体子宫内传播扩散,若感染胚胎存活,则会在子宫内传播病毒,致使同窝的其他胎儿也发生感染[7]。
JEV、PPV感染都可造成母猪繁殖障碍性疾病,检测这2种病毒有多种方法,包括病毒的分离鉴定、酶联免疫吸附试验和免疫荧光试验等,但都存在敏感性低、特异性差等缺陷[8]。近年来,聚合酶链式反应(PCR)因其特异性好,灵敏度高,被广泛应用于各种病原的检测,尤其是多重PCR,比常规PCR更高效,目前研究较多[9]。为快速鉴别诊断这2种病毒病,本研究旨在建立JEV-PPV复合PCR方法,并将该方法初步应用于临床样品检测。
1 材料与方法
1.1 病毒
JEV疫苗株、PPV疫苗株及实验室保存的疑似感染JEV、PPV的病料。病料采取自河南某养猪场的疑似感染JEV、PPV病死豬的肝脏、脾脏、肺脏和淋巴结等9份病料,每头猪的各种组织混合为1份病毒。
1.2 主要试剂
Ezup柱式病毒DNA抽提试剂盒、Taq DNA聚合酶,购自上海生物工程公司;HipureViralRNASpinKit试剂盒、M-MLV H-First Sand Sythesis Kit试剂盒,购自Magen公司;DL500 DNA Marker,购自宝生物工程(大连)有限公司等。
1.3 方法
1.3.1 病毒DNA的提取及检测
应用Sangon Biotech的Ezup柱式病毒DNA抽提试剂盒提取PPV病毒DNA,按照试剂盒标准抽提步骤进行,其中溶液A在65 ℃预热后沉淀溶解完全后使用,最后用100 μL经65 ℃预热的ddH2O洗脱。用超微量紫外分光光度计对所提取DNA的浓度进行检测。
1.3.2 病毒RNA的提取、检测及反转录
采用Magen公司的HipureViralRNASpinKit试剂盒提取JEV的RNA,严格按照试剂盒的操作步骤进行。Carrier RNA固体在使用前须用DEPC水溶解完全,浓度为1 μg/μL,注意分装保存。另外,Buffer VHB、Buffer RW2用前必须用无水乙醇稀释。最后采用100 μL DEPC水洗脱,并使用超微量紫外分光光度计进行RNA浓度的测定。
然后利用Magen公司的M-MLV H-First Sand Sythesis Kit试剂盒将提取的RNA进行反转录。取适量RNA溶液,依次加入适量RNA溶液、0ligo (dT)1 μL,dNTPs 1 μL,DEPC水补足至13 μL,经过孵育冰上冷却后,再加入5×First Stand Buffer 4 μL,0.1 M DTT 1 μL,M-MLV RNase HRT 1 μL,RNase Ihibior(40 U/μL)1 μL,离心,反应45 ℃ 30 min,85 ℃ 10 s后瞬离,将产物立即放置-20 ℃保存备用。
1.3.3 引物的设计和合成
根据GenBank公布的PPV和JEV的全基因序列,按照引物设计原则设计、选择引物,并对其特异性进行鉴定,均具有良好的特异性。引物由宝生物工程(大连)有限公司合成,引物设计见表1。
1.3.4 单项PCR反应体系的建立 单项PCR反应体系见表2。
94 ℃预变性5 min;94 ℃变性1 min,梯度退火温度(49.5、507、52.9、54.1、55.4、57.8、587、59.9 ℃)下30 s,72 ℃ 延伸1 min,35个循环;72 ℃延伸10 min。经1.5%琼脂糖凝胶电泳检测,确定最佳退火温度。
1.3.5 复合PCR反应体系的建立
在单项PCR的基础上,建立多重PCR反应体系(表3)。
94 ℃预变性5 min;94 ℃变性1 min,梯度退火温度(49.5、50.7、52.9、54.1、55.4、57.8、58.7、59.9 ℃)下30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min。经1.5%琼糖凝胶电泳检测,确定最佳退火温度。
1.3.6 敏感性试验
将病毒模板进行10倍系列稀释,以ddH2O为模板作为为阴性对照,进行单项和多重PCR扩增,以其模板最高稀释倍数扩增呈阳性为其PCR的敏感度。
1.3.7 特异性试验
分别以PPV、JEV、猪瘟病毒(CSFV)和猪伪狂犬病毒(PRV)基因组为模板,以ddH2O为模板作为阴性对照,应用复合PCR方法进行扩增,电泳,验证其特异性。
1.3.8 稳定性试验
对PPV和JEV重复检测5次,以验证该方法的稳定性。
1.3.9 临床样品检测
应用建立的单项PCR与多重PCR方法,检测实验室保存的9份疑似感染PPV和JEV的病料,比较两者检测结果的符合率。
2 结果
2.1 DNA的检测结果
提取的PPV的DNA浓度为141.9 ng/μL,D260 nm/D280 nm为1.91,比值在1.8~2.0 之间,表明提取的基因组DNA质量非常好。
2.2 RNA的检测结果
提取的JEV的RNA浓度为1 325.6 ng/μL,D260 nm/D280 nm为1.94,表明提取的RNA质量非常好。
2.3 PPV和JEV的单项PCR扩增结果
电泳结果显示,PPV和JEV分别扩增出152、238 bp的片段。PPV单项PCR的最佳退火是57.8 ℃,JEV单项PCR的最佳退火温度是58.7 ℃,见图1和图2。
2.4 复合PCR扩增结果
电泳结果(图3)显示,PPV和JEV的最佳退火温度是54.1 ℃。
2.5 敏感性试验
电泳结果(图4)显示,可检测到PPV和JEV的稀释浓度分别为10-7、10-5。
2.6 特异性试验
由图5可知,电泳结果显示,PPV和JEV可扩增出目的条带,而CSFV和PRV则没有产生,说明该方法特异性良好。
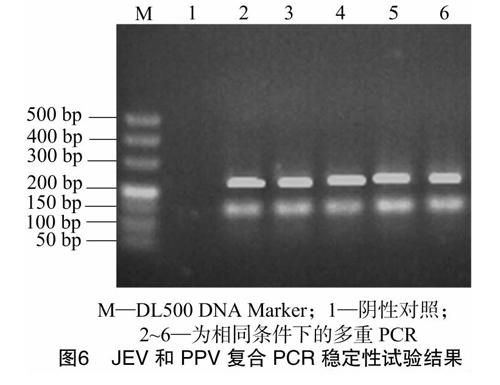
2.7 稳定性试验
以建立的多重PCR方法对PPV和JEV重复检测5次。由图6可知,5次的检测结果一致,说明该方法稳定性较好。
2.8 临床样品检测
利用建立的复合PCR方法对9份临床样品进行检测,然后使用同样的特异性引物进行单项PCR检测,结果显示两者结果符合率100%(表4)。
3 讨论与分析
目前,国内外发生的动物病毒病或一个征候群的疫病多同时涉及DNA和RNA两类病毒[10]。本研究从感染PPV和JEV[CM(24*8]的病死猪组织中提取了DNA和RNA,且在紫外线波长260 nm和280 nm处的比值均在1.8和2.0之间,符合纯的DNA D260 nm/D280 nm的值为2.0、纯的RNA D260 nm/D280 nm的值为1.8的要求[11]。
在多重PCR反应过程中,引物的设计至关重要,它关系到多重PCR反应的成功与否。本试验针对PPV和JEV这2种常见病毒的保守基因分别设计2对特异性引物,应用DNAstar软件进行综合分析,结果显示,2对特异性引物较好且同源性较低,各扩增片段相差不大,可在同一种浓度的电泳胶下进行。本试验设计的2对引物经试验验证,均是扩增效果较好的引物。
本研究在大量前期试验的基础上,首先确定了PPV和JEV单项PCR反应的最佳反应条件和反应程序,在此基础上摸索出了多重PCR的最佳反应条件,弥补了多重PCR因引物之间交叉干扰而导致敏感性降低的缺点。敏感性试验结果表明,该双重PCR具有较强的敏感性。本研究建立的PPV和JEV双重PCR检测方法,实现了这2种病毒的同步检测,为JEV和PPV感染的快速检测和流行病学调查奠定了基础。
参考文献:
[1]刘志杰,曾智勇,汤德元,等. 猪繁殖障碍病毒性疫病六重PCR检测方法的建立及应用[J]. 畜牧兽医学报,2012,43(9):1429-1436.
[2]邓绪芳,史子学,邱亚峰,等. 流行性乙型脑炎病原生态学的研究概况[J]. 动物医学进展,2011,32(2):111-114.
[3]张飞波. 科学防控猪繁殖障碍性疾病的方法[J]. 山东畜牧兽医,2009,30(9):28-29.
[4]魏潤生. 甘肃省规模化猪场4种病毒性繁殖障碍病的调查[D]. 兰州:甘肃农业大学,2005.
[5]陈世宝. 猪细小病毒病的诊断与防制[J]. 畜牧与饲料科学,2009,30(5):110-111.
[6]徐 峰,高炎坤,蔡 薇. 猪细小病毒的病源诊断与防制[J]. 吉林畜牧兽医,2005(4):36-38.
[7]吕惠序. 猪细小病毒病的危害及综合防制[J]. 养猪,2013(3):127-128.
[8]卜 丹. 河南省乙型脑炎病毒的分离鉴定及E基因进化分析[D].郑州:郑州大学,2010.
[9]Bellau-Pujol S,Vabret A,Legrand L,et al. Development of three multiplex RT-PCR assays for the detection of 12 respiratory RNA viruses[J]. Journal of Virological Methods,2005,126(1/2):53-63.
[10]Murdoch D R. Molecular genetic methods in the diagnosis of lower respiratory lower respiratory tract infections[J]. US National Library of Medicine National Institutes of Health,2004,112(11/12):713-727.
[11]刘维全. 动物生物化学实验指导[M]. 3版.北京:中国农业出版社,2014.
