氮磷添加对考来木光合特性和叶绿素荧光的影响
2019-12-16刘中华彭舜磊吕秀立
刘中华 彭舜磊 吕秀立


摘要:通过在土壤中添加12个梯度的氮(N)、磷(P)试验,研究氮、磷添加对考来木光合生理参数和叶绿素荧光参数的影响。结果如下表明,(1)单施P肥,考来木叶片叶绿素含量、净光合速率及荧光最大光化学效率Fv/Fm值等光合生产力指标整体上随着施P量的增加而下降,初始荧光Fo、非光化学淬灭系数NPQ等光能耗散指标则整体上随着施P量的增加而增加;(2)单施N肥,考来木叶片光合生产力指标大致随着施N量的增加而增加,光能耗散指标则大致随施N量的增加而降低;当施N量达到247.9 mg/kg后,光合生产力大致随着施N量的增加而下降,光能耗散指标大致随着施N量增加而上升;(3)同时增施N、P肥,施P效果大致随着施N量的增大而提高,而施N效果大致随着施P量的增大而先升后降,其中低N高P和低P高N处理均降低了考来木的光能利用率。在N2P1施肥组合下,考来木的光合生产力最高。上述结果表明,考来木对P反应敏感且需求量低,在低N土壤中增施P肥可降低考来木的光合生产力;若N、P肥同时增施,不仅可提高考来木叶片的光合生产力,且N、P肥可相互增效。研究探明了土壤N、P对考来木光能利用率的影响,为土壤-植物养分循环理论的丰富与发展贡献了微薄的力量,同时为考来木的栽培管理提供了理论依据。
关键词:叶绿素荧光;考来木;氮磷添加;光合生理;土壤-植物养分循环
中图分类号: S685.01文献标志碼: A
文章编号:1002-1302(2019)19-0148-07
收稿日期:2018-06-17
基金项目:河南省科技攻关计划(编号:162120110070)。
作者简介:刘中华(1965—),女,河南潢川人,副教授,主要从事植物生理、园艺学方面的研究。E-mail:1098505701@qq.com。
氮(N)和磷(P)是限制生态系统中植物生长的关键养分因子,对植物的生长有十分重要的作用,能够影响生态系统的生产力和生态过程[1-2]。在自然生态系统中,植物的生长一般表现为N限制或者P限制或者N、P共同限制[3]。荣戗戗等研究表明,植物体内的N、P元素含量及N ∶P能充分反映土壤养分供应与植物养分需求的动态平衡,可表征土壤氮素或磷素对植物生长的限制[4]。氮、磷添加可调节土壤养分转化[5],提高植物的净初级生产力[6-7],但长期、连续、过量的氮、磷输入会降低植物的净光合速率和净初级生产力[8]。植物通常会对自身资源进行配置、补偿和平衡,以最大限度地减小环境变化对自身的不利影响[9]。因此,探索植物与环境之间的关系,研究土壤-植物相互作用及碳、氮、磷循环,一直都是生态学的研究重点,近年来被越来越多地关注[10]。作为植物对环境变化最敏感的器官,叶片的功能性状能快速、准确地反映植物对环境变化的响应与适应机制[11-12],是当前研究生态系统响应环境变化的重要方法和依据[13]。
考来木(Correa carmen)为芸香科考来木属常绿灌木,2010年上海市园林科学研究所首次将其从澳大利亚引入我国,作为园林植物进行栽培繁育。其株型密集、花朵繁多、花型奇特、芳香且多彩、花期长,具有较高的园林观赏价值,被誉为“冬之精灵”[14]。考来木的生态适应性很强,耐旱、耐寒、耐盐碱,作为生态修复的先锋种或园林绿化的主栽种而被广泛栽培,市场占有量与日俱增。但目前,有关考来木生态位及生态价值的研究尚无报道,仅有的研究成果主要集中在快速繁殖[15]和耐高温干旱[16]等逆境生理方面。为了深入探究作为生态修复先锋种的考来木对陆地生态系统物质化学循环的贡献,本研究根据12种土壤氮磷添加比例对考来木叶片的营养含量、光合生理指标和叶绿素荧光参数的影响,分析叶片性状与土壤N、P的化学计量特征的关系,以探讨考来木响应土壤养分的生理生态机制,为考来木的应用与推广以及植物响应环境变化的研究提供科学理论依据。
1 材料与方法
采用盆栽控制试验法。
1.1 供试材料
2年生红花考来木幼苗,栽于白色塑料盆中,每盆1株。花盆规格为12 cm×12 cm×9 cm(高×上口径×底径),每盆装干土量0.6 kg。盆土取自平顶山市新城区白龟山下0~20 cm 的表层土,黄棕壤,有机质含量为21.2 g/kg,速效氮含量为97.9 mg/kg,速效磷含量为16.3 mg/kg,速效钾含量为79.2 mg/kg,pH值为8.18。
氮肥采用川化集团有限责任公司生产的硝酸铵肥,含N量≥15%;磷肥采用北京康普汇维科技有限公司生产的磷酸二氢钠[NaH2(PO4)·2H2O],化学纯(98%)。
试验用水为平顶山市自来水公司提供的自来水,经四川优普超纯科技有限公司生产的UPT-II-20T UPT超纯水机进行超纯过滤后直接使用或贮存备用。
1.2 试验设计
1.2.1 土样处理
将取回的土置于温室试验区的水泥地面上风干、粉碎后,均匀地掺入K2SO4和FeSO4,以降低pH值并作为底肥,K2SO4掺入量(以纯钾计)为75 mg/kg(干土),FeSO4掺入量为(商品量)70 mg/kg(干土),将土壤pH值调节至7.0~7.5。
然后将土分成3堆,添加不同数量的磷肥[NaH2(PO4)·2H2O],分别称作P0、P1、P2处理。P0处理,不添加磷肥,试验中作为对照处理;P1处理,添加磷肥的量为36.3 mg/kg(干土);P2处理,添加磷肥的量为56.3 mg/kg(干土)。充分掺拌均匀,备用。
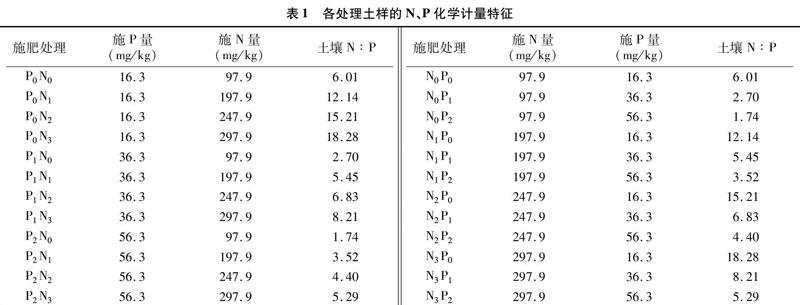
将P0、P1、P2处理分别分成4小堆,每小堆添加不同数量的氮肥(NH4NO3),分别称作N0、N1、N2、N3处理。N0处理,不添加N肥;N1处理,添加氮肥的量为197.9 mg/kg(干土);N2处理,N肥添加量为247.9 mg/kg(干土);N3处理,N肥添加量为297.9 mg/kg(干土)。12小堆即12个土样处理,分别编号为P0N0、P0N1、P0N2、P0N3、P1N0、P1N1、P1N2、P1N3、P2N0、P2N1、P2N2、P2N3,详见表1。
1.2.2 试验分组
在2016年2月24日,将配制好的土壤装入花盆,同时栽入考来木幼苗。每堆土壤分3批装盆,每批装3盆。将同批装的36盆作为1组,3批即3次重复,共108盆。幼苗上盆后浇透水,置于智能温室中生长。
1.3 测定指标及方法
1.3.1 土壤速效N、P含量的测定
取土样风干、粉碎、过 1 mm 孔筛,备用。
土壤速效N含量的测定:采用扩散吸收法。称取过筛土样2.00克,置于扩散皿的外室,均匀铺平;吸取2 mL H3BO3并加1滴定氮混合指示剂于扩散皿内室,盖严盖子。旋转数次后,转开盖子使扩散皿外室露出1条狭缝,迅速加入10 mL 1 mol/L NaOH溶液,立即盖严,放入40 ℃恒温箱中碱解扩散24 h。取出扩散皿,用0.005 mol/L H2SO4标准液滴定内室的吸收液,记录酸用量。由公式(1)计算速效N含量:
速效N含量(mg/kg)=D×14.0×103×(V-V0)/m。(1)
式中:D为H2SO4标准液的浓度,mol/L;V为滴定样品用的H2SO4标准液体积,mL;V0为滴定空白用的H2SO4标准液体积,mL;m为土样质量,g。
土壤速效P含量的测定:采用钼锑抗混合液分光光度法。称取过筛土样5.00 g置于三角瓶,加入0.5 mol/L NaHCO3溶液100 mL(pH值为8.5),振荡浸提30 min,过滤。吸取滤液 10 mL 于50 mL容量瓶中,加钼锑抗混合显色剂5 mL,静置显色30 min后,在722型分光光度计中用波长660 nm(光电比色计用红色滤光片)比色,读出吸光度。利用公式(2)计算速效P含量:
速效P含量(mg/kg)=(250×C)/m。(2)
式中:C=(D-0.008)/0.499 7,D为吸光度;m为土样质量,g。
1.3.2 叶片N、P含量及叶绿素含量的测定
分别于2016年3月20日、6月20日、9月20日,采摘考来木枝条的健康功能叶,保湿避光处理并立即带回实验室,用去离子水清洗干净后,留少许进行叶绿素含量的测定,其余置于烘箱中在 80 ℃ 条件下烘干至恒质量,取出冷却、粉碎、过0.25 mm筛,备用。
叶片全N含量的测定:采用张薇等的凯氏定氮法[17]。称取过筛叶片样品0.200 0 g(精确至0.000 1 g),用H2SO4-HClO4在180 ℃条件下消煮1~1.5 h,冷却,过滤,置于 K-370 全自动凯氏定氮仪中加碱蒸馏3 min,用H3BO3吸收,用盐酸标准液滴定,以甲基红-溴甲酚绿混合指示剂指示终点。记录消耗盐酸的体积,用公式(1)计算叶片全氮含量。
叶片全P含量的测定:采用钼锑抗吸光光度法。称取过筛叶片样品0.25 g,采用H2SO4-HClO4消煮,冷却,过滤,定容,得消煮液(V1,mL)吸取澄清液5.00 mL(V2,含P量5~30 μg)于50 mL容量瓶中,用水稀释至约30 mL,滴加酚指示剂、NaOH溶液和1/2 H2SO4溶液,调节溶液至黄色刚刚褪去,然后加入钼锑抗显色剂 5.00 mL(V3),在室温高于 15 ℃ 的条件下放置30 min,用1 cm光径比色槽在波长 700 nm 处测定吸光度。根据吸光度,采用公式(2)计算叶片全P的含量。
CP =1 000×[C×V3×(V1/V2)]/(m×106)。(3)
式中:CP为叶片P含量,mg/g;C为从标准曲线中查得的显色液中的P含量,mg/L;m为叶样质量,g。
叶绿素含量的测定:采用孙俊宝等的方法[18],即用丙酮乙醇混合液浸提、分光光度计测定吸光度的方法。将80%丙酮、95%无水乙醇按1 ∶1的比例配成混合浸提液;将新鲜、洗净的叶片剪成细丝,称取0.1 g置于含有浸提混合液的試管中,加塞放于暗处,于室温下浸提直至叶丝完全变白。然后,利用分光光度计分别测定浸提液在波长663、645 nm处的吸光度,根据公式(3)、(4)、(5)分别求出叶绿素a、叶绿素b的含量和叶绿素总含量:
叶绿素a含量(mg/g)=(12.71D663 nm-2.59D645 nm)×V/(1 000×m);(4)
叶绿素b含量(mg/g)=(22.88D645 nm-4.67D663 nm)×V/(1 000×m);(5)
叶绿素总含量(mg/g)=(8.04D663 nm+20.29D645 nm)×V/(1 000×m)。(6)
式中:V为提取液的体积,mL;m为叶片质量,g;D663 nm、D645 nm分别为663、645 nm处的吸光度。
1.3.3 光合生理与叶绿素荧光参数的测定 光合生理指标的测定。选择考来木枝条中部的健康功能叶,采用美国CIRAS-3便携式光合作用测定系统,测定其净光合速率Pn[μmol/(m2·s)]、气孔导度Gs[mol/(m2·s)]、胞间CO2浓度Ci(μmol/mol)、蒸腾速率Tr[mmol/(m2·s)]、光合有效辐射PAR[μmol/(m2·s)]、空气相对湿度(RH)等光合生理指标,每株测定3张叶片,取其平均值。光合测定时,将仪器连接好后按“on”开机,按“F2”进入设置界面,设置参数:叶室窗口为长方形,18 mm×25 mm;光源为发光二极管(LED),红光,光照度为100 μmol/(m2·s);控制参比CO2浓度为 390 μmol/mol;控制参比空气湿度为80%~100%。
叶绿素荧光参数的测定。利用德国WALz公司的Imaging PAM-2500调制式叶绿素荧光仪,参照付为国等的方法[19]:测试前先将叶片进行 30 min 的暗处理,然后把叶片夹入叶绿素荧光仪中,开启仪器,由仪器自动陆续打开调制测量光(measuring light,简称ML)和饱和脉冲光(saturation pulse,简称SP),测得叶片的叶绿素最小荧光(暗)Fo、最大荧光(暗)Fm以及PSⅡ最大光化学效率Fv/Fm;然后开启 580 μmol/(m2·s) 的光化光(actinic light,简称AL),进行叶绿素荧光动力学诱导荧光测试,每隔20 s开启1次饱和脉冲,从而获得饱和脉冲图像和一些叶绿素荧光参数如实际光化学效率Y(Ⅱ)、相对电子传递速率rETR、光化学淬灭系数qP和非光化学淬灭系数NPQ等系列参数。
1.4 数据处理和统计分析
试验数据的初步统计与整理、作图等均在软件Excel 2007中完成,数据的变异度方差分析与最小显著性差异法(LSD)多重比较则由软件SPSS 20.0完成。
2 结果与分析
2.1 考来木叶片N、P含量与土壤添加N、P肥量的关系
由图1可知,在相同水平的P肥添加量处理下,考来木叶片的N、P含量均随土壤添加N肥用量的增加而提高,呈显著(P<0.05)的正相关关系,不同处理间叶片的N含量差异显著(P<0.05),而叶片的P含量差异不显著。当土壤N肥添加量为N0水平时,叶片含N量随着土壤添加P肥量的增加而减小;当土壤添加N肥量为N1、N2水平时,叶片含N量随着土壤添加P肥量的增加而增加;当土壤添加N肥量为N3水平时,叶片含N量随着P肥添加量的增加而呈现先增后降的趋势。叶片含P量随着土壤添加P肥量的增大而增加,处理间差异显著。由此可以看出,增施N肥,不仅可以显著提高叶片中的N含量,还能提高叶片中的P含量;增施P肥,不仅可以显著提高叶片中的P含量,还能提高叶片中N的含量;N、P肥具有相互增效的生态效应。但过量施肥会引起N、P元素在植物体内累积而导致生长发育不正常。
由图1还可以看出,叶片中的N、P含量均呈现由春至夏增加、由夏至秋减少的趋势。春季(3月),叶片中的N含量平均为17.29 mg/g,夏季(6月)平均为19.60 mg/g,秋季(9月)平均为17.87 mg/g,春、夏、秋季差异显著;而叶片中的P含量,春季平均为0.84 mg/g,夏季平均为0.95 mg/g,秋季平均为0.82 mg/g,由春至夏P含量差异不显著,而由夏至秋P含量差异显著。结果表明,考来木体内N含量的季节变化明显,而体内的P含量相对稳定。相较于我国常见植物叶片的N含量20.24 mg/g、P含量1.12 mg/g的平均水平[21-24],考来木叶片的N、P含量偏低,差异显著;其中叶片的P含量达到极显著水平。
2.2 考来木叶片叶绿素含量与土壤N、P添加水平的关系
由图2可知,春、夏、秋各季节内,考来木叶片叶绿素含量受土壤N、P水平变化的影响是相同的:在土壤P肥添加量相同的4个N水平梯度的处理中,叶绿素含量由高到低的排序大致是N2、N3>N1>N0。如春季的P1处理下,N1、N2、N3处理的叶绿素含量分别比N0处理增加了16.69%、23.80%、 19.89%。在同一N肥添加量的3个施P处理中,叶绿素含量随着P肥添加量的提高而产生变化,施N水平不同,变化趋势不同。在N0水平下的3个P梯度处理中,叶绿素含量随着P肥添加量的增加而降低,如春季在N0水平下,P1、P2处理的叶绿素含量分别比P0处理降低了2.55%、5.70%。在N1、N2、N3的任一水平下,叶绿素含量均以P1处理最高,P2处理最低,P0处理居中,仅6、9月的P0N1处理例外。在春季的N1水平下,P1处理的叶绿素含量比P0处理提高了494%,而P2处理却比P0处理降低了2.88%。各季节考来木的叶绿素含量均以P1N2处理最高。以上结果表明,考来木的叶绿素含量受到N、P双因素的综合影响。
由图2还可看出,各处理的考来木叶片叶绿素含量,均呈现由春季至夏季增加、由夏季至秋季减少的趋势,且由春至夏的增幅显著大于由夏至秋的降幅。叶绿素含量的这一季节变化趋势与叶片N、P含量的季节变化趋势相同。经方差分析和LSD多重检验,土壤添加N、P量与考来木叶片的N、P含量及叶片的叶绿素含量呈显著的正相关关系。
總之,增施N肥可以提高土壤氮磷比,可显著提高考来木叶片的叶绿素含量;在低N的土壤条件下,增施P肥(即降低土壤氮磷比),考来木叶片的叶绿素含量下降;在高N的土壤条件下,增施P肥可提高考来木叶绿素含量,但进一步提高施P量,则叶绿素含量下降。说明考来木对P的需求量较小,提高土壤或叶片的N水平可加速考来木对P的吸收与代谢。
2.3 考来木叶片光合生理指标与土壤N、P添加水平的关系
由图3可知,考来木叶片的净光合速率Pn、气孔导度Gs和蒸腾速率Tr对土壤N添加水平或氮磷比水平的响应趋势一致,大都随土壤N添加水平的增加而先增后减,在N2水平达到最高值;而叶片细胞间CO2浓度Ci则随土壤N添加水平或氮磷比水平的增加而呈现持续增加的趋势,在N3水平达最高值。如在土壤添加P的量为P1的4个N添加量梯度的处理中,N1、N2、N3处理的叶片净光合速率Pn分别比N0处理高 7.46%、13.43%和11.19%,叶片气孔导度Gs分别增加了13.01%、31.51%和25.68%,叶片蒸腾速率Tr分别增加了10.96%、23.32%和21.14%;叶片细胞间CO2浓度Ci分别增加了6.21%、12.41%和15.17%。由此可见,考来木叶片的各项光合生理指标均与土壤N水平或土壤氮磷比水平呈显著的正相关关系。
P素对考来木叶片光合生理指标的影响与N不同。由图2可以看出,在N0水平下的3个水平梯度的P处理中,随着土壤P添加水平的提高即土壤氮磷比的下降,考来木叶片的净光合速率Pn、气孔导度Gs、胞间CO2浓度Ci均呈下降趋势;在N1、N2、N3任一水平下的3个土壤有效P梯度中,光合生理各项指标整体上均随土壤氮磷比的降低而呈现出先增加后降低的趋势,基本是P1处理最高,P2处理最低。如N2水平下,P1处理的Pn比P0处理增加了2.70%,而P2处理比P0处理降低了 2.07%。以上结果表明,在低N土壤条件下增施P肥即降低氮磷比,对考来木叶片的光合生理产生抑制效应;提高土壤N水平,P抑制现象缓解或消除,施P对光合生理产生促进效应;随着P水平的进一步提高,光合生理受抑制。总的看来,P对光合生理指标的影响受N水平的制约。经方差分析可知,土壤P水平的变化对考来木叶片净光合速率影响显著,对其他光合生理指标的影响未达到显著水平。
2.4 考来木叶片叶绿素荧光参数与土壤N、P添加水平的关系
由图4可知,在土壤添加P水平相同的4个N处理水平下,Fo随土壤氮磷比的增加而呈现先降低后增加的变化趋势,Fm呈现先增加后降低的变化趋势,Fv/Fm呈现与Fm相同的变化趋势。在P1水平下,N1、N2、N3处理的Fo分别比N0处理降低了19.57%、25.00%和10.87%,Fm分别增加了1484%、17.63%和13.49%,Fv/Fm分别提高了 10.90%、12.95%和8.17%。表明向土壤中添加N肥提高了氮磷比,可提高考来木的光化学效率潜能,若N肥添加过量(≥N3水平),Fo升高,表明光系统Ⅱ活性受抑制或受损伤。总体上,在适量施肥的基础上,N与考来木的光化学潜能呈正相关。
在N0水平的3个施P处理中,Fo随土壤氮磷比的降低而呈现持续增加的趋势,而Fm、Fv/Fm则呈现持续降低的趋势;P1、P2处理的Fo分别比P0处理增加了5.75%、11.49%,Fm分别降低了5.22%、8.41%,Fv/Fm分别降低了3.90%、7.33%;在N1处理下,Fo随着土壤氮磷比的降低而呈现先降低后增加的趋势,处理间差异不显著;在N1~N3处理下,Fm、Fv/Fm均呈现先升高后降低的趋势,其中不同处理的Fv/Fm间差异显著(图4)。
由图4还可看出,考来木叶片的qP、Y(Ⅱ)和NPQ随着土壤氮磷比的变化而呈现出不同的变化趋势:在N0水平下的3个P处理中,qP、Y(Ⅱ)均随着土壤速效氮磷比的降低而降低,NPQ随着土壤氮磷比的降低而增加。其中P1、P2处理的qP分别比P0处理下降了4.79%、10.28%,Y(Ⅱ)依次下降了6.22%、13.73%,而NPQ分别提高了4.19%、9.25%。很明显,土壤P水平的提高对考来木PSⅡ的光化学活性具有抑制作用。在N1~N3处理下,考来木叶片的qP均随着土壤氮磷比的降低而呈现出先增后降的变化趋势,最大值均出现在P1水平,在N1处理下考来木叶片的Y(Ⅱ)也表现出相似的规律;而NPQ随着土壤氮磷比的降低而呈现先降后增的变化趋势,最低值亦出现在P1水平。由此可以看出,提高土壤N水平,可以减弱P对考来木叶片光化学活性的抑制。
在不同水平的土壤P添加处理下,考来木叶片的qP、NPQ和Y(Ⅱ)均随土壤氮磷比的增加呈现出不同的变化趋势:在P0、P1水平下,qP、Y(Ⅱ)均随土壤氮磷比的增加而先增后减,且均在土壤N添加量为247.9 mg/kg的N2处理达最大值;而NPQ随土壤氮磷比的增加呈现出先降低后增加的变化趋势,最小值出现在N2处理;在P2水平下,qP、Y(Ⅱ)均随土壤氮磷比的增加而持续增加,而NPQ则随土壤氮磷比的增加而持续降低。
經方差分析和LSD显著性检验,土壤N、P化学计量特征对考来木叶片的各项叶绿素荧光产量均有显著影响。其中,考来木叶片的荧光产量及光化学效率,均在土壤N添加量为247.9 mg/kg、土壤P添加量为36.3 mg/kg、土壤氮磷比为683的P1N2处理下达到最高水平,可作为考来木栽培的理想土壤。
3 讨论
外源N、P的输入,在很大程度上改变了陆地生态系统中土壤N、P的可利用状态,从而对植物的初级生产力产生重要影响,因此施肥已成为一项促进植物生长的常规管理措施[20]。但过度施肥或不合理施肥则会使土壤-植被系统中营养元素失衡,造成土壤酸化或植物减产甚至受伤害[21-22]。N、P是植物光合器官建造必不可少的营养元素,叶片中N、P含量直接影响叶绿素水平和光合能力。有研究表明,叶中N、P含量与土壤N、P水平存在着显著的正相关关系[23-26]。本研究中,N1、N2、N3处理的光合性能及荧光产量整体上比N0处理依次提高,表明向土壤中添加氮肥或磷肥是提高植物光合性能和荧光产量的有效措施。
在N0处理下向土壤中添加P,植物体内P素累积水平较高,而无机P是1,5-二磷酸核酮糖羧化酶(RuBPCase)的1个竞争性抑制剂[27-28],高浓度的P可能抑制了RuBPCase的活性,使光合生产力下降或增强了光呼吸而使光合效率降低。因此,在N0处理下,叶片的光合生产力及荧光产能等大致随P素水平的提高而降低。而此时向土壤中添加N素,考来木的叶绿素合成增多,同时需要更多的P参与到光合器官的建造中,叶片中P的积累和抑制减弱或消除,光合生产力提高。但随着添加P素水平的进一步提高,考来木叶中又开始大量积累无机P而使光合性能降低。在N素的各个添加水平中,考来木的最大光合效率均出现在P1处理,说明N、P均具有促进考来木光合作用的效果,且二者具有相互增效的生态效应。因考来木对P的需求量较小或对土壤速效P反应敏感,易出现P抑制现象。
增施N肥可提高叶片中叶绿素的浓度,从而提高植物的光合生产力,这一点可用来解释考来木的荧光参数Fv/Fm值随土壤氮磷比的提高而先升高后降低的变化规律。Fv/Fm值是植物PSⅡ的最大量子产量,反映植物的最大光合能力或光合效率。土壤氮磷比的提高使得植物体内N素水平提高,从而加强了光合器官的建造和功能。但施N过多又会引起植物徒长,比如叶面积增大、叶片变薄等,使叶绿素含量降低,光能利用率下降;大量生长器官的建造,使C素的消耗增加,则光合效率下降。
初始荧光Fo一般较小且稳定,当植物遭受胁迫时,Fo升高;与此同时,Fv/Fm值显著下降。qP是由光合作用引起的荧光淬灭,反映了光合活性的高低;而Y(Ⅱ)反映的是PSⅡ的实际量子产量即实际光合产量[29]。本研究中,Fo随土壤P水平提高即氮磷比的降低而逐渐升高,Fv/Fm、qP和Y(Ⅱ)均持续降低,这从荧光的角度进一步表明,在土壤“低N”情况下增施P素,会造成考来木体内积累大量的无机P而产生“P胁迫”;提高土壤N水平,则“P胁迫”得以缓解或消除;N、P肥具有相互增效的生态效应。这与张玉斌等在玉米上的研究结果[30]相一致。
同时,NPQ的变化规律也可以用“P胁迫”来解释。众所周知,叶片所获取的光能,大部分用于光合作用,较少的光能以光的形式释放出来(即荧光);当光能过剩时,便以热能的形式(即NPQ)耗散掉。因此,NPQ可表达植物的光保护能力。本研究中,在低N土壤中添加P,考来木叶片中无机P累积而发生P胁迫,光化学淬灭即光合作用对光能的利用率降低,则更多的光能以非光化学淬灭即NPQ的形式耗散出来。此时提高土壤N水平,则NPQ下降。这可能是由于土壤N、P水平的提高,刺激了考来木叶片PSⅡ反应中心而使反应中心活性增强,电子传递速率增大进而使原初光能转换效率提高,即较多的光能用于光合作用,则光能的热耗散减少。
4 结论
增施N、P肥均能提高考来木叶片的叶绿素含量、净光合速率和光化学效率,但过量施肥会引起作物徒长或打破体内营养平衡而引起叶绿素含量降低,或使光系统中心受伤害。考来木对P的需求量小且反应敏感,在低N土壤中增施P肥会产生P胁迫而使作物生长发育受阻。试验条件下,P1 N2是考来木光合性能最优、光化学产量与效率最大化的土壤氮、磷添加组合,其化学计量特征是N含量为247.9 mg/kg,P含量为 36.3 mg/kg,土壤化学比氮碳比为6.83。
参考文献:
[1]Elser J J,Bracken M E,Cleland E E,et al. Global analysis of nitrogen and phosphorus limitation of primary producers in freshwater,marine and terrestrial ecosystems[J]. Ecology Letters,2007,10(12):1135-1142.
[2]Vitousek P M,Porder S,Houlton B Z,et al. Terrestrial phosphorus limitation:mechanisms,implications,and nitrogen-phosphorus interactions[J]. Ecological Applications,2010,20(1):5-15.
[3]张仁懿,徐当会,杨智永,等. 植物N ∶P化学计量特征对亚高寒草甸限制类型的指示作用研究[J]. 中国草地学报,2014,36(3):79-83.
[4]荣戗戗,刘京涛,夏江宝,等. 莱州湾湿地柽柳叶片N、P生态化学计量学特征[J]. 生态学杂志,2012,31(12):3032-3037.
[5]罗亲普,龚吉蕊,徐 沙,等. 氮磷添加对内蒙古温带典型草原净氮矿化的影响[J]. 植物生态学报,2016,40(5):480-492.
[6]杨晓霞,任 飞,周华坤,等. 青藏高原高寒草甸植物群落生物量对氮、磷添加的响应[J]. 植物生态学报,2014,38(2):159-166.
[7]陈慧敏,石福习,杨桂生,等. 养分添加对三江平原沼泽化草甸植物群落组成和地上生物量的影响[J]. 生态学杂志,2016,35(6):1440-1446.
[8]Hidaka A,Kitayama K. Divergent patterns of photosynthetic phosphorus-use efficiency versus nitrogen-use efficiency of tree leaves along nutrient-availability gradients[J]. Journal of Ecology,2009,97(5):984-991.
[9]白 雪,程军回,郑淑霞,等. 典型草原建群种羊草对氮磷添加的生理生态响应[J]. 植物生态学报,2014,38(2):103-115.
[10]韦莉莉,卢昌熠,丁 晶,等. 丛枝菌根真菌参与下植物-土壤系统的养分交流及调控[J]. 生态学报,2016,36(14):4233-4243.
[11]Li S,Liu W Y,Li D W. Bole epiphytic lichens as potential indicators of environmental change in subtropical forest ecosystems in southwest China[J]. Ecological Indicators,2013,29:93-104.
[12]Elumeeva T G,Onipchenko V G,Wu Y. Leaf functional traits of plants of alpine pastures at the Eastern Qinghai-Tibetan Plateau[J]. Moscow University Biological Sciences Bulletin,2015,70(1):46-52.
[13]盘远方,陈兴彬,姜 勇,等. 桂林岩溶石山灌丛植物叶功能性状和土壤因子对坡向的响应[J]. 生态学报,2018,38(5):1-8.
[14]吕秀立. 冬之精灵——考来木[J]. 园林,2011(6):76.
[15]呂秀立. 考来木离体培养及产业化研究[J]. 上海农业学报,2012,2(3):46-48.
[16]张志录,刘中华,陈明辉,等. 高温干旱胁迫下考来木幼苗的生理响应[J]. 北方园艺,2017(19):81-88.
[17]张 薇,付 昀,李季芳,等. 基于凯氏定氮法与杜马斯燃烧法测定土壤全氮的比较研究[J]. 中国农学通报,2015,31(35):172-175.
[18]孙俊宝,王建新. 樱桃叶绿素含量测定方法研究[J]. 山西农业科学,2010,38(3):18-19,33.
[19]付为国,王凡坤,赵 云,等. 土壤氮磷化学计量特征对小麦光合气体交换参数和叶绿素荧光参数的影响[J]. 西北植物学报,2016,36(7):1435-1442.[HJ1.7mm]
[20]李 曼,靳冰洁,钟全林,等. 氮磷添加对刨花楠幼苗叶片N、P化学计量特征的影响[J]. 应用与环境生物学报,2016,22(2):285-291.
[21]Wang C T,Long R J,Wang Q L,et al. Fertilization and litter effects on the functional group biomass,species diversity of plants,microbial biomass,and enzyme activity of two alpine meadow communities[J]. Plant and Soil,2010,331(1/2):377-389.
[22]Lieb A M,Darrouzet,Nardi A,et al. Nitrogen deposition decreases acid buffering capacity of alpine soils in the southern Rocky Montains[J]. Geoderma,2011,164(3/4):220-224.
[23]Bradshaw C,Kautsky U,Kumblad L. Ecological stoichiometry and multi-element transfer in a coastal ecosystem[J]. Ecosystems,2012,15(4):591-603.
[24]洪江濤,吴建波,王小丹. 藏北高寒草原紫花针茅根系碳氮磷生态化学计量学特征[J]. 山地学报,2014,32(4):467-474.
[25]李天平. 湘北丘陵区混交阔叶林不同树种土壤C、N、P生态化学计量学特征研究[D]. 长沙:中南林业科技大学,2015.
[26]Lu X T,Reed S C,Yu Q,et al. Nutrient resorption helps drive intra-specific coupling of foliar nitrogen and phosphorus under nutrient-enriched conditions[J]. Plant and Soil,2016,398(1/2):111-120.
[27]吴一群. 高磷对蔬菜生长的影响及其环境效应[D]. 福州:福建农林大学,2008.
[28]Yadav S,Irfan M,Ahmad A,et al. Causes of salinity and plant manifestations to salt stress:a review[J]. Journal of Environmental Biology,2011,32(5):667-685.
[29]石朝毅. 可变光脉冲诱导荧光浮游植物光合作用参数测量技术研究[D]. 北京:中国科学院大学,2014.
[30]张玉斌,曹庆军,张 铭,等. 施磷水平对春玉米叶绿素荧光特性及品质的影响[J]. 玉米科学,2009,17(4):79-81.
