盐胁迫对耐盐和盐敏感玉米幼苗生长和生理特性的影响
2019-12-16袁海何鹏飞武君洁吴毅歆李兴玉何鹏搏康志钰何月秋
袁海 何鹏飞 武君洁 吴毅歆 李兴玉 何鹏搏 康志钰 何月秋


摘要:为探究苗期玉米对盐胁迫的响应,采用不同浓度的NaCl溶液胁迫处理盐敏感性不同的玉米自交系N2553和N2521,测定玉米的型高、地上部鲜质量、根长、根鲜质量、叶片相对电导率、丙二醛含量、过氧化物酶活性。结果表明,在1.5% NaCl胁迫下,N2553的型高、地上部鲜质量、根长和根部鲜质量分别下降40.46%、58.57%、23.30%和37.75%,N2521相应地下降28.29%、38.52%、18.20%和28.54%;N2553叶片相对电导率、丙二醛含量和过氧化物酶活性分别上升48.08%、269.53%和75.18%,N2521相应地上升18.37%、178.80%和110.88%。在2.0% NaCl胁迫下,N2553的型高、地上部鲜质量、根长、根部鲜质量和叶片过氧化物酶活性分别下降62.81%、72.91%、33.17%、5029%和38.33%,N2521相应下降51.49%、60.40%、24.03%、42.63%和18.06%,N2553叶片相对电导率和丙二醛含量分别上升61.54%和697.26%,N2521相应地上升51.02%和516.41%。可见,不同浓度的NaCl胁迫对2个玉米自交系幼苗的各项指标有不同程度的抑制,盐胁迫对玉米地上部的抑制作用大于地下部,对N2553的抑制作用大于N2521。
关键词:盐胁迫;玉米;电导率;丙二醛;过氧化物酶
中图分类号: S513.01文献标志码: A
文章编号:1002-1302(2019)19-0086-03
收稿日期:2018-07-11
基金项目:云南省玉米产业体系项目(编号:2018KJTX002)。
作者简介:袁 海(1992—),男,安徽淮南人,硕士研究生,主要从事作物育种工作。E-mail:601125725@qq.com。
通信作者:康志钰,博士,副教授,主要从事小麦品质遗传与改良研究,E-mail:406457039@sina.com;何月秋,博士,教授,主要从事分子生物学研究,E-mail:ynfh2007@163.com。
土壤盐渍化是造成作物产量受损的重要因素之一。据统计,在世界范围内,约有9.5亿hm2的盐碱地,其中有 2.3亿hm2 是水浇地。由于受到盐害的影响,全球农业生产每年损失超过120亿美元[1]。土壤盐渍化会降低种子发芽率,推迟出苗时间,影响作物产量和品质,严重制约农业生产的发展。因此,盐碱地的治理和综合利用成为了近年来研究的热点,其中选育耐盐作物品种是最经济有效的手段之一,而对作物耐盐性的有效鉴定是选育耐盐作物品种的基础。
玉米是三大粮食作物之一,也是生产复合饲料的重要原料,在国民经济中占有重要地位。盐害是制约玉米稳产的重要因素之一。盐胁迫下作物体内电导率和丙二醛(MDA)含量增加,从而导致作物质膜损伤[2]。王婧泽等认为,在盐胁迫条件下,耐盐品种有较高的过氧化物酶(POD)活性和较低的MDA含量[3]。付艳等以株高及干质量变化率作为玉米耐盐性指标,对96个玉米品种进行耐盐性鉴定评价,结果表明,随着盐浓度增加,不同品种的株高和干质量变化率差异较大,并认为株高变化率在0~25%,干质量变化率在0~40%的品种为耐盐品种[4]。Cui等比较了盐胁迫对耐盐基因型玉米F63和盐敏感基因型玉米F35的影响,明确指出在盐胁迫下F63的鲜质量和相对含水量显着高于F35[5]。
作物耐盐性是多基因控制的复合遗传性状[6]。不同作物不同品种之间的耐盐性差异较大,耐盐机制也各不相同,因而不同作物不同品种某一具体指标对盐胁迫的反应也有所不同。所以单一指标无法准确地反映作物品种对盐胁迫的适应能力,应综合考虑多个指标科学地鉴定作物的耐盐性。本试验采用不同浓度NaCl模拟盐胁迫条件,选择型高、地上部鲜质量、根长、根鲜质量、过氧化物酶活性及丙二醛含量6项重要指标,比较盐敏感度不同的2个自交系玉米苗期耐盐性,为今后作物耐盐机制研究以及耐盐玉米品种选育提供理论基础。
1 材料与方法
1.1 材料
耐盐玉米N2521、盐敏感玉米N2553,为笔者所在实验室选育的自交系。
1.2 试验方法
本试验于2017年10月在云南省安宁市进行。
具体步骤:将经消毒处理的玉米种子播种于直径×高为 12 cm×13 cm的小塑料盆中,每盆3粒。分为4个处理,每个处理5盆。在玉米长至1叶1心时进行盐胁迫处理(2 d浇灌1次),处理1、2、3分别浇灌1.0%、1.5%、2.0% NaCl溶液 100 mL,空白对照浇灌蒸馏水100 mL。处理14 d后测定玉米型高、根长、地上部鲜质量、根部鲜质量,并取玉米幼嫩叶片剪成0.5 cm左右的小段测定相对电导率,磨样测定过氧化物酶(POD)活性、丙二醛(MDA)含量[7-8]。
2 结果与分析
2.1 盐胁迫对玉米型高和地上部鲜质量的影响
NaCl胁迫对玉米幼苗的生长发育有直接影响。如表1所示,NaCl胁迫下2个玉米自交系幼苗型高和地上部鲜质量受到严重抑制。当NaCl胁迫浓度为1.0%时,与对照相比,盐敏感玉米N2553和耐盐玉米N2521的型高分别降低1690%与14.40%,地上部鲜质量分别降低19.57%与1840%;当NaCl胁迫浓度为1.5%时,与对照相比,盐敏感玉米N2553和耐盐玉米N2521的型高分别降低40.46%和28.29%,地上部鲜质量分别降低58.57%和38.52%;当NaCl胁迫浓度为2.0%时,与对照相比,盐敏感玉米N2553和耐盐玉米N2521的型高分别降低62.81%和51.49%,地上部鲜质量分别降低72.91%和60.40%。以上结果表明,盐胁迫下2个自交系的型高和地上部鲜质量受到显著抑制,但是盐敏感型玉米N2553受到的抑制更为严重,尤其在NaCl胁迫浓度达到1.5%~2.0%时,耐鹽自交系N2521的型高和地上部鲜质量显著大于盐敏感型自交系N2553。
2.2 盐胁迫对玉米根长和根部鲜质量的影响
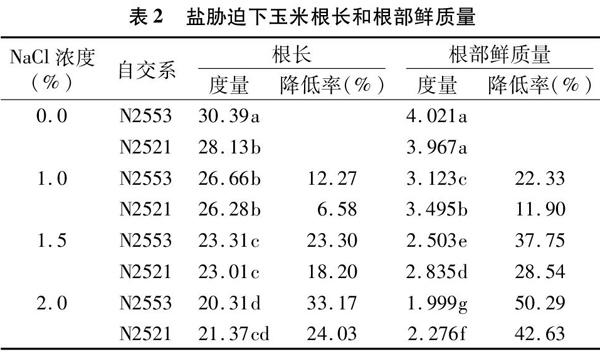
随着盐浓度的增加,玉米自交系幼苗根长及根鲜质量受到显著抑制(表2)。当NaCl胁迫浓度为1.0%时,与对照相比,盐敏感自交系N2553和耐盐自交系N2521的根长分别降低12.27%与6.58%,根部鲜质量分别降低22.33%与1190%;当NaCl胁迫浓度为1.5%时,与对照相比,盐敏感的N2553和耐盐的N2521的根长分别降低23.30%与 18.20%,根部鲜质量分别降低37.75%与28.54%;当NaCl胁迫浓度为2.0%时,与对照相比,盐敏感的N2553和耐盐的N2521的根长分别降低33.17%与24.03%,根部鲜质量分别降低50.29%与42.63%。以上结果说明盐胁迫显著抑制玉米根鲜质量,且对盐敏感型玉米根鲜质量抑制程度更大。
在1.0% NaCl胁迫下,盐敏感自交系N2553根长受到严重抑制,而耐盐自交系N2521受到的抑制不显著,在0.0~15% NaCl胁迫下盐敏感自交系N2553根长大于耐盐自交系N2521的根长,但是两者之间的差距随着盐浓度的增加正在缩小,而且在盐浓度达到2.0%时,耐盐自交系N2521的根长反超盐敏感自交系N2553的根长。
2.3 盐胁迫对玉米生理指标影响
2个玉米自交系的叶片相对电导率随着NaCl胁迫浓度的增大而增加(表3),说明NaCl胁迫会对玉米叶片细胞膜造成伤害。在低浓度NaCl(1.0%[KG*3]NaCl)处理下,2个玉米自交系的叶片相对电导率变化幅度较小,说明在1.0%的盐浓度胁迫下对自交系玉米幼苗叶片细胞膜的伤害程度较低。在高浓度NaCl(1.5%~2.0% NaCl)处理下,2个玉米自交系的叶片相对电导率变化幅度较大,说明1.5%~2.0% NaCl胁迫对自交系幼苗叶片细胞膜的伤害程度较高。盐敏感自交系N2553的叶片相对电导率整体高于耐盐自交系N2521,在10% NaCl胁迫下两者的差距并不明显;在1.5% NaCl处理下,和对照(0.0 NaCl)比较,盐敏感自交系N2553和耐盐自交系N2521的叶片相对电导率分别上升48.08%和 18.37%;在2.0% NaCl处理下,和对照比较,盐敏感自交系N2553和耐盐自交系N2521的叶片相对电导率分别上升61.54%和5102%。以上结果说明,NaCl胁迫对耐盐自交系N2521叶片细胞膜伤害程度低于盐敏感自交系N2553。
随着NaCl浓度的增加,玉米叶片的丙二醛含量呈现不断升高的趋势。在0.0~1.0%浓度范围内,NaCl胁迫下2个自交系叶片的丙二醛含量差距不大;在1.5%~2.0% NaCl胁迫下盐敏感自交系N2553叶片的丙二醛含量显著高于耐盐自交系N2521。1.5% NaCl胁迫下,与对照相比,盐敏感自交系N2553和耐盐自交系N2521叶片丙二醛含量分别上升269.53%和178.80%;2.0% NaCl胁迫下,与对照相比,盐敏感自交系N2553和耐盐自交系N2521叶片丙二醛含量分别上升697.26%和516.41%。说明盐敏感自交系N2553质膜体系受损程度显著高于耐盐自交系N2521。
2个自交系叶片的POD活性随着NaCl胁迫浓度的增高呈现先上升后下降的趋势。N2553、N2521叶片的POD活性都是在1.5% NaCl胁迫下达到最大值,分别达到713、911 U/g,与对照相比分别升高75.18%、 110.88%;随着盐胁迫浓度的继续提高,玉米叶片的POD活性表现为下降趋势,在2.0% NaCl胁迫下,与对照相比,N2553和N2521叶片的POD活性分别下降3833%和 18.06%。N2521叶片的POD活性整体高于N2553,尤其是在1.5% NaCl胁迫下达到了显著水平。
3 结论与讨论
在盐胁迫下,农作物的生长发育通常会受到显著抑制,抑制的程度一方面取决于种子的耐盐水平,另一方面取决于盐胁迫的水平[9]。本试验选用盐敏感度不同的2个自交系研究盐胁迫对玉米幼苗生長发育的影响,结果表明,盐胁迫显著抑制玉米幼苗的型高、地上部鲜质量、根长和根鲜质量,在高盐溶液胁迫下耐盐自交系N2521的型高、地上部鲜质量和根部鲜质量的变化率显著低于盐敏感型自交系N2553。
在逆境胁迫下,作物的活性氧清除系统功能降低,导致活性氧在作物体内大量积累,破坏细胞膜功能,扰乱细胞正常代谢过程,抑制作物生长发育[10-11]。盐胁迫使植物体内产生MDA,细胞膜系统受到损伤,膜通透性增加,电解质外渗[12]。作物的MDA含量和相对电导率可以有效地反映作物的衰老程度和细胞的受损程度,而POD活性是作物抗逆能力的重要指标[13]。本试验通过测定盐胁迫下玉米叶片的MDA含量、相对电导率以及POD活性探究NaCl胁迫如何影响玉米生长发育。大量研究表明,盐胁迫下作物的MDA含量和电导率随着胁迫浓度的增加而升高[14-15],这与本试验结果一致。玉米幼苗叶片MDA含量和相对电导率随着盐胁迫浓度的增加呈现上升趋势,说明盐胁迫导致玉米叶片积累了大量过氧化物并导致细胞电解质外渗,破坏了细胞膜稳态。在本试验中,在0.0~2.0%浓度范围内,NaCl胁迫下N2553和N2521叶片的相对电导率和MDA含量不断升高。在0.0~1.0% NaCl胁迫下二者的相对电导率和MDA含量相差不大,在 1.0%~2.0% NaCl胁迫下前者的相对电导率显著高于后者。说明盐胁迫对2个自交系玉米叶片细胞均造成了一定程度的伤害,但是在高盐胁迫下对盐敏感自交系N2553造成的伤害更为严重。
POD广泛分布于植物组织细胞中,其活性能够在一定程度上反映植物对活性氧自由基的清除能力[16]。正常情况下,植物抗氧化酶系统和活性氧自由基处于平衡状态,逆境胁迫会打破这种平衡,导致作物受到毒害[17]。郑世英等研究了盐胁迫下不同盐敏感型玉米抗氧化酶活性的变化,发现玉米幼苗POD活性随着盐胁迫浓度的增加呈现先上升后下降的趋势,且耐盐品种的POD明显高于盐敏感品种[18],这与本试验结果一致。在低盐胁迫下,POD等构成的保护酶系统被激活,缓解盐胁迫对作物造成的伤害,而在高盐胁迫下POD活性呈现下降趋势,这是因为玉米幼苗体内的保护酶系统清除体内活性氧的能力小于活性氧产生的能力时,活性氧在玉米体内大量积累,降低了POD的活性。本试验2个自交系的POD活性均是在1.5% NaCl胁迫下达到最大值,但是耐盐自交系N2521的POD活性上升幅度更大。
综上所述,盐胁迫对2个玉米自交系苗期的生长发育都有所抑制,但是对盐敏感型玉米N2553的抑制作用更为显著。且盐胁迫下耐盐自交系叶片相对电导率和MDA含量低于盐敏感自交系,POD活性高于盐敏感自交系。然而,作物对盐胁迫的适应性是一个复杂的过程,受多种基因控制,因此还需要从分子生物学等角度多方面研究玉米耐盐机理。
参考文献:
[1]Shabala S. Learning from halophytes:physiological basis and strategies to improve abiotic stress tolerance in crops[J]. Annals of Botany,2013,112(7):1209-1221.
[2]Rubio M C,Pilar B S,Clemente M R,et al. Effects of salt stress on the expression of antioxidant genes and proteins in the model legume Lotus japonicus[J]. New Phytologist,2009,181(4):851-859.
[3]王婧泽,高树仁,孙丽芳,等. 3个玉米自交系对盐胁迫的生理响应及耐盐性评价[J]. 干旱地区农业研究,2017,35(2):89-95.
[4]付 艳,高树仁,杨克军,等. 盐胁迫对玉米耐盐系与盐敏感系苗期几个生理生化指标的影响[J]. 植物生理学报,2011,47(5):459-462.
[5]Cui D Z,Wu D D,Liu J,et al. Proteomic analysis of seedling Roots of two maize inbred lines that differ significantly in the salt stress response[J]. PLoS One,2015,10(2):1-13.
[6]Singh V,Singh A P,Bhadoria J,et al. Differential expression of salt-responsive genes to salinity stress in salt-tolerant and salt-sensitive rice (Oryza sativa L.) at seedling stage[J]. Protoplasma,2018,255(6):1667-1681.
[7]李合生. 现代植物生理学[M]. 北京:高等教育出版社,2002.
[8]李小方,张志良. 植物生理学实验指导[M]. 北京:高等教育出版,2016.
[9]Wang F,Yuan Q H,Shi L,et al. A large-scale field study of transgene flow from cultivated rice (Oryza sativa) to common wild rice (O.rufipogon) and barnyard grass (Echinochloacrusgalli)[J]. Plant Biotechnology Journal,2006,4(6):667-676.
[10]白健慧. 燕麦对盐碱胁迫的生理响应机制研究[D]. 呼和浩特:内蒙古农业大学,2016.
[11]Liu Y J,Zhang S S,Tian X Y,et al. Effects of salt stress on protective enzyme system,DA content and membrane permeability of NHC foliar[J]. Grassland and Turf,2008,2(8):30-33.
[12]Kanazawa S,Sano S,Koshiba T,et al. Changes in antioxidative in cucumber cotyledons during natural senescence comparison with those during dark-induced senescence[J]. PhysiologiaPlantarum,2000,109(2):211-216.
[13]Ashraf M A,Akbar A,Parveen A,et al. Phenological application of Selenium differentially improves growth,oxidative defense and ion homeostasis in maize under salinity stress[J]. Plant Physiology and Biochemistry,2018,123:268-280.
[14]楊发荣,刘文瑜,黄 杰,等. 不同藜麦品种对盐胁迫的生理响应及耐盐性评价[J]. 草业学报,2017,26(12):77-88.
[15]贾新平,邓衍明,孙晓波,等. 盐胁迫对海滨雀稗生长和生理特性的影响[J]. 草业学报,2015,24(12):204-212.
[16]Guo H J,Hu T,Fu J M. Effects of saline sodic stress on growth and physiological responses of Loliumperenne[J]. Acta Prataculturae Sinica,2012,21(1):118-125.
[17]王东明,贾 媛,崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报,2009,25(4):124-128.
[18]郑世英,商学芳,余晓帅,等. 盐胁迫下不同盐敏感型玉米抗氧化酶活性的变化[J]. 山东农业大学学报(自然科学版),2011,42(1):1-5.
