外源钙镉处理对甜高粱幼苗叶片光合作用的影响
2019-12-16郝正刚王志恒魏玉清曾周琦邹芳
郝正刚 王志恒 魏玉清 曾周琦 邹芳

摘要:阐明外源钙处理对镉胁迫下甜高粱光合作用的影响特征,为甜高粱栽培及产业化提供理论参考。以甜高粱杂交品种辽甜1号为材料,采取盆栽试验方法对幼苗分别进行4种胁迫处理:CK(不供钙不加镉)、Cd(不供钙加 200 μmoL/L 镉)、Ca1(供2.0 mmol/L钙加200 μmol/L镉)、Ca2(供3.0 mmol/L钙加200 μmol/L镉)。处理后第15、30天对幼苗叶片的叶绿素含量、光合参数、叶绿素荧光参数进行测定,第31天对光合响应曲线进行研究,结果表明,镉胁迫降低了叶片叶绿素含量,显著抑制了净光合速率(Pn)、气孔导度(Gs)和蒸腾速率(Tr),降低Ci,同时降低了原初光能转化效率(Fv/Fm)、光合电子传递量子效率(ΦPSⅡ)、光化学淬灭系数(qP),降低了叶片最大净光合速率(Pmax)、表观量子效率(φ)、暗呼吸速率(Rd)、光饱和点(LSP),而Ci、非光化学淬灭系数(NPQ)、光补偿点(LCP)升高。外源钙处理能不同程度缓解镉对甜高粱光合作用的限制,并显著提高了甜高粱叶片的叶绿素含量、Pn、Gs、Tr、Fv/Fm、ΦPSⅡ、qP,降低了NPQ和Ci,此外也提高了叶片Pmax、φ、Rd、LSP,降低了LCP。综上所述,镉胁迫显著降低了甜高粱的光合作用,而增施钙可以有效地缓解镉对光合作用的抑制作用,并有助于其光合作用的恢复,其中浓度 3.0 mmol/L 的外源钙处理恢复效果最明显。
关键词:甜高粱;外源钙;镉胁迫;光合作用;荧光参数
中图分类号: S514.01;Q945.78 文献标志码: A
文章编号:1002-1302(2019)19-0075-05
收稿日期:2018-06-22
基金项目:国家自然科学基金(编号:31060180);北方民族大学研究生创新项目(编号:YCX18097);宁夏回族自治区大学生创新项目(编号:2018-QJ-061)。
作者简介:郝正刚(1992—),男,甘肃庆阳人,硕士研究生,研究方向为植物生理生态。E-mail:haozhenggang58@163.com。
通信作者:魏玉清,博士,教授,主要从事植物逆境生理与生物质能源研究。E-mail:weiyuqing@126.com。
重金属镉(Cd)不是植物生长所必需的元素,但是会被吸收后在植物体内积累,最终有可能通过食物链进入人体而对人类的健康造成危害[1-2]。光合作用是植物生存的生理基础,也是植物生产最基本的生理过程之一。相关研究表明,镉对植物有较高的毒性,通过抑制植物叶绿素的合成来降低植物的光合作用,以此来影响植物的生长发育[3]。钙(Ca)不仅是植物生长过程中的必需元素,也是偶联胞外信号与胞内生理生化反应的第二信使,对植物新陈代谢以及生长发育起到主要的调控作用[4]。相关研究表明,玉米[5]、大蒜[6]、葡萄[7]等作物在镉、钙共存时,镉对植物体造成的胁迫作用会减弱。
甜高粱具有生物产量高、适应性强、耐盐碱等特性[8],其作为一种新兴的生物质能源作物受到广泛的重视。近年来,由于工业“三废”的不科学排放,使得土壤重金属含量显著增加[9]。因此研究在重金属污染的土地上种植能源作物甜高粱具有重要的现实意义。目前关于镉胁迫对甜高粱光合作用的影响研究甚少,关于甜高粱镉与钙胁迫的关系还未见报道,故本研究以甜高粱为研究对象,通过镉钙混合处理的盆栽试验,研究镉胁迫下甜高粱叶片光合作用变化的特征,以及外源钙对其胁迫的缓解效应特点,为利用边际性土地和重金属污染土壤发展能源作物甜高粱提供理论依据和技术指导。
1 材料与方法
1.1 试验材料
以甜高粱杂交品种辽甜1号(由辽宁省农业科学院创新中心提供)为试验材料。
1.2 试验方法
试验于2018年2—4月在北方民族大学植物逆境生理实验室进行,采用盆栽试验方法。选取大小均匀、健康饱满的甜高粱种子,用自来水反复冲洗后用10%次氯酸钠消毒 10 min,常温下用灭菌水冲洗并浸泡8 h,摆放在铺有2层滤纸的培养皿中,置于27 ℃恒温生化培养箱内催芽。将催芽后的种子移至装有等量白色石头(直径约为0.3 cm)的塑料花盆(日本KANEYA 12 cm种植花盆,尺寸为11.7 cm×7.7 cm×10.7 cm)中,每盆8粒种子,后置于28 ℃、光暗周期为13 h—11 h的光照培养箱内进行光照培养。待苗高为3叶1心时,每盆定苗6株,并转至自然光条件下培养,培养过程中每周补加1次Hoagland营养液。培养20 d后将幼苗随机分成4组,每组4盆即重复4次,采取镉钙混合处理:(1)CK,不供钙不加镉;(2)Cd,不供钙加镉(200 μmoL/L镉);(3)Ca1,供钙加镉(200 μmol/L镉,2.0 mmol/L钙)。(4)Ca2,供钙加镉(200 μmol/L镉,3.0 mmol/L钙)。镉以CdCl2·25H2O的形式加入,钙以Ca(NO3)2·4H2O的形式加入。分别在处理后第15、30天对叶片叶绿素含量、光合参数、叶绿素荧光参数进行测定,第31天测定净光合速率对光合有效輻射强度的响应曲线。
1.3 测定项目及方法
1.3.1 叶绿素含量的测定 参照混合液提取法[10],用纯丙酮、无水乙醇和蒸馏水按4.5 ∶4.5 ∶1配成混合液,分别于具塞试管中加入10 mL混合液,称取新鲜叶片1 g,快速用剪刀剪成细条放入试管并置于黑暗条件下进行提取,等叶组织完全变白时,取3 mL叶绿素浸提液于10 mm比色皿中,用混合液作对照调零,用紫外可见分光光度计(UV1000,上海天美科学仪器有限公司)分别于663、645 nm波长处测定吸光度,并根据Aronn公式计算叶绿素a、叶绿素b含量及叶绿素总含量。
1.3.2 光合参数及响应曲线的测定 选择生长健康、完全展开的甜高粱叶片,于09:00—11:00采用美国LI-COR公司的LI-6400XT便携式光合作用测定系统进行测定,每处理取3个重复。光合参数包括净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr),均在控制条件下进行,设定光合有效强度(PAR)为1 000 μmol/(m2·s),固定红蓝光源,Flow为500 μmol/s,CO2R为400 μmol/mol,Temp为 25 ℃,等待数据稳定后开始记录数据。测定光响应曲线时采用自动测量程序,使用CO2注入系统浓度控制为(CO2R) 400 μmol/mol,光合有效强度由强到弱,依次设定为2 000、1 500、1 200、1 000、750、500、250、150、100、60、20、0 μmol/(m2·s),Temp为20 ℃,测定胁迫下叶片的Pn,测定前用500 μmol/(m2·s)冷光源诱导10 min,在每个光合有效辐射强度下平衡120~300 s 后开始测定。
1.3.3 荧光参数的测定 采用LI-6400XT便携式光合作用测定系统的荧光叶室进行测定,选择生长健康、完全展开的甜高粱叶片全部做标记,暗适应一个晚上后测定原初光能转换效率(Fv/Fm),后在自然光下活化,测定Fs、Fm′和Fo′,计算光化学猝灭系数(qP)、光合电子传递效率(ΦPSⅡ)、非光化学猝灭系数(NPQ)。
1.4 数据统计
采用Microsoft Excel 2003和GraphPad Prism 5.0进行数据处理和方差分析,采用SPSS statistics拟合光响应曲线,采用经典的Farquhar模型来拟合,具体操作参照陆燕元等的方法[11],该模型的理论公式为
式中:Pn为净光合速率,Pmax为最大净光合速率,I为光合有效辐射强度,φ为表观量子效率,Rd为暗呼吸速率,θ为非直角双曲线的凸度(曲角)。其中,在低光合有效辐射强度下,Pn随I的增加呈线性增高,通过对 200 μmol/(m2·s) 下所采集的数据进行直线回归分析,得出的线性方程与非直线双曲线模型中计算出的Pmax值和x轴这2条平行直线相交,可得出交点,其与x轴的交点数值即为LCP(光补偿点),而与Pmax的交点在x轴上的数值则为 LSP(光饱和点)。
2 结果与分析
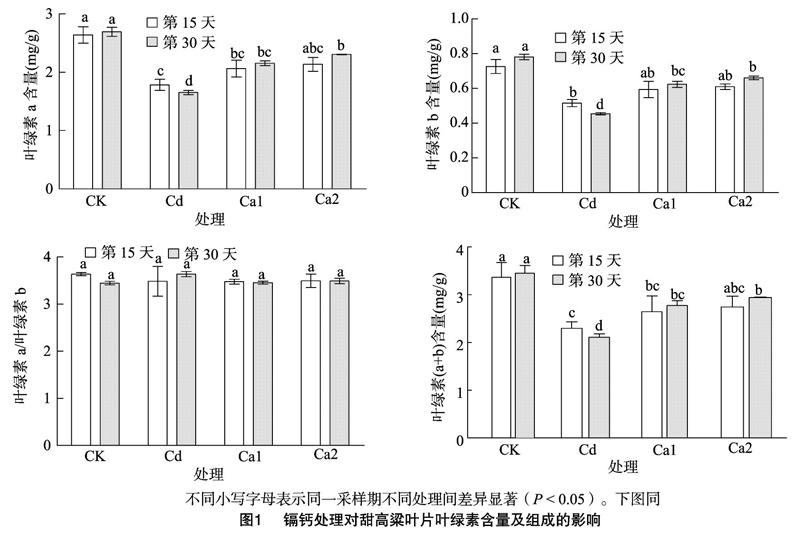
2.1 镉钙处理对甜高粱幼苗叶片叶绿素含量的影响
由图1可知,在第15天,与CK相比,Cd处理胁迫下的叶片叶绿素a、叶绿素b及总含量都显著降低,而叶绿素a/叶绿素b值也呈下降的趋势,但差异不显著。在第30天,Cd处理下叶绿素a、叶绿素b及总含量较CK分别降低了38.62%、41.87%、39.35%;Ca1、Ca2处理与Cd处理相比,叶绿素a、叶绿素b及总含量都随着增施钙浓度的增加而升高,而Ca1和Ca2处理间差异不显著,但叶绿素a/叶绿素b值无显著变化。另外在Ca1、Ca2处理下第30天的叶绿素a、叶绿素b及总含量较第15天都有所升高,与Cd处理相比,在第30天Ca2处理下叶绿素a、叶绿素b及总含量分别增加了28.29%、3132%、28.95%。这说明镉可能抑制了甜高粱叶片叶绿素的合成,也可能加速了其分解,在镉胁迫的基础上增施钙可以明显提高叶片叶绿素含量。
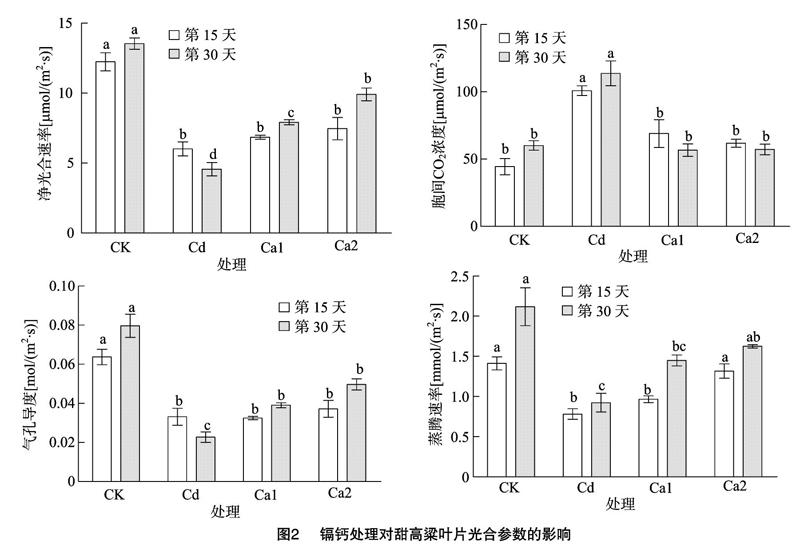
2.2 镉钙处理对甜高粱幼苗叶片光合参数的影响
由图2可知,镉胁迫会严重影响甜高粱叶片光合作用的进行,与CK相比,镉胁迫下的净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)均显著降低,而叶片胞间CO2浓度(Ci)则显著升高,在第30天,Cd处理下叶片的Pn、Gs、Tr分别降低了66.26%、71.48%、56.37%,同時Ci升高了47.16%。其次Ca1、Ca2处理与Cd处理相比,叶片Pn、Gs和Tr都随着增施钙浓度的增加而升高,而Ci则降低。在第30天,Ca2处理下叶片Pn、Gs和Tr较Cd处理分别增加了53.90%、5429%、43.16%,同时Ci降低了49.75%。这说明在镉胁迫的基础上增施钙可以明显减小镉对甜高粱幼苗光合的抑制作用,其中Ca2处理效果较好。
2.3 镉钙处理对甜高粱幼苗叶片荧光参数的影响
叶绿素荧光参数是被用来描述植物光合系统生理状况和叶绿素结构状态的指标,由图3可知,镉胁迫会使得甜高粱叶片原初光能转换效率(Fv/Fm)、光合电子传递效率(ΦPSⅡ)、光化学猝灭系数(qP)显著降低,而非光化学猝灭系数(NPQ)则显著升高,在第30天,Cd处理下叶片Fv/Fm、ΦPSⅡ、qP较CK分别降低了9.45%、48.05%、41.88%,而NPQ则上升了2003%。在镉胁迫的基础上增施钙使得甜高粱叶片Fv/Fm、ΦPSⅡ、qP均不同程度升高,而NPQ则降低,但Ca1和Ca2处理间差异不显著,在第30天Ca2处理下叶片Fv/Fm、ΦPSⅡ、qP较Cd处理分别增加了 9.48%、27.67%、32.82%,而NPQ则降低了18.72%。这说明增施钙可以减弱镉对甜高粱幼苗叶片荧光的不利影响。
2.4 镉钙处理对甜高粱幼苗叶片光合响应曲线变化及相关参数的影响
如图4所示,光合有效辐射强度(PAR)在0~500 μmol/(m2·s)时,Pn快速上升,当光合有效辐射强度达到500 μmol/(m2·s)时,Pn上升幅度较弱。对各处理下的叶片光响应曲线的变化趋势做进一步分析发现,Cd处理下叶片的Pn明显低于CK处理,二者差异明显,而Ca1和Ca2处理下叶片的Pn明显高于Cd处理,其中Ca2处理略高于Ca1。整体来看,PAR在200 μmol/(m2·s)以下时,各处理下光响应曲线都在线性增长,其中直线方程的斜率为表观量子效率(φ),主要反映甜高粱叶片对弱光的利用能力。
由表1可以看出,镉胁迫下甜高粱叶片Pmax、φ、Rd、LSP较CK分别降低了60.60%、60.00%、56.76%、42.50%,差异均达到显著水平;而镉胁迫下甜高粱叶片光补偿点(LCP)较对照则显著上升了280.29%。在镉胁迫的基础上增施钙处理使得叶片Pmax、φ、Rd、LSP均增高,Ca2处理最为明显,较Cd
处理分别增高了73.09%、100.00%、11250%、47.58%,其中Pmax、φ、Rd差异达到显著水平,而LSP不显著;而镉胁迫的基础上增施钙,LCP则下降,Ca1与Ca2处理较Cd分别降低2405%、46.95%,差异均达到显著水平。
3 讨论与结论
植物作为生态系统中的生产者,依靠光合作用不仅可以获得能量,也能合成营养物质。植物叶片中存在一定量的叶绿素蛋白复合物,在光能的吸收、传递、转换中起着重要的作用,因此叶绿素含量的高低和植物光合作用的强弱密切相关[12-13]。本研究表明,镉胁迫使得甜高粱叶片叶绿素a、叶绿素b及总含量、净光合速率(Pn),气孔导度(Gs)和蒸腾速率(Tr)均下降,而气孔导度(Ci)则增加,这与前人利用草莓、烟草得出的研究结果[2,14]相似。相关研究表明, 影响植物光
合作用的主要因素包括气孔因素和非气孔因素,当植物叶片Pn、Gs、Ci同时降低,则说明Pn的下降主要是气孔因素导致的,当Pn、Gs下降,Ci升高则表明Pn下降的主要原因是非气孔因素的限制[15]。在本试验镉胁迫下Pn、Gs降低,Ci升高,说明镉胁迫下甜高粱幼苗光合作用的降低不是气孔导度下降使得CO2供应减少导致的,可能是叶绿素含量降低,使得叶肉细胞光化学活性受到限制从而影响CO2同化利用造成的。镉胁迫使得叶片叶绿素含量降低的原因可能是镉被植物吸收后进入叶绿体,取代了叶绿体中的Fe2+、Zn2+和Mg2+,使得叶绿体的亚显微结构发生改变,主要表现在基粒垛叠结构的解体和片层系统相关的基质减少[16-17]。相关研究表明,Ca2+对于植物细胞壁和细胞膜具有稳定作用,且参与了植物的光合作用[4],本试验在镉胁迫的基础上增施钙不仅可以增加叶片叶绿素含量,而且缓解了镉胁迫对光合参数Pn、Gs、Tr、Ci的不利影响,随着时间的延长,缓解作用愈加明显,在Ca2处理下效果最好,这与前人研究结果[6]一致。其作用机理可能是Ca2+和Cd2+的竞争作用,阻止了Cd2+向地上部分运输[5],减少了甜高粱叶片叶绿素的分解,进而减弱了镉对甜高粱光合作用的不利影响。
叶绿素荧光和光合作用的关系十分密切,当强光持续照射植物时,为了避免叶绿体吸收光能超过光合作用过程中光化学反应的消耗能力以及过量的光能灼伤损害光合机构,荧光起到了重要的保护作用,主要表現为一部分光能以荧光的形式被耗散掉[18]。植物叶绿素荧光参数可以反应叶片PSⅡ反应中心的状态,与“表观性”的气体交换指标相比,叶绿素荧光参数具有反映“内在性”的特点[19],其中Fv/Fm是植物暗适应下PSⅡ反应中心完全开放时的最大光化学效率,它反映了PSⅡ反应中心最大光能转化率;ΦPSⅡ是实际光化学效率,它反应植物在照光条件下PSⅡ反应中心部分关闭的情况下的实际光化学效率,表示光化学反应消耗的能量占叶片吸收光能的比例[20]; qP反应PSⅡ反应中心的开放程度,反应叶片中捕光激发能用于光化学反应的程度[21];而NPQ则代表植物热耗散的能力。本研究结果显示,镉胁迫下甜高粱叶片Fv/Fm、ΦPSⅡ、qP均减小,而NPQ则增加,这与前人得出的结果[22-23]相同,说明镉胁迫下甜高粱叶片PSⅡ原初光化学活性受到影响,PSⅡ活性中心被损伤或破坏,使得反应中心捕获激发能下降,PSⅡ功能受到抑制,因此通过热耗散途径来耗用过剩的光能来尽量保护光合机构免受伤害,使得用于光化学反应的比例减少,导致甜高粱叶片CO2同化能力下降;而在镉胁迫的基础上增施钙可有效缓解镉对叶片Fv/Fm、ΦPSⅡ、qP的抑制作用,降低NPQ,这说明钙提高了镉胁迫下甜高粱幼苗叶片PSⅡ原初光化学活性,减少了热耗散的比例,使得光能转化效率升高,为暗反应碳同化积累了更多的能量,进而提高了光合能力。
植物对光强的响应曲线变化是研究植物光合作用的手段之一[24]。不同植物光合作用对光强的响应不同,因此光合响应曲线相关参数中Pmax、φ、Rd也不同,特别是LCP、LSP也存在很大的差异,同一植物的光合响应相关参数不是固定的数值,会随着外界环境的变化而变化[25-26]。其中叶片Pmax反应植物最大净光合能力[27],其大小受Rusbico活性和电子传递效率的影响[28]。φ的大小反应了叶片在弱光下吸收转换及利用光能的能力,该值越大说明叶片利用弱光的能力越强,光能转化率较高[29-30]。而LCP、LSP则反映植物叶片对光的利用能力,是植物需光特性的体现,相关研究表明,较低的LCP、LSP使植物在有限的光照条件下以最大能力利用低光量子密度,这与低光强下单位面积叶绿素含量升高和暗呼吸速率降低有关[31]。本试验中,镉胁迫降低了甜高粱叶片Pmax、φ、Rd、LSP,而使得LCP升高,而在镉胁迫基础上增施钙,叶片Pmax、φ、Rd、LSP有所升高,而LCP则降低,这说明镉胁迫降低了甜高粱叶片Rusbico活性和电子传递效率,使得叶片对光的吸收、传递、转化能力下降,从而降低甜高粱叶片对光的利用能力,而增施钙可以改善镉胁迫对甜高粱幼苗光合的抑制作用。相关研究表明,Cd对光合作用的影响与Cd在光化学过程中竞争光系统Ⅱ催化中心上钙离子的结合位点有关系[32],而Andersson等认为钙可以与镉竞争植物根系上吸收位点,所以钙对镉胁迫下甜高粱光合能力下降的缓解作用很可能是通过离子的竞争作用实现的[33]。
综上所述,结合本试验条件下甜高粱幼苗叶绿素及光合特性指标的变化,镉胁迫是通过降低叶片中叶绿素的含量,使得叶片PSⅡ原初光能转化效率降低,电子传递受到抑制,增加热耗散来降低甜高粱幼苗的光合能力;而在镉胁迫的基础上增施钙可以有效提高叶绿素含量,缓解镉对光合机构的伤害,使得PSⅡ活性增强,光合电子传递效率增加,促进了叶片对CO2的吸收、固定和同化,同时通过减少热耗散使得光能用于光化学反应的比例增加,进而促进了甜高粱的光合作用,提高了对光的利用能力,以此来减轻镉对甜高粱幼苗的伤害,其中浓度3.0 mmoL/L的钙效果最好。
参考文献:
[1]Wagner G J. Accumulation of cadmium in crop plants and its consequences to human health[J]. Advances in Agronomy,1993,51(1):173-205.
[2]张金彪,黄维南. 镉胁迫对草莓光合的影响[J]. 应用生态学报,2007,18(7):1673-1676.
[3]Clemens S,Palmgren M G,Kramer U. Along way ahead:understanding and engineering plant mental accumulation[J]. Trends in Plant Science,2002,7(7):309-315.
[4]孫大业. 植物细胞信号转导研究进展[J]. 植物生理学通讯,1996,32(2):81-91.
[5]汪 洪,周 卫,林 葆. 钙对镉胁迫下玉米生长及生理特性的影响[J]. 植物营养与肥料学报,2001,7(1):78-87.
[6]张鑫荣,杨洪强,隋 静,等. 葡萄根系钙处理对叶片镉伤害的保护作用[J]. 园艺学报,2008,35(10):1405-1410.
[7]李 贺,连海峰,刘世琦,等. 镉胁迫对大蒜苗生理特性的影响及施钙的缓解效应[J]. 应用生态学报,2015,26(4):1193-1198.
[8]刘公社,周庆源,宋松泉,等. 能源植物甜高粱种质资源和分子生物学研究进展[J]. 植物学报,2009,44(3):253-261.
[9]张 从,夏立江. 生物技术在污染土壤修复中的应用[M]. 北京:中国环境科学出版社,2000:1-10.
[10]陈福明,陈顺伟. 混合液法测定叶绿素含量的研究[J]. 浙江林业科技,1984(1):19-23,36.
[11]陆燕元,马焕成,李昊民,等. 土壤干旱对转基因甘薯光合曲线的响应[J]. 生态学报,2015,35(7):2155-2160.
[12]余叔文,汤章城. 植物生理与分子生物学[M]. 北京:科学出版社,1992.
[13]李孟洋,巢建国,谷 巍,等. 高温胁迫对不同产地茅苍术开花前叶片叶绿素荧光特征的影响[J]. 植物生理学报,2015,51(11):1861-1866.
[14]李 元,王焕校,吴玉树. Cd、Fe及其复合污染对烟草叶片几项生理指标的影响[J]. 生态学报,1992,12(2):147-154.
[15]Farquhar G D,Sharkey T D. Stomatal conductance and photosynthesis[J]. Ann Revi Plant Physiol,1982,33:317-345.
[16]孙赛初,王焕校,李启任. 水生维管束植物受镉污染后的生理变化及受害机制初探[J]. 植物生理学报,1985,11(2):113-121.
[17]Baszynski T,Wajda L,Krol M,et al. Photosynthetic activities of cadmium-treated tomato plants[J]. Physiologia Plantarum,1980,48(3):365-370.
[18]Bolhar-Nordenkampf H R,Long S P,Baker N R,et al. Chlorophyll fluorescence as a probe of the photosynthetic competence of leaves in the field:a review of current instrumentation[J]. Functional Ecology,1989,3(4):497-514.
[19]陈建明,俞晓平,程家安. 叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J]. 浙江农业学报,2006,18(1):51-55.
[20]Govindjee. A role for a light-harvesting antenna complex of photosystem Ⅱ in photoprotection[J]. Plant Cell,2002,14(8):1663-1668.
[21]Havaux M,Strasser R J,Greppin H. A theoretical and experimental analysis of the qP and qN coefficients of chlorophyll fluorescence quenching and their relation to photochemical and nonphotochemical events[J]. Photosynthesis Research,1991,27(1):41-55.
[22]李 伶. 镉、铜及其复合胁迫对浮萍[Spirodela polyrrhiea (L.) Schleid]叶绿素荧光参数的影响[D]. 上海:华东师范大学,2010:12-21.
[23]曹 玲,王庆成,崔东海. 土壤镉污染对四种阔叶树苗木叶绿素荧光特性和生长的影响[J]. 应用生态学报,2006,17(5):769-772.
[24]薛 伟,李向义,朱军涛,等. 遮阴对疏叶骆驼刺叶形态和光合参数的影响[J]. 植物生态学报,2011,35(1):82-90.
[25]孙旭生,林 琪,赵长星,等. 施氮量对超高产冬小麦灌浆期旗叶光响应曲线的影响[J]. 生态学报,2009,29(3):1428-1437.
[26]罗维成,曾凡江,刘 波,等. 绿洲-沙漠过渡带引种植物光合生理特征研究[J]. 草业学报,2013,22(2):273-280.
[27]林叶春,曾昭海,任长忠,等. 局部根区灌溉对裸燕麦光合特征曲线及叶绿素荧光特性的影响[J]. 作物学报,2012,38(6):1062-1070.
[28]郎 莹,张光灿,张征坤,等. 不同土壤水分下山杏光合作用光响应过程及其模拟[J]. 生态学报,2011,31(16):4499-4508.
[29]刘建锋,杨文娟,江泽平,等. 遮荫对濒危植物崖柏光合作用和叶绿素荧光参数的影响[J]. 生态学报,2011,31(20):5999-6004.
[30]吕晋慧,王 玄,冯雁梦,等. 遮荫对金莲花光合特性和叶片解剖特征的影响[J]. 生态学报,2012,32(19):6033-6043.
[31]张 云,夏国华,马 凯,等. 遮阴对堇叶紫金牛光合特性和叶绿素荧光参数的影响[J]. 应用生态学报,2014,25(7):1940-1948.
[32]Faller P,Kienzler K,Krieger-Liszkay A. Mechanism of Cd2+ toxicity:Cd2+ inhibits photoactivation of photosysⅡby competitive binding to the essential Ca2+ site[J]. Biochimica et Biophysica acta,2005,1706(1/2):158-164.
[33]Andersson A,Nilsson K O. Influence of lime and soil pH on Cd availability to plants[J]. Ambio,1974,3(5):198-200.
