鸡α干扰素真核表达载体的改造及在毕赤酵母中的分泌表达
2019-12-16曹丁李学优昝继清兰玲峰甘祥武
曹丁 李学优 昝继清 兰玲峰 甘祥武
摘要:旨在利用毕赤酵母密码子的偏好性和遗传简并性,将鸡α干扰素优化基因片段cIFN-α[STBX]2[STBZ]连入毕赤酵母表达载体pPIC9k,再经重叠延伸PCR方法去除重组质粒的5′端非翻译区多余的8个核苷酸GGATCCAA,使其与毕赤酵母AOX1(醇氧化酶)的5′端非翻译区的序列完全一致,构建并筛选重组毕赤酵母,并进行摇瓶诱导表达试验。将表达产物用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行检测,并用微量病变抑制法检测其抗病毒效价。抗病毒活性检测结果显示,天然基因、优化基因、质粒5′端非翻译区改造后的优化基因重组质粒表达产物的抗病毒效价分别为105、106、1.5×106 U/mL。鸡α干扰素基因优化后的抗病毒效价提高了10倍,对质粒5′端非翻译区进行进一步改造后,表达蛋白的抗病毒活性提高了50%,从而为鸡α干扰素的工业化生产奠定了基础。
关键词:鸡α干扰素;真核表达;pPIC9k;分泌表达;抗病毒活性
中图分类号: Q786文献标志码: A
文章编号:1002-1302(2019)19-0068-04
收稿日期:2018-09-16
基金项目:广州市科技计划(编号:201610010087)。
作者简介:曹 丁(1986—),女,河南南阳人,硕士,高级工程师,主要从事生物农业工程方面的研究。E-mail:caoding218@163.com。
干扰素是一类能够诱导人及动物细胞产生多种广谱抗病毒蛋白的类激素蛋白,具有抗病毒、抗肿瘤和免疫调节等生物学活性,可有效解决禽类的疫病泛滥问题,并能够解决应用抗生素造成的菌群失调、出现耐药性菌株及药物的不良反应等问题[1-2]。毕赤酵母是近年来发展起来的一种以甲醇为碳源的真核表达系统,酵母可对异源蛋白进行修饰,采用有信号肽的质粒时,蛋白能被正确折叠和加工,然后被分泌到培养基中。毕赤酵母分泌蛋白除了具有与哺乳动物细胞表达蛋白许多相似的优点外,还具有操作简便、营养要求低、培养价格低廉、便于高密度发酵、高产分泌表达外源蛋白以及表达产物易于纯化等优点[3-4]。因此,基于毕赤酵母的表达系统,可以有效地高表达重组鸡α干扰素。
鸡α干扰素作为禽类干扰素中的代表,其抗病毒作用较强。本研究为了解决天然鸡α干扰素基因表达量低下等问题,在其成熟肽序列的基础上,选用毕赤酵母偏好性密码子,人工合成其优化基因序列,并在基因序列前加入蛋白酶切割位点,使其表达蛋白具有天然的N端。此外,将连入的真核表达载体pPIC9k的5′端非翻译区(5′UTR)序列进行改造,去除多余的8个碱基序列,使其与毕赤酵母AOX1(醇氧化酶)的mRNA序列完全一致,并初步研究了改造载体在毕赤酵母SMD1168中的表达和抗病毒活性,以期提高雞α干扰素的表达水平,解决其在工业生产中的瓶颈问题。
1 材料与方法
1.1 供试菌株和质粒
pPIC9k质粒、大肠杆菌DH5α、毕赤酵母SMD1168和水泡性口炎病毒(VSV),均由广东省微生物种质资源库保存。
1.2 主要试剂
PFU(高保真DNA聚合酶) Mix、DNA胶回收试剂盒、质粒DNA小量提取试剂盒、引物、核酸染色剂、琼脂糖,购自生工生物工程(上海)股份有限公司;T4 DNA连接酶、限制性内切酶、G418、DNA marker、蛋白质marker,购自TaKaRa公司;酵母抽提物、胰蛋白胨,购自英国Oxoid公司;琼脂粉,购自广州环凯生物科技有限公司;其他试剂均为国产分析纯。
1.3 主要仪器设备
主要仪器与设备有生化培养箱、DHZ-DA大容量全温振荡器、752N型紫外可见分光光度计、PCR仪、恒温金属浴、水平/垂直电泳仪、蓝光切胶仪、显微镜、电子天平、pH值等。
1.4 引物的设计与合成
根据GenBank上发表的鸡α干扰素成熟肽序列,同时遵循毕赤酵母密码子使用的偏好性和遗传简并性原则,选用毕赤酵母的偏爱密码子[5],用Primer 5.0软件设计12条引物P1~P12,运用重叠延伸PCR方法人工合成cIFN-α基因序列[6]。插入毕赤酵母表达载体pPIC9k,在5′端起始密码子前选择酶切位点EcoR Ⅰ,在3′端终止密码子后选择酶切位点Not Ⅰ,在目的基因前面加入kex2、Ste13蛋白酶裂解位点,使外源基因表达产物具有天然的N端,并利用载体上的α信号肽序列得到分泌表达。
1.5 鸡α干扰素成熟肽优化基因序列的SOE(重叠延伸基因扩增技术)
取引物P1~P4(10 μmol/L)各2 μL,PFU Mix 25 μL,用双蒸水补至50 μL,PCR反应程序如下:94 ℃ 3 min,(94 ℃ 30 s,52 ℃ 30 s,72 ℃ 40 s)×30个循环,72 ℃ 10 min。每组分别以P1~P4引物为第1组,P5~P8引物为第2组,P9~P12引物为第3组,按相同条件进行PCR扩增,将反应产物分别在1%琼脂糖凝胶中电泳,用琼脂糖凝胶DNA回收试剂盒纯化回收,将回收产物分别标记为D1、D2、D3。
取D1、D2、D3各2 μL,引物P1、P12各1 μL,PFU Mix 25 μL,补充双蒸水至总体积为50 μL,PCR反应程序如下:94 ℃ 3 min,(94 ℃ 30 s,52 ℃ 30 s,72 ℃ 40 s)×30个循环,72 ℃ 10 min。将反应产物进行琼脂糖凝胶电泳检测并切胶回收,该回收产物即为扩增的鸡α干扰素成熟肽优化基因序列,标记为cIFN-α[STBX]2[STBZ],鸡α干扰素成熟肽天然基因标记为cIFN-α[STBX]1[STBZ]。
1.6 cIFN-α重组表达载体的构建
将cIFN-α2基因片段和pPIC9k质粒分别进行EcoR Ⅰ、Not Ⅰ双酶切后连接,转化大肠杆菌DH5α,构建表达载体pPIC9k-cIFN-α2。将转化菌落经菌落PCR鉴定,提取阳性质粒送至生工生物工程(上海)股份有限公司进行序列测定。
1.7 pPIC9k-cIFN-α2的5′非翻译区的改造
将pPIC9k表达载体的非翻译区序列与毕赤酵母全基因序列中的AOX1基因序列进行比较,发现pPIC9k质粒的5′非翻译区多出了8个核苷酸序列GGATCCAA,本试验通过设计4条引物,应用PCR方法拟去除表达重组载体信号肽mRNA 5′-UTR序列中的GGATCCAA序列[7]。首先在载体上改造位点(GGATCCAA)的上游找到Sac Ⅰ酶切位点,在目的基因下游找到Not Ⅰ酶切位点,设计3条引物E1、E2、E3,其中E1含有酶切位点Sac Ⅰ,E2、E3有互补序列,且内部人为去除GGATCCAA序列,分别以E1、E2以及E3、P12为引物,以pPIC9k-cIFN-αR质粒为模板进行PCR扩增,可扩增得到长度分别为732、824 bp左右的片段A、B。再将片段A、B进行切胶回收后,用引物E1、P12利用重叠延伸PCR方法扩增得到片段C,大小为1 532 bp。将片段C回收后与pPIC9k质粒经SacⅠ、NotⅠ双酶切后连接,即得到重组5′UTR区改造质粒pPIC9k-cIFN-αR,进一步进行序列测定以验证结果。最终实现去掉5′-UTR多余的8个碱基,使得经过改造的质粒pPIC9k的5′-UTR与酵母基因组的AOX1完全相同,从而降低了可能引起的表达量降低或者不表达的可能性。
1.8 重组质粒转化SMD1168的筛选和鉴定
将重组质粒经限制性内切酶SacⅠ进行单酶切后,电击转化毕赤酵母SMD1168,将转化后的酵母细胞涂布于MD(最小葡萄糖培养基)平板进行培养,直至长出单菌落。挑选转化子菌落,用裂解液进行PCR模板的制备,用通用引物α-factor、3′AOX进行PCR扩增,将筛选到的阳性转化子经浓度逐渐增高的G418抗生素筛选高拷贝克隆,用于表达目的蛋白。
1.9 鸡α干扰素的诱导表达及检测
选取耐受2.0 mg/mL G418抗生素浓度的单菌落,每种重组质粒各选取3个,以pPIC9k空质粒转化酵母作为阴性对照。将毕赤酵母从活化平板接种至YPD(酵母浸出粉胨葡萄糖培养基)摇瓶,于28 ℃、220 r/min 培养24 h,从YPD摇瓶中按1%的接种量接至BMGY(最小甘油缓冲液培养基)摇瓶中,于28 ℃、220 r/min培养16 h,4 000 r/min离心10 min取沉淀;用等体积的BMMY(最小甲醇缓冲液培养基)培养基重新悬浮菌体,于28 ℃、220 r/min培养24 h后,补加1%甲醇和磷酸钾溶液1次,48 h后结束培养。将BMMY摇瓶菌液于12 000 r/min离心10 min,取上清,用0.22 μm微孔滤膜过滤除菌,对过滤上清进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和抗病毒活性检测。
1.10 重组鸡α干扰素的抗病毒活性检测
采用微量细胞病变抑制法[8]测定重组鸡α干扰素的抗病毒活性,具体步骤如下:取孵化9~10 d的SPF(无特定病原体)鸡胚,去头、四肢及内脏,在无菌状态下用磷酸缓冲盐溶液(PBS)洗3遍后,剪碎,用0.25%胰酶于37 ℃消化后,再用无血清营养液洗去胰酶,并用大孔吸管吹打成单个细胞后上96孔板,生长约12 h使细胞全部贴壁生长至单层后,去除生长液。每孔加入10倍倍比稀释的干扰素(用无血清营养液稀释)共 100 μL,每个稀释度设6孔平行样,孵育12 h后用100 TCID50剂量的水泡性口炎病毒进行攻毒,同时设陽性对照孔(不加干扰素,只加病毒)、阴性对照孔(只加干扰素,不加病毒)、空白对照孔(不加干扰素,不加病毒),大约12~24 h后在倒置显微镜下观察结果。当阳性对照孔出现75%以上病变时,判断结果,以能抑制50%细胞病变的样品干扰素稀释度定义为1个单位干扰素。
2 结果与分析
2.1 鸡α干扰素成熟肽优化基因的扩增及重组表达质粒的构建
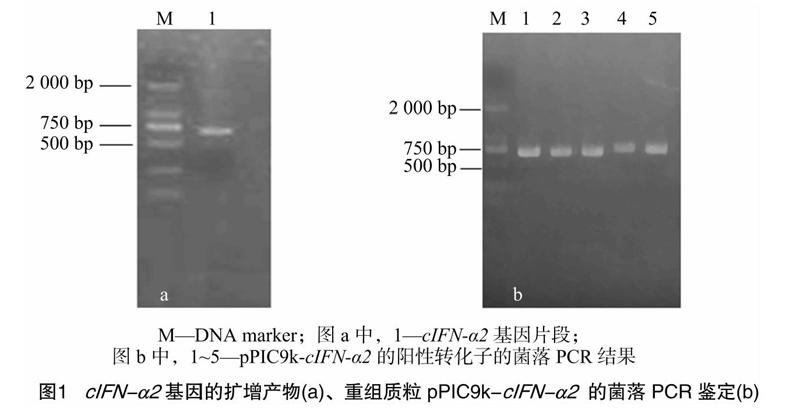
PCR扩增后的cIFN-α2基因产物片段经琼脂糖凝胶电泳检测后,发现有1条清晰的条带(图1-a),预期大小为 696 bp,与DNA marker相比,大小与预期相符,回收后测序表明,序列正确,与设计相符合。
将cIFN-α2基因片段双酶切后连入pPIC9k表达载体,用通用引物α-factor、3′AOX进行菌落PCR筛选阳性克隆,将扩增条带进行1%琼脂糖凝胶电泳检测,结果有明显条带被扩增出来,与DNA marker比对可知,位于750 bp附近。扩增出来的片段预计大小为696 bp,与PCR检测的结果基本相符。选择3个阳性克隆保种、提质粒,送至生工生物工程(上海)股份有限公司进行测序,结果表明,载体连入序列正确,得到含鸡α干扰素成熟肽优化基因的pPIC9k表达载体。
2.2 pPIC9k-cIFN-α2的5′非翻译区的改造
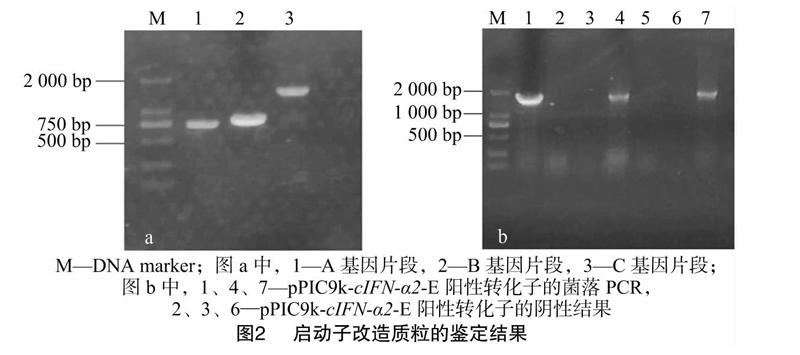
将扩增后的A、B、C片段进行琼脂糖凝胶电泳检测,发现在目标位置均有1条清晰的条带,经检测,大小正确,说明扩增成功(图2-a)。用通用引物对pPIC9k-cIFN-α2启动子改建转化子的菌落PCR结果显示,扩增有明显条带(图2-b),与DNA marker相比,位于1 600 bp附近。由于鉴定PCR中采用的是E1、3′AOX引物,因此扩增出来的片段大小应该是1 532 bp,与PCR检测的结果基本相符(图2-a)。选择3个阳性克隆保种、提质粒,送至生工生物工程(上海)股份有限公司进行测序,结果表明,载体连入序列正确,得到含有鸡α干扰素成熟肽优化基因的5′UTR区改造质粒pPIC9k-cIFN-α2-E。
2.3 重组毕赤酵母的鉴定
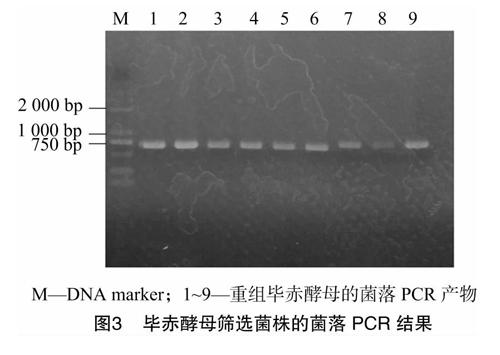
将重组毕赤酵母菌株用通用引物α-factor、3′AOX进行酵母菌落PCR验证,如图3所示,筛选到的重组毕赤酵母在目标位置出现了明显条带,与预期的696 bp一致,证明线性化的重组质粒已经被成功整合至毕赤酵母基因组中。
2.4 鸡α干扰素的表达检测
对筛选到的高拷贝阳性毕赤酵母重组子SMD1168-pPIC9k-cIFN-α1、SMD1168-pPIC9k-cIFN-α2、SMD1168-pPIC9k-cIFN-α2-E进行摇瓶诱导表达试验,分别取48 h表达上清进行12%SDS-PAGE。由图4可以看出,在20 ku左右出现特异蛋白条带,与预期分子量大小19 ku基本相符,而阴性对照未重组的SMD1168与空质粒转化对照SMD1168-pPIC9k未出现相应条带。光密度扫描结果显示,鸡α干扰素优化基因重组酵母的蛋白表达量大于天然基因重组酵母SMD1168-pPIC9k-cIFN-α1。
2.5 重组酵母表达鸡α干扰素抗病毒活性的测定
病毒抑制法测定酵母表达产物的抗病毒活性结果显示,攻毒24 h后观察到阳性对照孔出现100%的病变,阴性对照孔中是正常的鸡胚成纤维细胞。从表1可以看出,鸡α干扰素基因的优化可以提高其表达水平,抗病毒效价明显提高了
10倍;在优化基因重组毕赤酵母的基础上,对质粒5′端非翻译区进行进一步改造后,表达蛋白的抗病毒活性提高了约50%。
3 讨论与结论
研究表明,mRNA的5′端非翻译区序列组成和长度可影响翻译效率,毕赤酵母是1种甲醇营养型酵母,能够以甲醇为唯一碳源生长[9]。与甲醇代谢相关的醇氧化酶AOX1基因受甲醇的严格调控并启动高效表达,醇氧化酶占细胞可溶性蛋白的35%,而對应的mRNA仅仅占总mRNA的5%以下[10],说明醇氧化酶mRNA的翻译效率极高,其5′端非翻译区有利于目的蛋白在毕赤酵母中的表达。
Sreekrishna等通过改建人血清蛋白mRNA,使其与甲醇氧化酶基因AOX1 mRNA的5′UTR相同,结果发现,其表达水平提高了50倍以上[11],说明AOX1的5′UTR对目的基因表达水平的影响比较大,具有相同的5′UTR有利于目的基因在毕赤酵母中的表达翻译,而pPIC9k质粒的5′UTR与AOX1的5′UTR的序列相比,多了8个碱基GGATCCAA,这可能成为限制目的蛋白表达的重要因素之一。
近年来的多数研究表明,由于不同物种对同义密码子的使用频率不同,外源基因,尤其是来自较远物种的基因在宿主中的表达会受到一定影响,通过对外源基因的密码子进行优化,可以提高其表达水平[12]。本研究运用PCR方法,将pPIC9k质粒5′UTR的8个核苷酸序列去除,使其与AOX1 的5′UTR序列相同,并对其鸡α干扰素的密码子进行了优化,将获得的重组菌株在摇瓶水平进行了甲醇诱导表达。检测结果表明,与天然基因相比,密码子优化后的鸡α干扰素重组酵母菌株的表达量得到了提高,抗病毒活性提高了10倍,在此基础上,对pPIC9k质粒的5′UTR进行改造后,抗病毒活性提高了50%,说明其mRNA的5′非翻译区的改造能有效提高鸡α干扰素在毕赤酵母中的表达。本研究为提高鸡α干扰素的工程菌表达效果提供了新的思路。
参考文献:
[1]岳道友,索 勋,汪 明,等. 鸡α-干扰素研究进展[J]. 中国家禽,2010,32(17):45-47.
[2]蔡梅红,曹瑞兵,王传友,等. 重组酵母鸡α干扰素的研制及其抗病毒活性测定[J]. 中国免疫学杂志,2007,23(9):829-832.
[3]朱泰承,李 寅. 毕赤酵母表达系统发展概况及趋势[J]. 生物工程学报,2015,31(6):929-938.
[4]Rabert C,Weinacker D,Pessoa A Jr,et al. Recombinants proteins for industrial uses:utilization of Pichia pastoris expression system[J]. Brazilian Journal of Microbiology,2013,44(2):351-356.
[5]赵 翔,霍克克,李育阳.毕赤酵母的密码子用法分析[J]. 生物工程学报,2000,16(3):308-311.
[6]黄朝远. 猪IFN-γ在毕赤酵母中的分泌表达与功能验证[D]. 广州:华南农业大学,2016.
[7]明飞平,杨 军,朱进美,等. 5′非翻译区序列改建提高抗菌肽PR39表达[J]. 中国生物工程杂志,2013,33(12):86-91.
[8]蔡梅红,曹瑞兵,曹景立,等. 重组酵母鸡α干扰素的诱导表达及其抗MDV、NDV能力[J]. 西北农林科技大学学报(自然科学版),2010,38(9):37-41.
[9]Macauley-Patrick S,Fazenda M L,Mcneil B,et al. Heterologous protein production using the Pichia pastoris expression system[J]. Yeast,2005,22(4):249-270.
[10]Koutz P,Davis G R,Stillman C,et al. Structural comparison of the Pichia pastoris alcohol oxidase genes[J]. Yeast,1989,5(3):167-177.
[11]Sreekrishna K,Brankamp R G,Kropp K E,et al. Strategies for optimal synthesis and secretion of heterologous proteins in the methylotrophic yeast Pichia pastoris[J]. Gene,1997,190(1,SI):55-62.
[12]王庆华,高丽丽,梁会超,等. 影响毕赤酵母高效表达重组蛋白的主要因素及其研究进展[J]. 药学学报,2014,49(12):1644-1649.
