TePDS1基因功能番茄遗传转化分析
2019-12-13王瑞鹏冯国栋徐焕焕王莹莹张恩启牛向丽
王瑞鹏 冯国栋 徐焕焕 王莹莹 张恩启 牛向丽


摘要 根据万寿菊转录组测序分析结果克隆PDS基因(TePDS1),并构建植物表达载体,利用农杆菌介导法将TePDS1进行番茄遗传转化。试验结果显示,TePDS1已整合于番茄基因组中,获得了表达万寿菊PDS基因的番茄植株,且转化番茄果实中的番茄红素含量明显高于野生型,表明TePDS1基因具有功能活性,可用于提高植物果实中色素含量。
关键词 万寿菊;八氢番茄红素脱氢酶;番茄;遗传转化;番茄红素
中图分类号 Q943.2文献标识码 A
文章编号 0517-6611(2019)22-0107-04
Abstract In this study, PDS gene (TePDS1) was cloned according to the transcriptome sequencing analysis of Tagetes erecta, and the plant expression vector of TePDS1 was constructed for transformation by Agrobacteriummediated method. The results showed that TePDS1 had been integrated into tomato genome, and tomato plants expressing marigold PDS gene were obtained. The content of lycopene in transformed tomato fruits was significantly higher than that of wild type, which suggested that TePDS1 had functional activity and could be applied for improvement of pigment content in fruits.
Key words Tagetes erecta;Phytoene desaturase;Tomato;Genetic transformation;Lycopene
类胡萝卜素是一类重要的天然色素的总称,属于萜类有机化合物[1]。迄今,被发现的天然类胡萝卜素已达600多种,对人体营养有意义的有40~50种[2]。番茄红素(lycopene)是类胡萝卜素的一种,也是这一生物合成途径中的上游产物。植物中类胡萝卜素生物合成途径为:两分子的牻牛儿基焦磷酸(geranylgeranyl diphosphate,GGPP)在八氢番茄红素合成酶(phytoene synthase,PSY)作用下缩合产生八氢番茄红素,八氢番茄红素经由八氢番茄红素脱氢酶(phytoene desaturas,PDS)等酶的共同作用生成番茄红素[3]。因此,PDS是类胡萝卜素合成途径的关键酶之一[4]。随着人们对八氢番茄红素脱氢酶关注度的提高,编码PDS的基因序列也从蓝细菌、藻类和高等模式植物中进行了克隆分离[5],进而对其序列特征以及它们在类胡萝卜素合成途径、光保护中的作用進行了研究,期望能将不同来源的PDS基因用于作物色素营养品质改良。
万寿菊(Tagetes erecta)为菊科万寿菊属一年生草本植物,原产于墨西哥及中美洲[6],具有易于栽培、花形大且绚丽多彩,植株能够较强吸收二氧化硫等特点[7-9],是观赏和绿化花卉之一。同时,万寿菊花中富含类胡萝卜素,而类胡萝卜素是维护人体健康所必需的摄入营养素,具有抗氧化、抗癌、预防心血管疾病等功能[10]。作为提取天然类胡萝卜素的重要植物资源,万寿菊又具有食用及药用价值,
可用于食品、药品、饲料及化妆品等的生产[11]。笔者前期工作中,通过对万寿菊不同组织、花发育阶段组织进行转录组高通量测序,获得了PDS基因组装序列,并从花中克隆分离了该基因,命名为TePDS1。笔者通过构建TePDS1植物表达载体、番茄遗传转化、鉴定,及果实中的番茄红素含量测定,分析TePDS1基因功能活性,并对其用于培育和筛选高色素植物材料进行探讨。
1 材料与方法
1.1 材料
1.1.1 植物材料。万寿菊品种Juwang、野生型番茄品种Micro-Tom的种子由笔者所在实验室保存,种植于合肥工业大学植物培养室。
1.1.2 菌株与载体。大肠杆菌(Escherichia coli)菌株DH5a、根瘤农杆菌(Agrobacterium tumefaciens)菌株EHA105、植物表达载体pBI121,均由笔者所在实验室保存。
1.1.3 仪器与试剂。Alliance E2695高效液相色谱仪(美国WARTERS公司);Hitachi UH5300双光束分光光度计(日本日立公司);Nano Drop 2000超微量分光光度计(美国Thermo Scientific公司);基因扩增仪(美国 ABI公司)。Trizol、反转录酶购于Invitrogen公司;高保真DNA聚合酶购于北京全式金生物技术有限公司;质粒提取试剂盒、DNA纯化试剂盒、琼脂糖胶回收试剂盒购于天根生化科技有限公司;T4 DNA Ligase,购于Thermo Scientific;限制性内切酶Xba I、Sac I,购于大连宝生物公司;引物设计采用Primmer Premmier 5.0软件,由苏州金唯智生物科技有限公司合成;番茄红素标准品购于上海源叶生物科技有限公司;乙腈、二氯甲烷、甲醇为国产色谱纯。其他试剂均为进口分装或国产分析纯。
1.2 方法
1.2.1 TePDS1基因生物信息学分析。
利用ExPASy软件(http://web.expasy.org/protparam/),对实验室前期获得的万寿菊TePDS1(MF421535)编码蛋白的理化性质进行分析。通过同源建模方法(SWISS-MODEL),对TePDS1进行蛋白质三级结构预测。同时,在NCBI数据库中通过比对搜索其他植物物种PDS基因序列,使用MEGA 5.0软件,采用邻接法(Neighbor-joining)绘制系统进化树,分析TePDS1的进化关系。
1.2.2 植物表达载体构建。
利用Trizol法提取万寿菊成熟花的总RNA,超微量分光光度计检测浓度、质量后用于反转录cDNA。根据TePDS1基因序列设计引物PDS1F(TGCTCTAGAATGTCTCTGTTATCAGCCACCA)和PDS1R(AAAGAGCTCTTAGACCAGACTTGCTTCAGCA),并引入Xba I、Sac I酶切位点。以cDNA为模板,对TePDS1进行PCR扩增。PCR产物经琼脂糖凝胶电泳、纯化后,以Xba I 和 Sac I进行酶切,同时对pBI121植物表达载体以相同的酶进行酶切。酶切片段進行胶回收、连接,并转化大肠杆菌DH5a。经菌落PCR和质粒酶切鉴定后进行测序验证,构建pBI121-TePDS1载体。利用冻融法将所构建载体转化农杆菌EHA105,鉴定筛选阳性克隆,于-80 ℃冰箱保存,用于后续试验。
1.2.3 TePDS1基因番茄遗传转化。
将Micro-Tom番茄种子经75%乙醇、15%次氯酸钠表面杀菌、清洗后置于1/2 MS培养基暗培养3 d,露白后光照培养4 d,获得无菌番茄幼苗。剪下幼苗子叶和茎段光照预培养3 d。利用农杆菌介导法,将带有pBI121-TePDS1载体的农杆菌(OD600=0.5~0.6)侵染预培养子叶和茎段15 min,然后转移至共培养基,25 ℃培养2 d。将转化愈伤组织转移至含有卡那霉素的筛选培养基(浓度依次为60、65和70 μg/mL),继代培养约60 d,挑选生长较好的分化小苗转移至生根培养基诱导生根,然后移栽至土壤中,获得番茄转基因植株。
1.2.4 转基因植株鉴定与表型分析。
以CTAB法从野生型、TePDS1转化番茄植株叶片提取基因组DNA。由于pBI121载体中带有新霉素磷酸转移酶 Ⅱ(NPTⅡ,AF485783)基因片段,可根据其序列设计引物(NPTⅡ-F,AGACAATCGGCTGCTCTGAT;NPTⅡ-R,TCATTTCGAACCCCAGAGTC)进行PCR扩增,对转基因植株进行DNA水平鉴定。取野生型、TePDS1转化番茄植株叶片提取总RNA、反转录,以cDNA为模板,番茄UBI3基因(NM001346406)为内参进行定量分析。定量引物分别为RTPDS1F(GCTCATACTATTACGGCTCGTCATC)、RTPDS1R(GTGAAGGTGGAAGACAAGTAAGCAG)和UBI13F(AGGTTGATGACACTGGAAAGGTT)、 UBI3R(AATCGCCTCCAGCCTTGTTGTA)。
取野生型、TePDS1表达的阳性转化番茄植株成熟果实外果,加入液氮研磨成粉末,称取约2 g于试管中。加入1.6 mL的BHT-乙醇溶液,涡旋振荡15 s。接着加入50% KOH溶液0.4 mL,涡旋振荡15 s后,置于60 ℃水浴锅水浴1 h,每隔15 min涡旋振荡1次。用2 mL丙酮超声提取3次,合并提取后混匀。吸取3 mL提取液过滤,采用高效液相色谱法(HPLC)测定番茄红素含量。高效液相色谱条件:色谱柱为Symmetry C18(250 mm×4.6 mm,5 μm);柱温30 ℃;流动相为乙腈∶二氯甲烷∶甲醇=7∶2∶1;流速为1 mL/min;检测波长472 nm;进样体积10 μL[12-13]。
2 结果与分析
2.1 TePDS1基因生物信息学分析
采用ExPASy软件对TePDS1编码蛋白理化性质进行分析,结果显示TePDS1编码550个氨基酸,相对分子质量约为62 kD;等电点为6.34;不稳定系数为46.63,属于不稳定蛋白;亲水性平均值为-0.117,属于亲水性蛋白。同源建模方法对TePDS1蛋白的三级结构预测如图1a所示。同时,系统进化(图1b)分析表明,在已报道向日葵(KF263656.1)、旋覆花(KY761959.1)、北野菊(KC202430.1)、莴苣(LOC111915314)、番木瓜(DQ666830.2)、番茄(Solyc544073)、拟南芥(Artha827061)、葡萄(JQ319635.1)、水稻(LOC4331854)PDS基因序列中,万寿菊TePDS1与向日葵同源基因的一致性最高。
2.2 植物表达载体构建
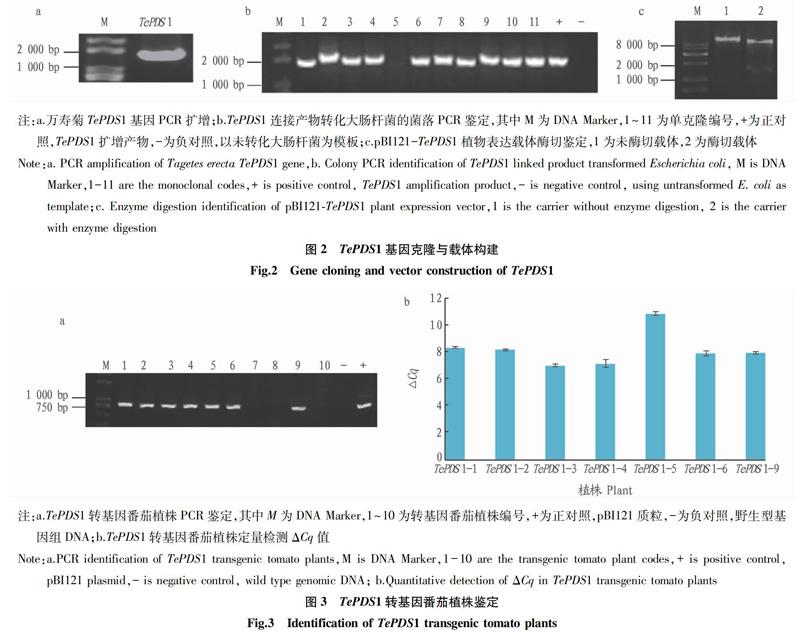
以万寿菊成熟花cDNA为模板,PCR扩增TePDS1基因编码序列。经凝胶电泳检测,显现预期1 653 bp条带(图2a)。将纯化PCR产物、载体pBI121分别进行Xba I 和 Sac I酶切,酶切产物胶回收后,连接并转入大肠杆菌DH5a感受态。挑取单克隆进行菌落PCR鉴定,结果如图2b所示,阳性克隆扩增得到与正对照大小一致条带。取阳性单克隆转接扩大培养后提取质粒,以Xba I 和 Sac I进行酶切鉴定(图2c),获得预期大小条带。将酶切鉴定阳性克隆进行测序,测序结果显示与目的基因序列相一致,表明pBI121-TePDS1载体构建完成。
2.3 TePDS1转基因番茄植株鉴定
利用上述农杆菌介导遗传转化方法,获得番茄转基因植株。提取TePDS1转化番茄植株基因组DNA。以野生型为对照,进行pBI121表达载体筛选标记NPTⅡ基因PCR扩增。结果如图3a所示,野生型未显现扩增条带,阳性转化植株扩增获得与正对照pBI121质粒相同大小特异条带。在TePDS1转化植株中,共有7株为阳性,转化片段已整合于基因组DNA。
取阳性转基因植株叶片,Trizol法提取总RNA。将RNA反转录为cDNA,进行定量PCR检测。由于TePDS1是万寿菊的功能基因,且与番茄同源基因的同源性较低,所以TePDS1基因在野生型番茄中无扩增产物。由于未进行万寿菊基因转化的野生型番茄在TePDS1定量检测中没有对应Cq值,在数据分析时采用转基因植株中导入外源基因与内参基因的Cq值差(ΔCq)描述各植株导入基因的表达水平(图3b)。ΔCq值越小,则表明转基因植株内转入目的基因的表达量越高。结果显示,转基因番茄阳性植物中表达了不同水平的万寿菊类胡萝卜素合成途径基因TePDS1,其中表达量最高的是3号植株,其次是4号和6号植株。
2.4 TePDS1转化番茄植株表型分析
根据分子鉴定结果获得万寿菊TePDS1基因的番茄转化植株。通过与野生型植株进行比较(图4a),表明TePDS1基因转入在叶片大小、株高、开花时间和果实熟期等方面对番茄未有明显影响。但TePDS1基因转化番茄植株的果实颜色较野生型深(图4b)。
取阳性转化植株TePDS1-3、TePDS1-4和TePDS1-6成熟果实,采用高效液相色谱检测番茄红素的含量,由图5可知,TePDS1转基因果实中番茄红素显著高于野生型。结果表明万寿菊类胡萝卜素合成途径基因TePDS1在番茄中表达,能够增加番茄红素的积累,验证了TePDS1的功能活性。
3 討论
八氢番茄红素脱氢酶(phytoene desaturase,PDS)是植物中类胡萝卜素生物合成代谢途径中的关键酶,它可以将无色的八氢番茄红素催化脱氢为9,9′-二顺式-ζ-胡萝卜素,之后由ζ-胡萝卜素脱氢酶(ZDS)和类胡萝卜素异构酶(CRTISO)催化合成番茄红素,由此再进一步生成下游的其他类胡萝卜素[14-16]。PDS 位于类胡萝卜素生物合成途径的上游,是代谢途径中的关键限速酶之一,影响整个代谢途径的合成速度和产物水平。该研究从高色素含量植物材料万寿菊中克隆TePDS1 基因,其编码序列与向日葵、旋覆花、北野菊、莴苣、番木瓜、番茄、拟南芥、葡萄、水稻的同源性均为80%以上,表明不同植物来源PDS 具有保守的重要共同功能。
虽然类胡萝卜素生物合成途径在植物中保守存在,但不同植物物种中类胡萝卜素的含量和成分组成有很大差异。叶黄素、胡萝卜素、番茄红素等类胡萝卜素成分具有重要的营养作用,主要由膳食获取或食物中添加。为验证万寿菊中TePDS1的功能和应用潜力,该研究通过遗传转化方法将万寿菊中TePDS1基因整合于模式果蔬作物番茄中,转基因植株主要农艺表型未受明显影响,但果实中番茄红素含量显著增加,表明来源于万寿菊的TePDS1基因具有功能活性,可用于培育和筛选高色素植物材料。
目前,从对模式植物的研究中,已经对类胡萝卜素生物合成途径主要过程步骤及其催化基因有了比较清晰的认识,也为应用基因工程技术改变农作物的类胡萝卜素成分和提高类胡萝卜素含量奠定了基础。但对于控制这一合成途径的调控基因仍报道不多。在该研究中,通过转入万寿菊功能基因TePDS1,使番茄果实中番茄红素增加,为提高植物果实色素营养品质提供了新的基因资源和研究基础。后续可进一步探讨利用组学、生物学等方法鉴定分离万寿菊色素合成调控基因,尝试利用调控基因对番茄中类胡萝卜素生物合成途径进行整体调节和遗传改良。
参考文献
[1] 张建成,刘和.植物类胡萝卜素生物合成及其调控与遗传操作[J].中国农学通报,2007,23(11):211-218.
[2] 周红.类胡萝卜素的作用与功效[J].世界今日医学杂志,2006(2):140-141.
[3] 邹礼平,高和平,钟亚琴.植物番茄红素生物合成相关基因的表达调控研究进展[J].安徽农业科学,2009,37(33):16232-16233,16242.
[4] 王飞.甘薯类胡萝卜素合成酶基因pds全长cDNA的克隆[J].安徽理工大学学报(自然科学版),2007,27(1):55-58.
[5] 李春季,李炳学,韩晓日.八氢番茄红素脱氢酶的研究进展[J].微生物学报,2016,56(11):1680-1690.
[6] 田丽,冯国栋,刘莹,等.色素万寿菊不同栽培品种农艺性状和叶黄素量的比较[J].合肥工业大学学报(自然科学版),2018,41(5):703-707.
[7] DU R C,LIU J D,SUN P P,et al.Inhibitory effect and mechanism of Tagetes erecta L.fungicide on Fusarium oxysporum f.sp.niveum[J].Scientific reports,2017,7(1):1-13.
[8] HOOKS C R R,WANG K H,PLOEG A,et al.Using marigold(Tagetes spp.)as a cover crop to protect crops from plantparasitic nematodes[J].Applied soil ecology,2010,46(3):307-320.
[9] 李德臣,陈培忠.三种万寿菊属植物提取物对两种蚊虫的毒效[J].预防医学情报杂志,1996(1):36-37.
[10] 黄晨.万寿菊中类胡萝卜素的分离及性质研究[D].天津:天津商业大学,2008.
[11] 刘洪海,杜平,梁红兵,等.万寿菊花中叶黄素酯的提取及皂化工艺的研究[J].农产品加工,2009(3):71-74,77.
[12] RODRIGUEZAMAYA D B.A guide to carotenoid analysis in food[M].Washington,DC:ILSI Press,2001:41-45.
[13] 赵洁,尹俊涛,李超鹏,等.HPLC测定万寿菊干花和万寿菊颗粒中叶黄素含量[J].农垦医学,2010,32(6):496-499.
[14] 高慧君,明家琪,张雅娟,等.园艺植物中类胡萝卜素合成与调控的研究进展[J].园艺学报,2016,42(9):1633-1648.
[15] TUAN P A,THWE A A,KIM J W,et al.Molecular characterisation and the lightdark regulation of carotenoid biosynthesis in sprouts of tartary buckwheat(Fagopyrum tataricum Gaertn.)[J].Food chemistry,2013,141(4):3803-3812.
[16] FENG G D,HUANG S X,LIU Y,et al.The transcriptome analyses of Tagetes erecta provides novel insights into secondary metabolite biosynthesis during flower development [J].Gene,2018,660:18-27.
