副猪嗜血杆菌Hps-SX19株药物敏感性研究
2019-12-13谈小龙张黎张佳郑龙龙
谈小龙 张黎 张佳 郑龙龙

摘要 为了解山西某规模化猪场5月龄猪群副猪嗜血杆菌(Haemophilus parasuis,Hps)的敏感药物情况,采集病死猪胸腔积液5份,通过细菌染色、形态观察、PCR检测,从胸腔积液样品中检测出5株Hps,根据其药物敏感特性推测其为同一菌株,将其命名为Hps-SX19。此次试验获得的Hps菌株为超级耐药株,该菌对β-内酰胺类、截短侧耳素类、林可胺类药物敏感,对氨基糖苷类、氯霉素类、喹诺酮类药物产生耐药性,给生产上敏感药物的选择带来了巨大的困扰,降低了猪群的整体健康情况,为非洲猪瘟进场提供了便利,可能会带来巨大损失。
关键词 Hps;K-B法;敏感药物;超级细菌
中图分类号 S859文献标识码 A
文章编号 0517-6611(2019)22-0085-03
Abstract In order to understand the sensitive drug situation of Haemophilus parasuis(Hps) in a 5monthold pig herd of a largescale pig farm in Shanxi Province,5 samples of pleural effusion were collected from sick and dead pigs. 5 strains of Hps were detected in pleural effusion samples by using bacterial staining, morphological observation and PCR detection. Based on its drug sensitivity characteristics, it was speculated to be the same strain,named as HpsSx19. Hps strain obtained in this experiment was a super drugresistant strain, which was sensitive to lacta mines, pleurotropin and lincomyla mine, and it was resistant to a minoglycosides, chloramphenicol and quinolones, which brought great troubles to the selection of sensitive drugs in the production, reduced the overall health status of swine herd, facilitated the occurrence of African swine fever, and brought huge losses.
Key words Hps;KB method; Sensitive drugs;Super bacteria
副豬嗜血杆菌(Haemophilus parasuis,Hps)常引起纤维素性肺炎、关节炎为主要症状的一种细菌性传染病,以高发病率和高死亡率为特征,给养猪业带来了严重损失,因此应对此病引起高度重视。38.9%~77.8%的健康猪携带Hps致病菌[1-2],2~8周龄的青年猪易感,发病率一般为10%~20%,严重时死亡率在50%以上[3-4]。
2019年3月山西省一家规模化育肥场5月龄开始发病,精神沉郁、食欲废绝,体温 41 ℃,呼吸困难,呈腹式呼吸。胸腔、心包及腹腔有多量纤维性渗出物,可见绒毛心;全身淋巴结肿大、暗红色,切面呈大理石花纹样。笔者对猪高热病副猪嗜血杆菌的感染进行了初步研究,分离、鉴定了5株副猪嗜血杆菌,并进行了药敏试验,旨在为指导猪场合理用药、控制和治疗高热病继发感染该病提供依据。
1 材料与方法
1.1 材料
1.1.1 样品来源。2019年3月无菌采集来自山西省某规模化养殖场出现急性死亡、纤维素性心包炎猪的胸腔积液及肺脏5份。
1.1.2 试验材料。巧克力琼脂、血琼脂、Hps阳性菌株、金黄色葡萄球菌、麦氏比浊管等,由山西农业大学病理实验室提供。
1.2 方法
1.2.1 分离培养及培养特性检查。参考GB/T 34750—2017 《副猪嗜血杆菌检测方法》,无菌采集肺脏、胸腔积液接种于巧克力琼脂平板、血琼脂平板, 37 ℃ 5 %~10 % CO2 培养 36 h 后,观察其在培养基上的生长表现、菌落特征以及在血琼脂平板上的溶血性等培养特性。
1.2.2 卫星现象检查。将鲜血琼脂平皿用无菌棉签均匀涂布此次分离的细菌,在其中一部分划线接种金黄色葡萄球菌, 37 ℃下培养36 h,观察其是否在葡萄球菌周围出现“卫星现象”。
1.2.3 PCR鉴定。将分离纯化的菌株用接种环挑取菌落接种于含5 mL无菌不含琼脂的巧克力液体培养基玻璃管中,37 ℃ 5 %~10 %CO2 培养 36 h 后,使用麦氏比浊管调整菌液浓度至1.5×108个/mL,取1 mL菌液10 000 r/min离心5 min,弃去上清液,沸水中水浴10 min,10 000 r/min离心5 min取上清作为PCR模板。根据副猪嗜血杆菌OmpP5基因(M75065)序列设计引物[5],由上海生工生物技术公司合成。P1为5′-GTGATGAGGAAGGGTGGGT-3′,P2为5′-GGCI'CGACCCTCTGT-3′;其中10×PCR Buffer 2.5 μL,dNTP Mixture 1 μL,上游和下游引物终浓度为0.2 μmol/L,Taq DNA聚合酶0.5 μL,模板300 ng(1.5~2.0 μL),加水补足25 μL。PCR条件如下:94 ℃5 min;94 ℃30 s,56 ℃30 s,72 ℃60 s,30个循环;72 ℃30 s。取8 μL PCR产物与适量上样缓冲液混合后,在120 V电压条件下用1.5%的琼脂糖凝胶电泳30 min后,使用凝胶成像系统观察并记录结果。
1.2.4 动物致病性试验。将分离菌株接种到营养肉汤中37 ℃恒温培养36 h,取1.0 mL接种于2月龄小鼠腹腔中,设置空白对照组。接种后连续7 d,每天3次观察小鼠状况。
1.2.5 药敏试验。将分离菌株接种到营养肉汤中37 ℃恒温培养24 h后,使用麦氏比浊管调整菌液浓度至1.5×108个/mL。按照常规细菌接种方法取100 μL菌液均匀涂抹在巧克力琼脂培养基上,并贴上标准药敏纸片(直径6 mm),在4 ℃条件下放置30 min。然后,再移入37 ℃恒温培养箱中培养36 h,观察并测量抑菌圈直径,最后根据美国临床实验室标准化协会(CLSI)标准判定结果。
2 结果与分析
2.1 分离菌株的培养特性 分离菌株在巧克力培养基上培养36 h后生长良好,形成针尖大小菌落,钓取菌落进行染色并镜检,发现分离菌株符合副猪嗜血杆菌的形态和染色特征。在普通肉汤和营养琼脂,37 ℃培养36 h后未见细菌生长。在血平板上培养 36 h后,可见有针尖大小、圆形、边缘整齐、灰白色半透明的小菌落生长,不表现溶血现象。
2.2 致病性试验结果 小鼠接种菌液16~36 h 内全部死亡,对照组无异常,取其胸腔积液接种于巧克力琼脂培养基上,分离到同样的细菌。
2.3 PCR鉴定结果 猪场分离到的致病性Hps基因进行
PCR扩增,经琼脂糖凝胶电泳获得大小约380 bp的特异性目的条带(图1),与预期结果相符。
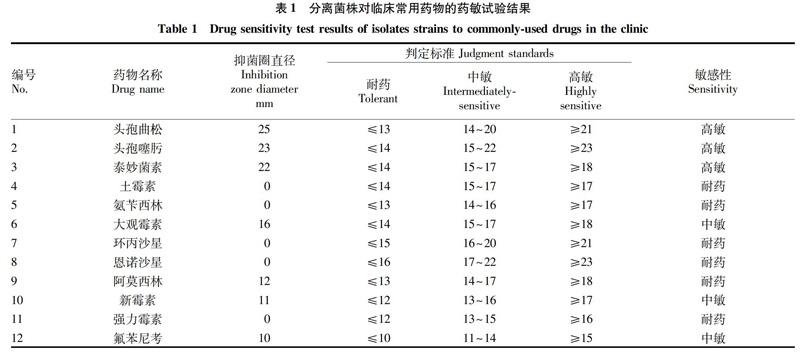
2.4 药敏试验结果 此次获得的Hps-SX19菌株为超级耐药株。药敏试验结果表明,该分离菌株对β-内酰胺类第三代头孢类药物头孢曲松和头孢噻肟、截短侧耳素类(泰妙菌素)、林可胺类(大观霉素)药物敏感,对β-内酰胺类氨苄西林和阿莫西林、氨基糖苷类(新霉素)、四环素类(土霉素、强力霉素)、氯霉素类(氟苯尼考)、喹诺酮类(恩诺沙星、环丙沙星)药物产生耐药性(表1)。
3 结论与讨论
我国养猪环境差,疾病防控压力大,因此常选用抗生素广泛应用于兽医临床保健,已经是治疗猪疾和保障生产的重要工具;由于抗生素的频繁使用,导致大量细菌耐药菌株的持续出现,给养猪生产带来了巨大危害,但目前尚未发现完全耐药的超级细菌[6-10],處于可控范围内,因此持续跟踪当前敏感药物及回顾性研究耐药性,对于提高生产成绩、食品安全具有十分重要的意义。
Hps是猪上呼吸道的常见菌,该病的治疗效果较差,预防才是上策,该病通常是作为继发或并发感染发生的,常伴有支原体、附红细胞体的混合感染。通常情况下,疫苗是疾病预防的首选,但对该菌作用甚微,有很多分离株不能被分型,目前已经投入使用的疫苗对猪群免疫后虽然能够提高猪群对副猪嗜血杆菌的抵抗力,大大降低了猪群暴发或继发副猪嗜血杆菌的概率[11-14];但随着非洲猪瘟的肆虐,疾病更加复杂化,猪群抵抗力可能因为过度消毒而降低,造成Hps防控压力更大,因此需要多种方案共同作用。
该研究对分离到的Hps-SX19株进行了7类12种抗生素的药物敏感性分析,结果表明致病性Hps-SX19株对β-内酰胺类第三代头孢类药物、截短侧耳素类泰妙菌素、林可胺类大观霉素)药物敏感,对β-内酰胺类氨苄西林、阿莫西林、氨基糖苷类新霉素、四环素类土霉素、强力霉素、氯霉素类氟苯尼考、喹诺酮类恩诺沙星、环丙沙星产生耐药性,呈现出多重耐药性。
该研究从药物敏感性的角度对Hps进行了初步研究,通过分离和鉴定发病猪场致病菌,并对分离株Hps-SX19进行敏感药物性筛选,为进一步跟踪山西规模化猪场发生Hps的复杂病因和临床用药提供一定的科学参考。
参考文献
[1] OLVERA A,PINA S,MACEDO N,et al.Identification of potentially virulent strains of Haemophilus parasuis using a multiplex PCR for virulenceassociated autotransporters (vtaA)[J].The veterinary journal,2012,191(2):213-218.
[2] 高丰,罗毅,成军,等.猪副嗜血杆菌感染的诊断与防治[J].动物医学进展,2002,23(6):101-103.
[3] 刘正飞,蔡旭旺,陈焕春,等.副猪嗜血杆菌研究进展[J].动物医学进展,2003,24(5):17-19.
[4] 白艳艳,张斌,刘健鹏,等.榆林市一起副猪嗜血杆菌病的诊治[J].动物医学进展,2018,39(10):130-133.
[5] 王超,陈欣,张梦南,等.副猪嗜血杆菌的分离鉴定及其OmpP5基因序列分析[J].动物医学进展,2018,39(1):16-21.
[6] 李曦婷,董俏,李化生,等.副猪嗜血杆菌检测技术及耐药性研究进展[J].动物医学进展,2016,37(10):85-89.
[7] 王建,邵卫星,吕占军,等.2012年我国部分省市规模化猪场副猪嗜血杆菌分离鉴定及菌株血清分型[J].动物医学进展,2014,35(3):48-52.
[8] ZHAO Y D,WANG Q,LI J,et al.Epidemiology of Haemophilus parasuis isolates from pigs in China using serotyping, antimicrobial susceptibility,biofilm formation and ERICPCR genotyping[J].PeerJ,2018,6:5040-5043.
[9] ZHANG L,LI Y,WANG Y,et al.Integration of pharmacokineticpharmacodynamic for dose optimization of doxycycline against Haemophilus parasuis in pigs[J].Journal of veterinary pharmacology and therapeutics,2018,41(5):706-718.
[10] ZHAO Y D,GUO L L,LI J,et al.Characterization of antimicrobial resistance genes in Haemophilus parasuis isolated from pigs in China[J].PeerJ,2018,6:4613-4630.
[11] JIA A Q,ZHOU R Y,FAN H Y,et al.Development of serotypespecific PCR assays for typing of Haemophilus parasuis isolates circulating in southern China[J].J Antimicrob Chemother,2017,55(11):3249-3257.
[12] WU X L,XIAO L,WANG Y,et al.Genetic variants and phylogenetic analysis of Haemophilus parasuis (HPS) OMPP2 detected in Sichuan, China from 2013 to 2015[J].J Vet Med Sci,2017,79(10): 1648-1651.
[13] WANG Z H,ZHAO Q,WEI H L,et al.Prevalence and seroepidemiology of Haemophilus parasuis in Sichuan province, China[J].PeerJ,2017,5:3379-3384.
[14] LI Y F,KWOK A H,JIANG J W,et al.Complete genome analysis of a Haemophilus parasuis serovar 12 strain from China[J].PLoS One,2013,8(9):683-685.
