玉露的组培快繁与变异研究
2019-12-13陈娟刘琪张定珍韩素菊
陈娟,刘琪,张定珍,韩素菊
(绵阳师范学院城乡建设与规划学院,四川绵阳 621000)
玉露(Haworthia cooperiBaker)属于百合科十二卷属软叶品种,原产南非,现世界多地均有栽植。玉露因其透亮如露珠的外形很受欢迎,市场需求较大[1-2]。
玉露生长较为缓慢,产量少,个别稀有品种母本难求。玉露采用叶插、根、枝插、分株和种子等方式进行繁殖,但均存在繁殖系数小、繁殖速度慢的问题,短时间内难以满足市场需要[3-4]。另外,玉露变异(嵌合体)品种稀少,只能通过杂交的方式获得,概率低,数量少,价格昂贵。目前,关于玉露的组织培养快繁及变异的研究较少[5-7]。陈红刚等[1]和宋扬[6]以玉露花茎为外植体建立了组培快繁体系,但花茎取样有时间限制,不如叶片方便。该研究以玉露叶片为试验材料,构建了玉露组织培养快繁体系,并且利用不同浓度的诱变剂溴化乙锭诱导玉露变异体,旨在为实现玉露规模化生产和进一步的品种选育提供科学依据。
1 材料与方法
1.1 玉露组织培养体系建立
1.1.1 愈伤组织的诱导。取新鲜玉露叶片,置流水下冲洗约30 min 后,置于浓度为2%次氯酸钠(NaClO)溶液中浸泡15 min,在超净工作台紫外光灯下消毒30 min,80%酒精消毒10 s 后接种。在酒精灯旁操作,剪刀、镊子均在酒精灯火焰上灼烧后接种,接种时切除叶端,每瓶接种5 片玉露叶片。按照培养基中不同的激素浓度配比处理分为4 组,每组8 瓶。处理1 为:MS+6BA 0.1 mg/L+NAA 0.1 mg/L;处理2 为:MS+6BA 0.2 mg/L+NAA 0.2 mg/L;处理3 为:MS+6BA 0.3 mg/L+NAA 0.3 mg/L;处理4 为:MS+6BA 0.4 mg/L+NAA 0.4 mg/L。接种好后置于2000 Lx 光照和温度25℃下培养。观察愈伤组织生长情况,记录出愈时间及比例,确定最佳愈伤组织培养基。当愈伤组织大量分化时开始继代,继代培养基选用MS+6BA 0.2 mg/L+NAA 0.2 mg/L。
1.1.2 愈伤组织的丛芽分化培养。愈伤组织丛芽分化培养基处理分为4 组,处理1 为:MS+6BA 0.1 mg/L+NAA 0.1 mg/L;处理2 为:MS+6BA 0.2 mg/L+NAA 0.2 mg/L;处理3 为:MS+6BA 0.3 mg/L+NAA 0.3 mg/L;处理4 为:MS+6BA 0.4 mg/L+NAA 0.4 mg/L。每个处理为8 瓶,每瓶8 个愈伤组织块。取继代培养中生长良好的大小均匀的愈伤组织,在2000 Lx 光照和温度25℃下培养。记录出芽时间及生长状况。
1.1.3 壮苗与生根培养。复壮生根培养基选用4 种不同激素配比。处理1:1/2MS+6BA 0.1 mg/L+NAA 0.1 mg/L;处理2 为:1/2MS+6BA 0.2 mg/L+NAA 0.2 mg/L;处理3 为1/2MS MS+6BA 0.3 mg/L+NAA 0.3 mg/L;处理4 为:1/2MS MS+6BA 0.4 mg/L+NAA 0.4 mg/L。在超净工作台上,选用生长良好的丛芽,将剪刀和镊子在酒精灯上灼烧冷却后,切除丛芽基部,将丛芽插入培养基,在2000 Lx 光照和温度25℃下培养。记录生根时间及生长状况。
1.1.4 出瓶与硬化。硬化基质为泥炭土∶蛭石∶珍珠岩1∶1∶1 均匀混合,喷水使其湿润。将组培苗栽入基质,浇透水,置于阴凉通风处,避免阳光直射。后期每10 d 浇水,注意通风和适当遮阴。
1.2 玉露诱变体系建立
1.2.1 玉露变异嵌合体诱导。诱导变异试验共分为4 组,每组24 瓶。以MS+6BA 0.2 mg/L+NAA 0.2 mg/L为基础培养基,分别加入不同浓度的溴化乙锭,其浓度梯度为:0、1、10 和100 mg/L。在4 种培养基中分别接种疏松且具有明显丛芽分化趋势的大小均匀的愈伤组织,置于2000 Lx 光照和温度25℃下培养90 d,期间不断继代与分瓶。记录嵌合体变异及生长状况。将诱导出变异的愈伤组织接种在丛芽分化培养基MS+6BA 0.2 mg/L+NAA 0.2 mg/L 中,使其分化成丛芽。
1.2.2 嵌合体变异强化。选取生长状况良好的玉露嵌合体一代复壮生根丛苗,切下嵌合体变异明显的叶片,尽量保持切口面积大和光滑,将叶片横放在培养基MS+6BA 0.2 mg/L+NAA 0.2 mg/L 中,伤口50%埋入培养基,50%露在空气中,以利于愈伤组织的形成。待愈伤组织大量形成,将愈伤组织一部分继代在MS+6BA 0.1 mg/L+NAA 0.1 mg/L,以得到更疏松的愈伤组织,一部分继代在MS+6BA 0.2 mg/L+NAA 0.2 mg/L,以促使其分化成苗。以嵌合体一代苗再次组培强化变异可得到嵌合体二代。
1.2.3 嵌合体变异苗的出瓶与硬化。出瓶过程中,硬化基质采用泥炭土∶珍珠岩∶蛭石1∶1∶1。将组培苗栽入基质中,置于阴凉通风处,浇透水,避免阳光直射。后期每隔10 d 浇水,注意通风和适度遮阴。
2 结果与分析
2.1 玉露组培体系的构建
2.1.1 激素浓度对玉露愈伤组织生成的影响。在组培过程中,叶片膨大形成透明体后开始形成愈伤组织,20 d 后在处理2 和处理3 的培养基上形成少量愈伤组织,30~40 d 开始大量形成愈伤组织。在60 d时接入的叶片在所有培养基上均达到60%以上的出愈率,其中处理2 培养基上出愈率最高,达到85%。从表1 和图1a、b 可以看出,处理2 中的愈伤组织形成速度和出愈外植体数均显著高于其他处理。其次是处理3,在各个培养时间均高于其他2 个处理。随着培养基中细胞分裂素6-BA 和NAA 激素浓度的成倍增加,其对愈伤组织生成的促进作用表现为先增强,后逐渐减弱趋势,表明植物激素浓度超过一定的阈值范围时,其增加并不能促进愈伤组织生成。
2.1.2 不同激素配比处理对愈伤组织丛芽分化的影响。如表2 和图1c、d 所示,不同激素浓度处理对玉露愈伤组织的丛芽生成率影响显著,随着时间的延长,出芽率呈上升趋势。在40 d 时,有50%以上的愈伤组织分化成芽,其中处理2 培养基上的丛芽生成率最高,并且其出芽速度快,在20 d 时已有59%的愈伤组织分化成芽,在30 d 时有92%分化成芽,表明处理2 的激素浓度对于愈伤组织的增殖和丛芽的分化效果最明显,为最佳激素配比。其余处理中,处理4 培养基中的丛芽生成率最低。
2.1.3 不同激素浓度配比对丛芽生根的影响。玉露丛生芽接入生根培养基后,1 周后能够看见萌发的新根。随着培养时间的延长,各处理的生根率逐步上升。如表3 和图2 所示,处理1 的生根培养基上玉露生根快,生根率高,在25 d 时生根率为70%,在40 d时可达到97%。处理2 的培养基生根效果要优于处理3 和处理4,40 d 处理2 上的培养基可达到59%。处理3、4 生根效果不良,两者间无明显差异。
2.2 玉露的变异诱导
高浓度的溴化乙锭对玉露愈伤组织的增殖与丛芽的分化有明显的抑制作用。丛芽分化少、生根慢、根长势差,甚至不长根。丛芽基部对溴化乙锭有较大的吸附作用。

表1 不同激素浓度处理对玉露愈伤组织生成的影响

表2 不同激素配比对玉露愈伤组织丛芽生成率的影响

图1 处理2 愈伤组织丛芽分化情况

图2 处理1 丛生芽分化成根情况
在溴化乙锭浓度为1 mg/L 培养基中得到嵌合体个体,在MS+6BA 0.2 mg /L +NAA 0.2 mg/L 培养基中继续继代后产生大量的嵌合体丛芽(图3、图4a)。取嵌合体一代苗的叶片,再次组培形成嵌合体二代苗,以促进形成大量嵌合体变异的愈伤组织和丛芽,嵌合体二代个体强化了嵌合体一代个体的变异(图4b、c),并发现有少量无叶绿素的个体(图4d)。
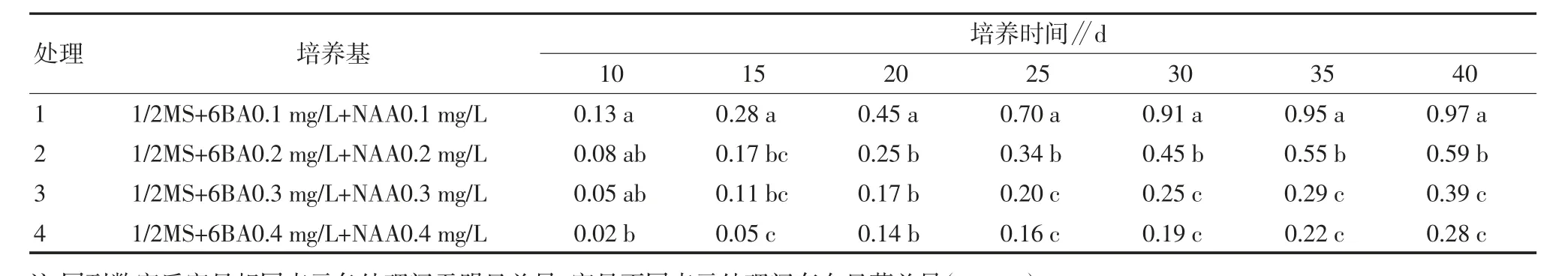
表3 不同激素配比对玉露丛芽生根的影响

图3 MS+6BA 0.2 mg/L+NAA 0.2 mg/L 培养基上嵌合体生长情况

图4 嵌合体后代生长情况
3 讨论和结论
与陈丽等[5]和张景新等[4]以叶片外植体建立的组培体系相比,该试验采用了不同的激素种类与浓度,但是获得了较好的愈伤组织诱导率、芽分化率和生根率。目前玉露诱导变异的研究较少,周海成等[7]采用冰灯玉露松散型胚性愈伤组织为诱变试材,在培养基中加入0.1%EMS 处理后获得形态变异个体。该试验采用了不同的诱变剂,用低剂量的溴化乙锭诱导出可遗传变异的嵌合体。诱导育种是园艺植物品种选育的途径之一[8]。不同的诱导剂可能诱导出不同的形态变异。未来还可探讨不同诱导剂的诱导效应,或者采用某些射线等物理诱导方法来进行玉露品种选育。
该试验以玉露叶片为外植体构建了组培快繁体系。确定的最佳愈伤组织诱导培养基和丛芽分化培养基为MS+6BA 0.2 mg/L +NAA 0.2 mg/L,壮苗生根培养基为1/2MS+6BA 0.1 mg/L+NAA 0.1 mg/L。此外,在愈伤组织培养基中添加1 mg/L 溴化乙锭时,后代产生了生长良好的嵌合体变异品种。
