黄芪多糖预处理对肾缺血再灌注损伤大鼠细胞凋亡的影响
2019-12-12王莹
王莹


【摘 要】 目的:探讨黄芪多糖预处理对肾缺血再灌注损伤大鼠细胞凋亡的影响及机制。方法:SD大鼠30只随机分为假手术组、模型组和黄芪多糖干预组,每组各10只。黄芪多糖干预组在建模前,每天给予黄芪多糖450 mg/kg灌胃,连续用药10 d,1次/d;假手术组和模型组以相同方式灌胃等体积的生理盐水。模型组与黄芪多糖干预组建模,假手术组只分离不建模,48 h后肾动脉采血,立即处死大鼠并取肾脏组织。全自动生化分析仪测定血清中的尿素氮(BUN)、肌酐(Cr)含量,TUNEL法检测肾脏细胞凋亡,免疫组化检测肾组织Bax和Bcl-2蛋白含量表达。结果:与假手术组比较,模型组大鼠血清BUN、Cr含量明显升高(P<0.01);与模型组比较,黄芪多糖干预组大鼠血清BUN和Cr含量明显下降(P<0.01)。与假手术组比较,模型组肾脏细胞凋亡指数明显升高(P<0.01);与模型组比较,黄芪多糖干预组大鼠肾脏细胞凋亡指数明显降低(P<0.01)。与假手术组比较,模型组肾脏Bax表达明显升高,Bcl-2表达明显下降(P<0.01);与模型组比较,黄芪多糖干预组大鼠肾脏Bax表達明显降低,Bcl-2表达明显升高(P<0.01)。结论:黄芪多糖预处理具有减轻肾脏细胞凋亡,改善肾功能的作用,其机制可能与下调Bax蛋白表达,以及上调Bcl-2蛋白表达有关。
【关键词】 黄芪多糖;细胞凋亡;Bcl-2;Bax
【中图分类号】R285.5 【文献标志码】 A 【文章编号】1007-8517(2019)18-0012-03
肾缺血再灌注损伤(Renal Ischemical Reperfusion Injury,RIRI)是指在肾缺血的基础上,当恢复血流灌注后,损伤不仅没有改善,反而加重的现象[1]。RIRI发病机制复杂,其中继发性的细胞凋亡可能起到重要作用[2],通过抑制细胞凋亡来作为治疗的靶点,为研究开发新型药物开辟了新的途径。从中医学的角度来看,细胞凋亡与中医正气学说有密切联系[3]。RIRI根据其临床表现可将其归于“关格”“虚劳”“溺毒”“癃闭”等范畴,其病因病机皆与脾肾有关,脾肾两虚易致浊毒内蕴、邪气增多[4]。《素问·通评虚实论》曰:“邪气盛则实,精气夺则虚”。
黄芪为豆科类植物膜荚黄芪或者蒙古黄芪干燥后的根,其味甘、性微温,归脾肺经。《本草汇言》赞其为“补肺健脾,实卫敛汗,驱风运毒之药也”。国内外研究表明其具有保护肾脏,对肾脏疾病具有治疗作用[5]。黄芪多糖(Astragalus Polysac charides,APS)为黄芪的有效成分之一,在心肌[6]、脑[7]的缺血再灌注损伤中具有抗细胞凋亡的作用。肾脏作为缺血再灌注损伤的常见器官之一,APS是否通过抗细胞凋亡,发挥对RIRI的保护作用,还未见相关报道。实验拟通过在大鼠体内复制RIRI模型,从抗细胞凋亡角度分析APS对RIRI作用的机制,以期为临床APS的运用提供实验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 健康雄性成年S-D大鼠30只,体重200~300 g左右,购于山西医科大学实验动物中心,编号:SXYK180605120。分组饲养,室温控制在20~25 ℃,空气湿度控制在50%~55%,饮食与饮水均标准化供给。
1.1.2 实验药品和试剂 APS(批号:1803152230,上海康舟真菌多糖公司);TUNEL细胞凋亡检测试剂盒(批号:18I03AJ,武汉博士德生物工程有限公司);肌酐(Cr)试剂盒、尿素氮(BUN)试剂盒均购自于南京建成生物工程研究所,批号皆为201809036;Bax(Bcl-2 associated X蛋白质,批号:2343179)、Bcl-2(B淋巴细胞瘤-2基因,批号:185641)免疫组化试剂盒购自于武汉博士德生物工程有限公司。
1.1.3 仪器 7020型全自动生化分析仪(日本HITAHI公司);TS-12U型生物组织自动脱水机(孝感市宏业医用仪器有限公司);TDK-BMB型石蜡冰冻切片机(浙江金华市益迪医疗设备厂);显微镜(日本尼康公司);DMR+Q550型病理图像分析仪(德国Leica公司)。
1.2 方法
1.2.1 建模和分组 30只大鼠随机分为3组:模型组、假手术组和APS干预组,每组10只。手术前12 h禁食不禁水,各组动物以45 mL/kg剂量戊巴比妥钠腹腔注射进行全身麻醉。仰卧位固定,沿腹正中切开腹部,模型组大鼠游离双侧肾脏并分离肾动脉,用无创动脉夹夹闭双侧肾动脉60 min,然后松开动脉夹,肾脏由紫黑色变为鲜红,表明模型制备成功,如果松开动脉夹5 min后,肾脏颜色没有变为鲜红色,说明模型制作失败,这种大鼠被剔除。假手术组只沿腹正中切开腹部,并分离左右肾脏,不夹闭肾动脉。APS干预组在模型制作前给予450 mg/kg APS灌胃,连续用药10 d,1次/d,假手术组与模型组给予等量的生理盐水灌胃。各组大鼠手术后单笼常规饲养,48 h后肾动脉采血,然后处死大鼠并摘取肾脏组织。
1.2.2 血清BUN、Cr含量测定 将采集的血液,以3000 r/min离心15 min后提取血清。参照说明书通过全自动生化分析仪测定血清中的BUN、Cr含量。
1.2.3 TUNEL法检测肾脏细胞凋亡 取肾组织固定,常规石蜡包埋、切片,严格参照细胞凋亡检测试剂盒说明书对肾脏凋亡细胞进行检测。光镜下凋亡细胞核染色为棕黄色。在显微镜(×400)下,每张切片随机选择5个非重叠视野进行观察,计数凋亡细胞数目,取平均值,计算细胞凋亡指数,具体公式为:细胞凋亡指数=(凋亡细胞数/总细胞数)×100%
1.2.4 免疫组化检测肾组织Bax和Bcl-2蛋白表达 制备肾组织切片,用SABC免疫组化染色法检测Bax、Bcl-2的表达,操作步骤严格参照试剂盒说明书。Bax和Bcl-2表达阳性结果为胞浆染色呈棕色,不着色者为阴性。在显微镜(×400)下,每张切片随机选择5个非重叠视野进行观察,计算阳性反应区域面积的平均光密度值(OD)。
1.2.5 统计学方法 采用SPSS18.0分析处理数据。计量资料采用均数加减标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用t检验,P<0.05表示差异有统计学意义。
2 结果
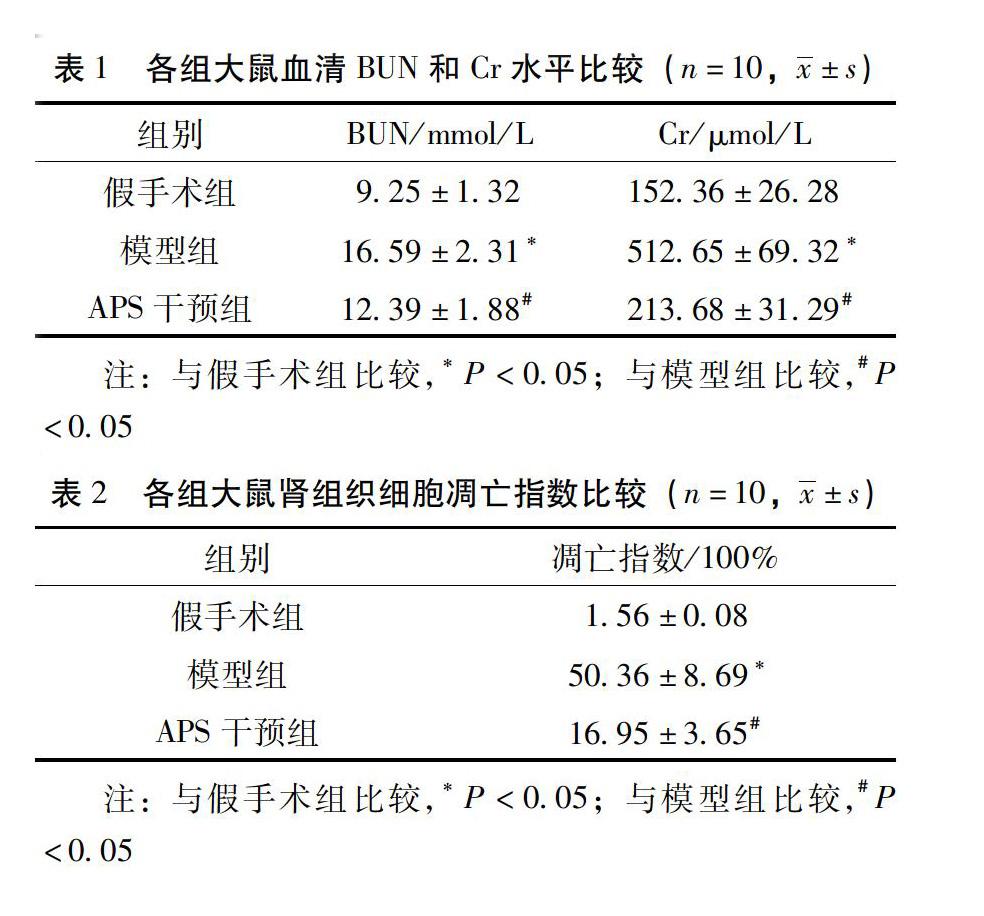
2.1 各组大鼠血清BUN、Cr水平比较 与假手术组比较,模型组大鼠血清BUN和Cr含量明显升高(P<0.01);与模型组比较,APS干预组大鼠血清BUN和Cr含量明显下降(P<0.01)。具体结果见表1。
2.2 各组大鼠细胞凋亡指数比较 与假手术组比较,模型组肾脏细胞凋亡指数明显升高(P<0.01);与模型组比较,APS干预组大鼠肾脏细胞凋亡指数明显降低(P<0.01)。具体结果见表2、图1。
2.3 各组大鼠肾组织Bax和Bcl-2蛋白表达 与假手术组比较,模型组肾脏Bax表达明显升高,Bcl-2表达明显下降(P<0.01);与模型组比较,APS干预组大鼠肾脏Bax表达明显降低,Bcl-2表达明显升高(P<0.01)。具体结果见表3、图2。
3 讨论
RIRI是因肾供血障碍后血流再灌注而导致的常见的应激性疾病,临床最常见于肾移植术后[8]。RIRI导致肾脏血管损伤,引发肾小管代谢紊乱甚至坏死,进而影响肾血流,最终导致肾细胞凋亡、坏死,直至肾功能衰竭。通过本实验研究发现与假手术组比较,模型組大鼠血清BUN和Cr含量明显升高(P<0.01);与模型组比较,APS干预组大鼠血清BUN和Cr含量明显下降(P<0.01)。提示RIRI大鼠肾功能下降,通过APS干预作用后肾功能得到改善,说明APS对RIRI大鼠肾脏具有保护作用。
细胞凋亡是指细胞在一定生理或病理条件下,通过启动内部自身机制,激活内源性核酸内切酶而引起自身细胞死亡的现象[9],其在RIRI病理生理中发挥重要作用[10]。细胞凋亡与多种基因表达有关,其中Bcl-2家族为现在研究较为深入的调控基因之一。迄今已发现Bcl-2家族包括20多种成员,按其功能可分为抑制凋亡的亚家族(包括Bcl-2、Bcl-xL、Bcl-w、mcl-1、A1/Bfl-1等)和促进凋亡的Bax亚家族(包括Bax、Bcl-XS、Bad、Bik、Bak、Bid、Hrk等),其中Bcl-2和Bax是最主要的成员。Bcl-2具有抗细胞凋亡作用,而Bax具有促进细胞凋亡的作用,在正常情况下Bcl-2与Bax调控作用保持动态平衡,当Bcl-2表达程度升高或者Bax的表达程度受到抑制时,就会抑制细胞凋亡[11],这种抑制的机理包括以下几种可能:①对促细胞凋亡基因信号传达产生阻隔作用,或使得相关基因失效[12];②Ca2+内流在细胞中发生变化,使凋亡受到抑制;③抑制氧自由基的产生,减少氧化应激等。而Bax表达的增强,使线粒体通透性增大,进而使细胞内引入大量的细胞色素C,促进细胞凋亡[12]。通过本研究显示,与假手术组比较,模型组大鼠肾脏细胞凋亡指数明显升高,且Bax表达明显升高、Bcl-2表达明显下降(P<0.01);与模型组比较,APS干预组大鼠肾脏细胞凋亡指数明显降低,且Bax表达明显降低、Bcl-2表达明显升高(P<0.01)。说明APS通过对凋亡基因进行调节的作用,抑制细胞凋亡,保护肾脏,避免产生肾损伤。
黄芪作为传统名贵中药,有补气升阳、固表止汗、行水消肿和托毒生肌的功效,有“补气诸药之最”之称。APS作为黄芪中最重要的一种药用物质,大量实验证明其具有抗细胞凋亡的作用。综上所述,APS预处理具有减轻肾脏细胞凋亡,改善RIRI肾功能的作用,其机制可能与Bax蛋白表达下调,以及Bcl-2蛋白表达上调有关。
参考文献
[1]Mitaka C, Si MK, Tulafu M, et al. Effects of atrial natriuretic peptide on inter-organ crosstalk among the kidney, lung, and heart in a rat model of renal ischemia-reperfusion injury[J]. Intensive Care Med Exp, 2014, 2(1): 28-29.
[2]胡红林,王共先. 肾缺血再灌注损伤中细胞凋亡和氧化应激[J]. 中国现代医学杂志,2010,20(15):2279-2283.
[3]庄欣. 细胞凋亡与中医正气学说辨析[J]. 中医药学刊,2004,22(1):97.
[4]王丽荣,马晓燕. 中医药治疗慢性肾衰研究进展[J]. 云南中医中药杂志,2017,38(10):81-83.
[5]汪卫红,许烨,李志明,等. 黄芪水提取物对慢性肾功能衰竭模型大鼠的改善作用及其对MAPK信号通路的影响[J]. 中国药房,2019,30(10):1386-1392.
[6]范宗静,谢连娣,崔杰,等. 黄芪多糖后处理通过抑制线粒体损伤介导的凋亡保护心肌缺血再灌注损伤[J]. 辽宁中医杂志,2018,45(7):1357-1360.
[7]苏韫,刘永琦,颜春鲁,等. 黄芪多糖对脑缺血再灌注大鼠脑组织Bcl-2、Bax蛋白及NO含量的影响[J]. 西部中医药,2016,29(3):10-13.
[8]BAO D S, WU Y K, FU S J, et al. Hyperbaric oxygenation protects againsts ischemia-resperfusion injury in transplanted rat kidneys by triggering autophagy and inhibiting inflammatory response[J]. Ann Transplant, 2017, 2(10): 75-82.
[9]范宗静,唐杰,谢连娣,等. 人心脏微血管内皮细胞缺血再灌注损伤Fas/FasL系统的表达及黄芪多糖的干预研究[J]. 中华中医药杂志,2016,31(11):4672-4674.
[10]许瑞瑞,宋年华,徐岩,等. 肾缺血再灌注损伤对细胞凋亡的影响[J]. 青岛大学医学院学报,2015,51(1):29-32.
[11]GUO J, WANG J L, SONG S, et al. Sphallerocarpus gracilis polysaccharide protects pancreatic β-cells via regulation of the bax/bcl-2, caspase-3, pdx-1 and insulin signalling pathways[J]. Int J Bio Macromol, 2016, 93(PtA): 829-836.
[12]ZHENG X R, WEI R B, SHI S Z, et al. Effect of Fufang Shenhua Tablet on the expression of Toll-like receptors during acute kidney injury induced by ischemia-reperfusion in rats[J]. Chin J Integr Med,2012,18(12):918-924.
[13]王红祥,徐彬,万海同.黄芪对脑缺血-再灌注损伤大鼠MMP-9 和 IL-1β 的影响[J]. 海峡药学,2013,25(4):17-19.
(收稿日期:2019-07-09 编辑:陶希睿)
