不同土壤pH下AM真菌对苜蓿苗期生长的影响
2019-12-12古丽君段廷玉
邓 杰,李 芳,古丽君,段廷玉
(兰州大学草地农业生态系统国家重点实验室 / 兰州大学农业农村部草牧业创新重点实验室 /兰州大学草地农业科技学院,甘肃 兰州 730020)
紫花苜蓿(Medicago sativa)是一种优良的多年生豆科牧草,具有蛋白质含量高、营养价值全面、利用年限长等特点[1],同时,紫花苜蓿根系发达,不仅能吸收土壤深层的水分和养分,还可以起到保持水土的功能[2-3]。紫花苜蓿适宜生长在pH 6.5 ~ 7.5的微酸性或微碱性土壤中,对酸性土壤较为敏感[4-5]。研究表明,当土壤中的酸度达到一定域值时,植物的超微结构会被破坏,从而降低叶绿素含量和光合效率,阻碍生长发育[6]。在土壤pH 低于 5.7之后,苜蓿生物量随着pH的下降而显著下降[7]。土壤酸度在很大程度上限制了苜蓿的栽培种植[8]。酸性土壤的类型多,主要分布在我国南方地区,且随着环境的恶化,酸性土壤面积不断增加。近年来,随着南方地区畜牧业的快速发展,尤其是奶牛业的快速发展,对优质苜蓿草的需求越来越大,但酸性土壤极大地制约了苜蓿在南方地区的生产利用[9]。
微生物是农业生态系统中的重要组成部分,具有不可替代的作用。丛枝菌根(arbuscular mycorrhizal,AM)真菌是广泛存在于森林、草地、农田等生态系统中的一类土壤微生物[10],它能与超过80%的植物根系形成菌根共生体[11]。截止2017年,我国发现并报道的AM真菌有147个种,约占全世界已报道的AM真菌种数的一半[12]。AM真菌能与植物根系之间形成菌根根圈效应,具有拓展根系吸收面积,增加宿主植物对矿质养分,尤其是P的吸收[13-14],促进光合作用[15-16],以及调节植物体内光合产物分配等功能,从而促进植物生长[11,17]。在逆境条件下,AM真菌能提高抗氧化保护酶的活性,降低丙二醛(MDA)含量,从而减缓脂质过氧化作用,提高植物对生物逆境[18]和非生物逆境[19-21]的抗性,从而提高植物的产量,促进生态系统持续、稳定发展。
目前,AM真菌与紫花苜蓿互惠共生的研究已有报道。蒙程等[22]的研究表明,不同pH下接种AM真菌能提高苜蓿植物的分枝数、株高以及根长等生长指标,而不同pH下接种AM真菌对紫花苜蓿叶绿素含量、净光合速率、养分吸收以及MDA和超氧化物歧化酶 (SOD) 酶活性变化等生理生化方面的研究鲜有报道。为此,拟通过模拟南方酸性土壤,在盆栽条件下以苗期紫花苜蓿为研究对象,探究幼套球囊霉和根内球囊霉以及这两种菌的混合菌剂对不同pH下紫花苜蓿幼苗生长的影响,为利用AM真菌增强紫花苜蓿对酸胁迫的抗性、提高紫花苜蓿产量提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 供试植物
本研究供试植物为陇东苜蓿(M. sativa var.Longdong),挑选籽粒饱满并且大小一致的苜蓿种子,种子表面用75%的酒精消毒3 min,然后用3%的NaClO溶液对种子消毒10 min,最后用无菌水冲洗3次。将处理好的种子摆放在有湿润滤纸的培养皿中,置于25 ℃恒温培养箱中催芽。
1.1.2 供试菌种
供试菌种幼套球囊霉(Claroideoglomus etunicatum)和根内球囊霉(Rhizophagus intraradices)购于北京市农林科学院植物营养与资源研究所中国丛枝菌根真菌种质资源库(BGC),经三叶草(Trifolium pratense)大量扩繁、备用。试验开始之前,将等量的幼套球囊霉和根内球囊霉混匀,制成混合菌剂。
1.1.3 供试土壤
草炭土购自兰州花市,经2 mm网过筛后,按1∶1比例掺入河沙充分混匀,于高压灭菌锅中灭菌2次,温度设为121 ℃,每次灭菌1 h,间隔24 h,混合基质pH为6.48。将灭好的土壤分装到每个花盆中,每盆装1 500 g,通过在土壤中添加或不添加硫酸的方法将土壤pH调节至6.48、5.0和3.0,配制时,把98%浓硫酸先配制成5 mmol·L-1(pH 2)溶液,然后将硫酸溶液逐量添加到含有1 500 g混合基质的花盆中,充分混匀,分别记下pH为5.0和3.0时添加硫酸溶液的体积,其余花盆中的pH分别按对应体积的硫酸溶液进行配制。
1.1.4 试验设计
试验在兰州大学的榆中智能温室中进行,设置4个菌根处理,分别为1)单接种幼套球囊霉(AM1);2)单接种根内球囊霉(AM2);3)接种幼套球囊霉+根内球囊霉混合菌剂(Mix);4)接种灭活的AM真菌菌剂作为对照(NM),AM真菌单独接种处理每盆接30 g AM菌剂,混合接种处理中幼套球囊霉和根内球囊霉分别接种15 g,NM处理每盆接种30 g灭活菌剂(接种的菌剂因量少对pH的影响可以忽略不计);3个pH处理,分别为pH 6.48、5.0和3.0; 3个pH处理和4个菌根处理交互设置后,共12个处理,每处理4个重复。每个重复移栽6株已催芽的苜蓿幼苗,生长一周后,选择生长较为一致的保留5株,进行后期试验。
植物生长期间浇改进的Hoagland营养液[23],配比为2 mmol·L-1KNO3, 0.5 mmol·L-1NaCl,1.2 mmol·L-1Ca (NO3)2·4H2O,1 mmol·L-1NH4H2PO4,1 mmol·L-1MgSO4·7H2O,0.1 mmol·L-1FeEDTA,0.1 mmol·L-1ZnSO4·7H2O,0.1 mmol·L-1CuSO4·5H2O,0.1 mmol·L-1MnSO4·H2O,0.1 mmol·L-1H2MoO4,0.1 mmol·L-1H3BO3。营养液配好后测定其pH为5.5。用H2SO4和NaOH将营养液的pH分别调至6.48、5.0和3.0,分别用来浇灌相应的土壤pH处理组,每天浇2次,每次20 mL。苜蓿生长6周后收获,在收获前测定株高、叶片数以及光合速率等指标。收获时对不同处理组植株采集相同部位的新鲜叶片低温保存,之后用于测定叶绿素含量、超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde,MDA)含量等指标。植株收获后,根部用清水冲洗干净,并取相同部位的根断用来测定菌根侵染率,将剩余的地上部分和地下部分用来测定磷(P)含量和生物量。
1.2 试验方法
1.2.1 菌根侵染率测定
称 取 0.2 g 左 右 同 部 位 的 根 部 组 织,浸 泡 在10% 左右的 KOH 溶液中,置于于60 ℃ 水浴锅中加热1 h,清去KOH 溶液,用流水冲洗两次,然后将根系置于1 mol·L-1HCl溶液中酸化30 s,用蒸馏水冲洗3次,最后在解剖镜下检查,若植物根部皮层中的颜色已褪去,则用0.05% Trypan Blue (乳酸∶甘油∶水 = 1∶1∶1)保存根样[24],用十字交叉法[25]测定菌根侵染率。侵染率 = 侵染根长度 / 观察根长度 × 100%。
1.2.2 形态学指标测定
株高:植株的最高点到露出培养土表面的部位长度。
叶片数:以盆为单位,每盆所有的叶片总数。
生物量:植株地上部分和根部均先称取鲜重(W1),然后用烘干法测定干重。在105 ℃杀青20 min,然后于80 ℃烘箱烘至恒重,并称重(W2)。地上部分和地下部分的生物量可根据用来测定叶绿素含量、MDA、SOD活性以及菌根侵染率等相关指标的鲜重(W3)与干重比,计算公式如下。
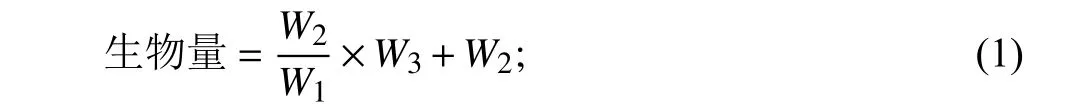
生物量 = 地上部分干重 + 地下部分干重。
1.2.3 净光合速率的测定
收获前选择天气晴朗的上午09:00-11:00,采用Li-6400便携式光合仪随机选取盆栽植株叶片测定净光合速率[Pn,μmol·(m2·s)-1],每盆测定5次,计算平均值,作为一个重复,每个处理4个重复。
1.2.4 总磷含量测定
烘干的植物地上部分和根部样品研磨后,称取0.2 g样品于100 mL消化管中,每管加 3 g K2SO4和0.3 g CuSO4催化剂,并加10 mL H2SO4,于420 ℃消煮2 h。消化好的溶液定容至100 mL。采用钼锑抗吸光光度法,用分光光度计(Pectrum,Shanghai 721,中国),在390 nm处测定溶液吸光度值[26]。
1.2.5 生理生化指标的测定
叶绿素含量、SOD活性和MDA浓度分别参照王学奎[27]的丙酮浸提法、氮蓝四唑(NBT)光化还原法和硫代巴比妥酸法。
1.3 数据处理
试验记录数据采用SPSS19.0统计软件进行双因素方差分析。用Tukey's HSD法(Tukey's honestly significant difference)检测各处理间的显著性差异。
2 结果与分析
2.1 侵染率
接种AM真菌的处理组根部均不同程度地受到AM真菌的侵染,对照组NM的根系中未检测到菌根结构。相同AM真菌处理条件下,随着pH的下降,苜蓿根系菌根侵染率逐渐降低,pH为3.0的处理与pH为6.48的处理相比,2种AM真菌单独及混合接菌后其侵染率分别降低36.23%、23.53%和37.02%。相同pH处理条件下,苜蓿根系菌根侵染率均以混合菌剂最高(表1)。

表 1 不同pH条件下苜蓿AM真菌侵染率Table 1 Alfalfa arbuscular mycorrhizal fungi (AMF) colonization rates at different pH treatments
2.2 生长指标
随着pH的降低,苜蓿叶片数、株高和生物量逐渐降低。与pH为6.48的处理组相比,pH为5.0时,NM处理组生物量显著降低16.08% (P <0.05),幼套球囊霉处理组叶片、株高和生物量分别显著降低12.81%、6.65%和10.23%,根内球囊霉处理组株高和生物量分别显著降低8.87%和13.69%,混合菌剂处理组叶片数和生物量分别显著降低6.13%和8.36%;pH为3时,NM处理组叶片数、株高和生物量分别显著降低22.09%、17.60%和17.25%,幼套球囊霉处理组叶片数和生物量分别显著降低20.20%和25.13%,根内球囊霉处理组叶片数、株高和生物量分别显著降低19.43%、13.12%和25.82%,混合菌剂处理组叶片数、株高和生物量分别显著降低11.96%、7.86%和17.48%(图1)。
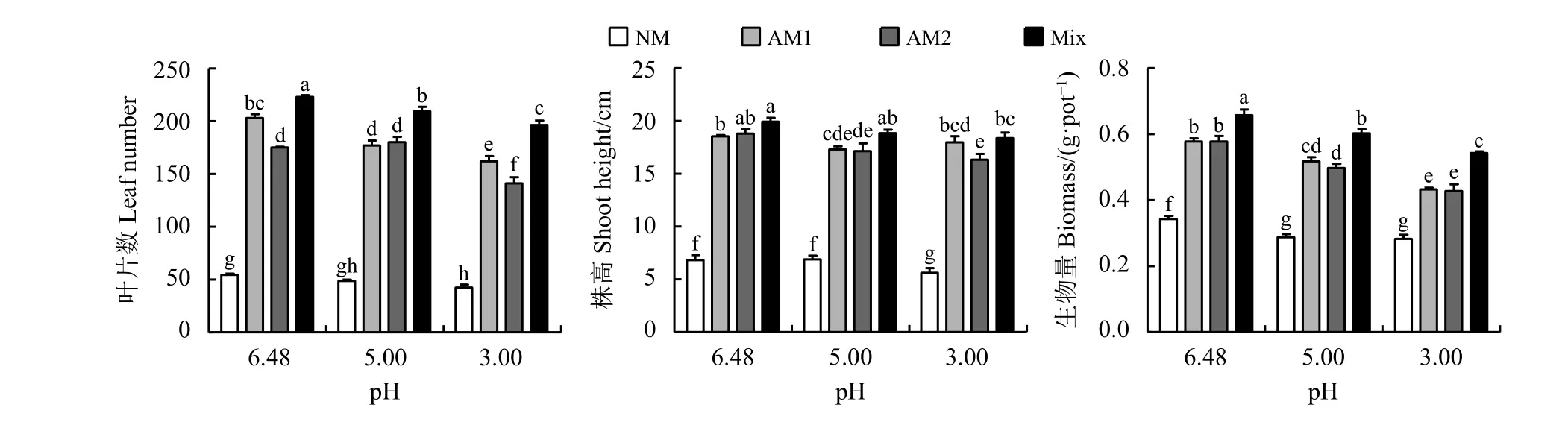
图 1 苜蓿叶片数、株高和生物量试验结果Figure 1 Results of the leaf number, shoot height, and biomass of alfalfa
与NM处理相比,接种幼套球囊霉、根内球囊霉和混合菌剂显著提高苜蓿叶片数、株高和生物量,pH为6.48时,叶片数分别显著提高273.62%、222.09%和310.43%,株高分别显著提高171.75%、175.66%和192.27%,生物量分别显著提高68.71%、68.71%和 92.40%;pH为5时,叶片数分别显著提高263.69%、269.86%和330.13%,株高分别显著提高150.98%、148.56%和173.22%,生物量分别显著提高80.49%、73.52%和110.11%;pH=3时,叶片数分别显著提高282.68%、233.07%和363.78%,株高分别显著提高219.70%、190.62%和226.82%,生物量分别显著提高52.65%、51.24%和91.87%(图1)。
2.3 叶绿素含量和净光合速率
酸处理降低了苜蓿净光合速率和叶绿素含量。与pH为6.48的处理相比,pH为5时,NM处理组、幼套球囊霉处理组和混合菌剂处理组叶绿素含量分别显著降低10.57%、8.43%和9.59% (P <0.05),根内球囊霉处理组叶绿素含量和净光合速率分别显著降低18.07%和7.24%;pH为3时,NM处理组叶绿素含量和净光合速率分别显著降低18.74%和34.69%,幼套球囊霉处理组叶绿素含量和净光合速率分别显著降低21.42%和17.01%,根内球囊霉处理组叶绿素含量和净光合速率分别显著降低39.02%和9.94%,混合菌剂处理组叶绿素含量和净光合速率分别显著降低16.90%和7.53%(图2)。
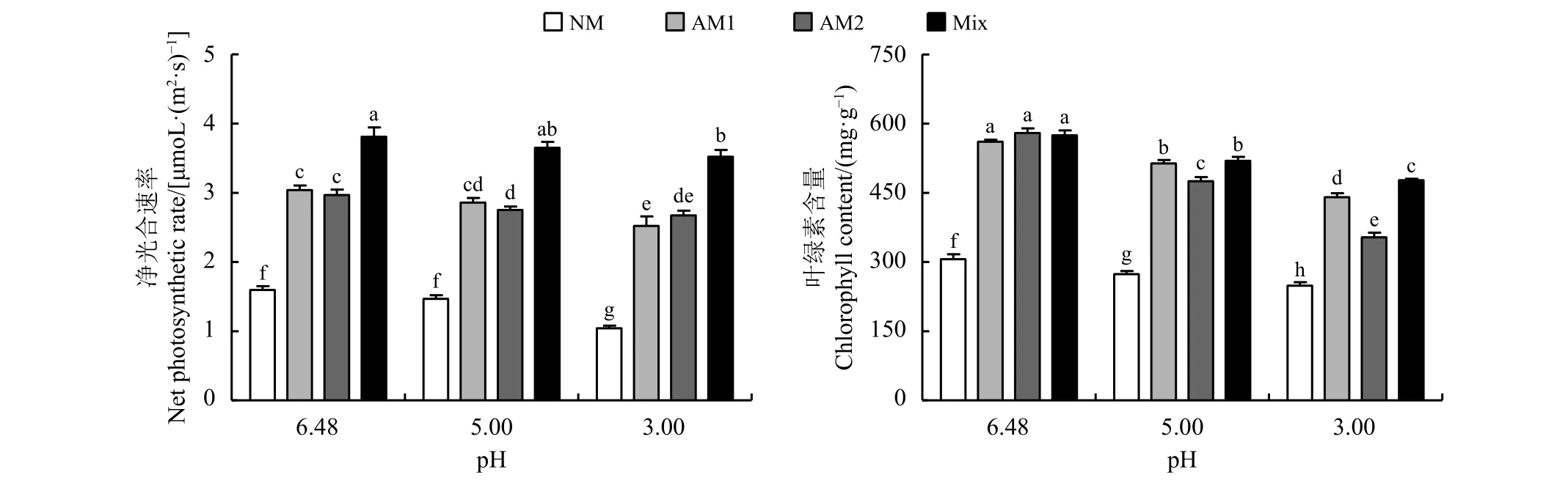
图 2 苜蓿净光合速率和叶绿素含量Figure 2 Net photosynthetic rates and chlorophyll content of alfalfa
与NM处理相比,接种幼套球囊霉、根内球囊霉和混合菌剂显著提高苜蓿叶绿素含量和净光合速率,pH为6.48时,叶绿素含量分别显著提高83.24%、89.44%和87.70%,净光合速率分别显著提高90.36%、85.85%和138.57%;pH为5时,叶绿素含量分别显著提高87.62%、73.54%和89.75%,净光合速率分别显著提高94.82%、87.53%和148.64%;pH为3时,叶绿素含量分别显著提高77.21%、42.17%和91.95%,净光合速率分别显著提高141.90%、156.28%和237.78%。
2.4 总P含量
苜蓿总 P 含量的变化趋势与生物量基本一致。与pH为6.48的处理相比,pH为5时,幼套球囊霉处理组总 P 含量显著增加9.45% (P < 0.05),根内球囊霉处理组和混合菌剂处理组总 P 含量分别显著降低28.63%和19.65%;pH为3时,NM处理组、根内球囊霉处理组和混合菌剂处理组总 P 含量分别显著降低54.18%、49.53%和41.07% (图3)。
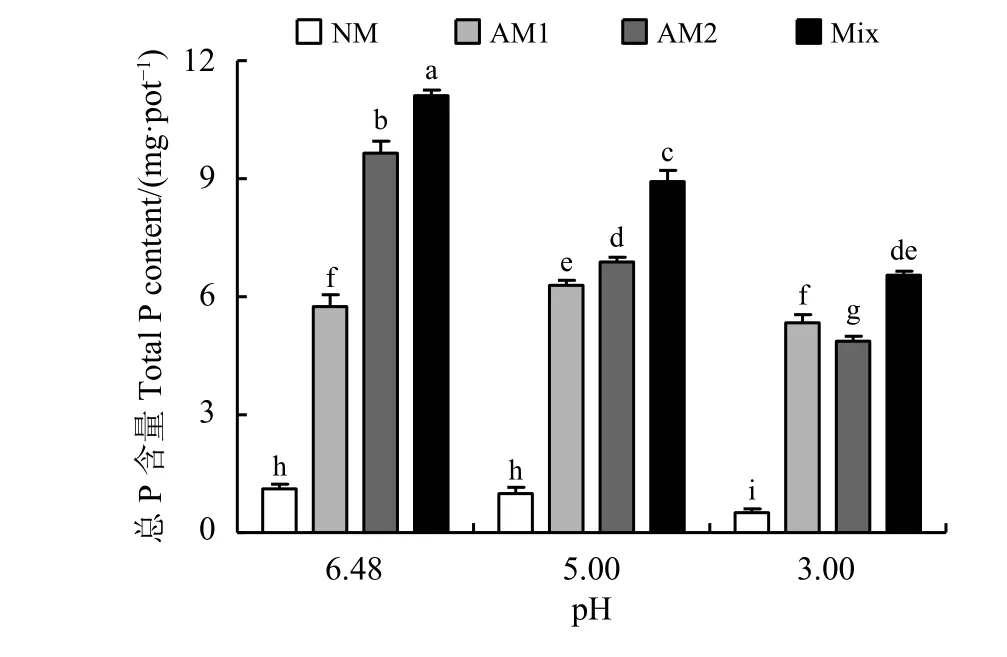
图 3 苜蓿总P含量Figure 3 Results of the total phosphorus content of alfalfa
与NM处理相比,接种幼套球囊霉、根内球囊霉和混合菌剂显著提高苜蓿总 P 含量,pH为6.48时,总 P 含量分别显著提高416.35%、767.03%和898.20%;pH为5时,总P含量分别显著提高530.89%、590.77%和795.38%;pH为3时,总 P含量分别显著提高946.47%、854.90%和118.37%。
2.5 MDA浓度和SOD酶活性
酸处理增加了苜蓿SOD 酶活性和MDA浓度。与pH为6.48的处理相比,pH为5时,幼套球囊霉处理组、根内球囊霉处理组和混合菌剂处理组的SOD酶活性分别显著增加45.56%、16.67%和25.08% (P < 0.05),NM处理组和根内球囊霉处理组的MDA浓度分别显著35.64%和34.89%;pH为3时,NM处理组、幼套球囊霉处理组、根内球囊霉处理组和混合菌剂处理组的SOD酶活性分别显著增加27.29%、60.20%、23.33%和57.38%,NM处理组合根内球囊霉处理组的MDA浓度分别显著52.97%和46.71% (图4)。
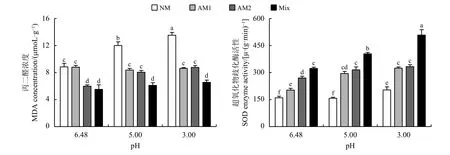
图 4 苜蓿MDA浓度和SOD酶活性Figure 4 Results of the MDA concentration and SOD enzyme activity of alfalfa
与NM处理相比,接种幼套球囊霉、根内球囊霉和混合菌剂显著提高苜蓿SOD酶活性,降低了MDA浓度。pH为6.48时,SOD酶活性分别显著提高26.67%、68.75%和101.88%,根内球囊霉处理组和混合菌剂处理组的MDA浓度分别显著降低32.49%和37.72%;pH为5时,SOD酶活性分别显著提高87.50%、100.21%和156.78%,MDA浓度分别显著降低30.25%、32.86%和49.14%;pH为3时,SOD酶活性分别显著提高59.41%、63.50%和149.59%,MDA浓度分别显著降低36.28%、35.25%和51.55%。
2.6 相关性分析结果
相关性分析结果(表2)显示,苜蓿的根系菌根侵染率与叶片数、株高、叶绿素含量、净光合速率、P吸收和生物量呈极显著正相关关系(P <0.01),与MDA浓度呈现极显著负相关关系(P <0.01)。苜蓿生物量的积累与菌根侵染率、叶片数、株高、叶绿素含量、净光合速率以及P吸收和SOD酶活性呈显著极正相关关系(P < 0.01),与MDA浓度呈现极显著负相关关系(P < 0.01)。
3 讨论与结论
本研究通过温室和室内研究发现,酸胁迫下,苜蓿幼苗的生长会受到抑制,并且pH越低,受到的伤害越大。随着pH的降低,苜蓿幼苗的株高、叶片数和地上、地下生物量等显著降低,说明酸性土壤会抑制植物生长,降低植物产量[28-29],这可能有以下几方面的原因:1)酸处理减少植物体内参与叶绿素合成的矿质元素[28],从而降低叶绿素含量,影响光合作用的进行;2)酸性土壤抑制植物对P等养分的吸收[30],从而抑制P参与的重要生理生化过程,如光合作用、能量储存和运输等[21];3)酸胁迫下,膜脂质过氧化作用加剧,损害植物体内生物膜及其功能,减缓或抑制植物体内一系列的生理生化反应,最终导致植物长势变弱,产量降低。
酸性土壤是植物生长重要的限制因素之一,丛枝菌根真菌存在于不同的土壤类型中,植物根部感染丛枝菌根真菌可以提高植物在酸性土壤中生长的能力,改善幼苗的生存环境[31]。蒙程等[22]的研究表明,AM真菌可以缓解酸胁迫,并促进苜蓿生物量7.27 ~ 22.20倍。本研究也发现,AM真菌能显著促进紫花苜蓿叶片数、株高等产量构成因子。这可能是因为AM真菌的存在促进植物对P的吸收和光合作用的进行,从而促进植物的生长和生物量的积累。
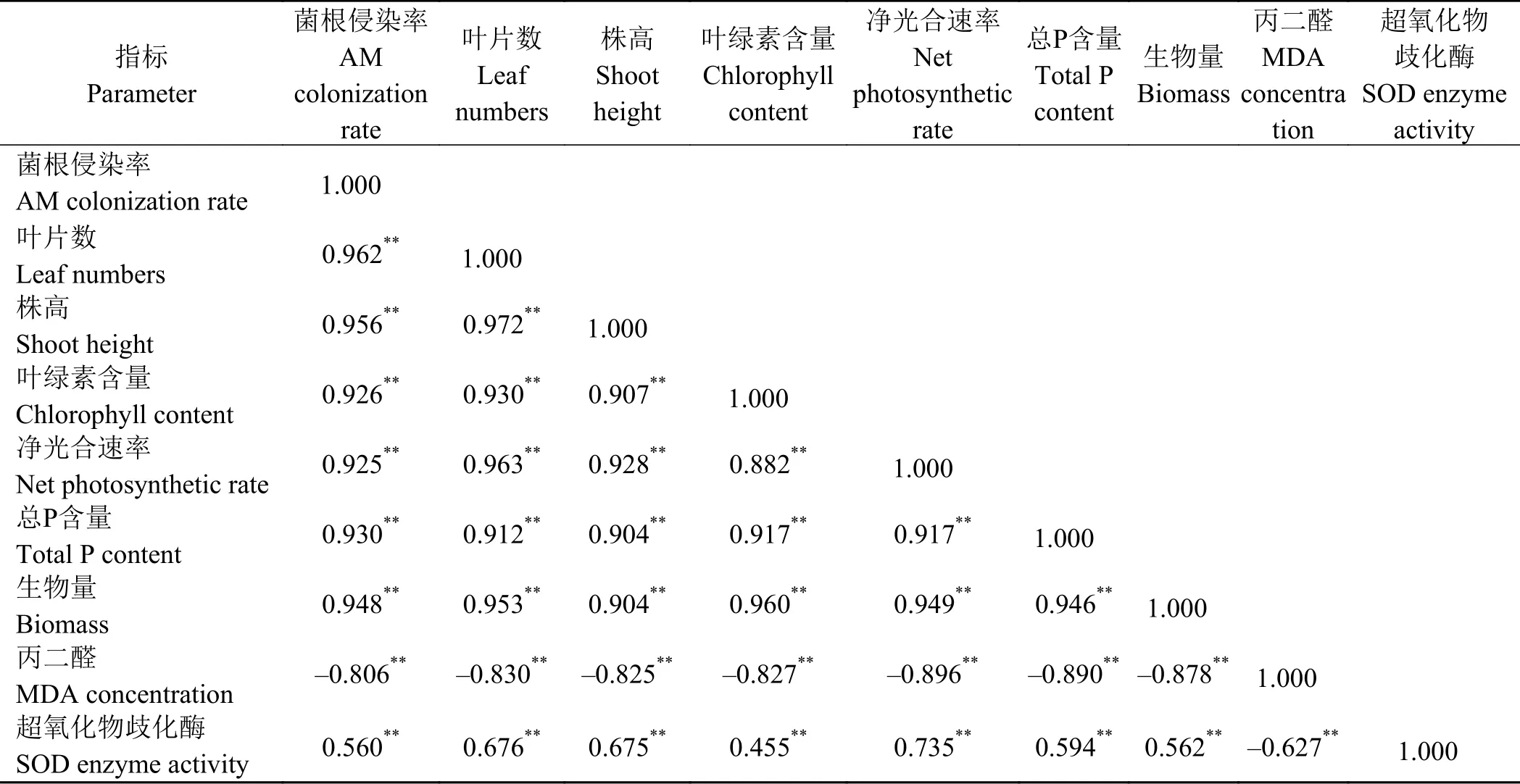
表 2 苜蓿生长、P吸收、生理生化指标之间的相关性分析系数Table 2 Pearson correlation coefficients among the growth, P uptake, and physiological and biochemical indices of alfalfa
此外,AM真菌可在逆境条件下提高抗氧化保护酶活性,降低植物体内活性氧的积累和膜质过氧化产物的积累[32-33]。本研究结果表明,AM真菌能提高SOD酶活性,降低MDA含量,这可能是因为AM真菌的存在能诱导植物的氧化应激反应,从而缓解膜质过氧化反应,维持植物体内正常的生理生化反应和免疫反应。
AM真菌虽可减轻酸性土壤对植物的胁迫,但其本身亦会收到酸性土壤的影响,本研究发现,AM真菌的侵染率会随着pH的降低而降低。说明AM真菌在酸性土壤中的侵染小于中性和碱性土壤。这可能是因为随着pH的降低,植物的超微结构被破坏,从而降低叶绿素含量和光合效率,减少光合产物的积累及其向根部AM真菌的分配,因而降低AM真菌在根部定植所需要的养分,最终导致AM真菌的侵染降低(菌根侵染率与叶绿素含量和净光合速率呈极显著正相关关系(表2)[34]。但也有研究表明,土壤pH (4.2和5.2)未显著影响红薯根系珠状巨孢囊霉(Gigaspora margarita)的菌根侵染率[35]。这可能与植物类型、土壤pH、AM真菌类型等有关。
Li等[33]研究幼套球囊霉和根内球囊霉单独和混合接种对黑麦草叶斑病的影响时发现,这两种AM真菌混合接种效应低于幼套球囊霉单独接种的效应,而本研究结果发现,混合菌剂提高叶片数,生物量、净光合速率、总P含量、SOD酶活性的效果大于幼套球囊霉和根内球囊霉单独存在的处理,这种不同的结果可能与植物类型和环境土壤有关。说明幼套球囊霉和根内球囊霉均能提高苜蓿幼苗的生长和对酸胁迫的耐受性,而这两种菌剂混合侵染苜蓿植物时,二者间存在协同效应,所以二者的效应可以叠加,因而混合接种的效果最好。
在我国,紫花苜蓿主要分布在北方的中性和微酸性土壤中,而在南方地区的种植面积还较小[2]。近年来,随着南方地区奶牛业的快速发展,对优质苜蓿草的需求越来月迫切,而从别处运输会增加成本,且运输途中因天气等原因会造成饲草发霉、变质,进而影响牧草品质,造成损失。因此,提高苜蓿在南方酸性土壤中的产量是解决这一问题的关键。根据本研究结果,AM真菌能显著促进植物光合速率、P吸收,增加叶绿素含量和生物量,降低逆境胁迫下苜蓿植株的MDA浓度。说明AM真菌能促进植物生长,提高植物抗逆性。在南方酸性土壤苜蓿生产系统中具有广泛的应用前景。
