小分子RNA干扰HIF-1α对糖尿病视网膜病变小鼠视网膜的保护作用及机制
2019-12-09张瑞萍刘红凌
张瑞萍,刘红凌
0引言
糖尿病视网膜病变(diabetic retinopathy,DR)作为糖尿病患者常见的微血管并发症,是导致后天失明的主要因素,严重威胁患者生存质量[1]。研究表明[2],视网膜血管新生是DR发病的重要机制。而高糖血症引起的慢性缺氧是导致DR的始发原因[3]。缺氧诱导因子1(hypoxia-inducible factor 1,HIF-1)是缺氧环境下调控机体机能的重要调节因子,包括α和β两个亚基,其中,HIF-1α是主要的功能亚基,在缺氧环境中可稳定表达,与靶基因结合而产生一系列缺氧适应[4],动物实验表明[5],HIF-1α在糖尿病大鼠视网膜组织中呈高表达,且与糖尿病病程有关。但HIF-1α是否参与了DR发病,以及在DR发病过程的作用鲜有报道。本研究拟采用小分子RNA干扰技术特异性沉默HIF-1α基因,观察其对DR小鼠视网膜血管新生及神经节细胞凋亡的影响,并探讨可能的机制,以期为DR临床防治提供基础资料。
1材料和方法
1.1材料链脲佐菌素购自上海然泰生物科技有限公司,焦碳酸二乙酯(DEPC)购自上海前尘生物科技有限公司,葡萄糖含量检测试剂盒购自上海索莱宝生物科技有限公司,Trizol总RNA提取试剂盒、LipofectamineTMRNAiMAX转染试剂盒均购自美国Invitrogen公司,逆转录试剂盒和PCR试剂盒均购自日本TaKaRa公司,HIF-1α、血管内皮生长因子(VEGF)、核因子-κB(NF-κB)、白细胞介素-1(IL-1)、IL-6、肿瘤坏死因子-α(TNF-α)及内参引物均由上海生工生物公司设计合成,siRNA-HIF-1α、siRNA-NC均由上海吉玛制药技术有限公司设计合成,苏木素-伊红(HE)染色试剂盒购自上海研晶生物公司,山羊抗小鼠CD34单克隆抗体购自美国R&D公司,免疫组化试剂盒购自北京中杉生物公司,兔抗鼠HIF-1α多克隆抗体购自美国Bioworld公司,兔抗小鼠内皮素-1(ET-1)多克隆抗体购自上海沪峰化工公司,兔抗小鼠血管性血友病因子(vWF)单克隆抗体购自美国Sigma公司,实时荧光定量PCR仪购自美国ABI公司,凝胶电泳分析系统购自美国Bio-Rad公司。
1.2方法
1.2.1实验动物及分组处理SPF级C57BL/6雄性小鼠40只购自河南省实验动物中心[SCXK(豫)2010-1-0003],12周龄,体质量28±2g,利用随机数字表分为正常组、糖尿病组、siRNA-HIF-1α组、siRNA-NC组,每组10只。糖尿病模型构建:小鼠禁食10h,将链脲佐菌素按小鼠体质量60mg/kg剂量进行腹腔注射,连续注射5d,第7d时取尾静脉血检测血糖,以血糖>11.1mmol/L作为成功建模标准,对于建模不成功的,补充小鼠,保证每组10只。正常组给予等量的柠檬酸缓冲液,连续注射5d。
1.2.2靶向HIF-1α的siRNA设计和合成利用GenBank基因库得到HIF-1α基因序列(AF207206),选取最有效的HIF-1α-siRNA基因序列:5’-GAAACTCTTCCAAGCAATTTT-3’,以及非靶向性siRNA作为对照序列:5’-TTCTCCGAACGTGTCACGTTTC-3’。将siRNA溶解于经DEPC处理的生理盐水中,调整浓度为15μmol/L。
1.2.3各组小鼠转染处理建模4wk后,将4组小鼠腹腔注射麻醉后,用碘伏于眼周消毒,在显微镜观察下,于各只大鼠双眼,利用Hamilton微量注射器在角膜缘外1mm处进针,沿视神经方向直至瞳孔区,siRNA-HIF-1α组:将含HIF-1α-siRNA基因序列和转染试剂的混合液注入玻璃体腔;siRNA-NC组:将含siRNA对照序列和转染试剂的混合液注入玻璃体腔;正常组:将等量磷酸盐缓冲液(PBS)注入玻璃体腔;糖尿病组:将等量PBS注入玻璃体腔。每14d重复注射1次,连续注射4次。
表1 基因序列

基因序列HIF-1α上游:5-GGCGCGAACGACAAGAAAAAG-3下游:5-CCTTATCAAGATGCGAACTCACA-3VEGF上游:5-AGGCGAGGCAGCTTGAGTTA-3下游:5-CTGTCGACGGTGACGATGGT-3NF-κB上游:5-GCTCCTAAGGTGCTGACA-3下游:5-ACCTCCGAAAGCGAGATA-3IL-1上游:5-ACCTGGGCTGTCCTGATGAGAG-3下游:5-TGTTGATGTGCTGCTGCGAGAT-3IL-6上游:5-GTTCTCTGGGAAATCGTGGA-3下游:5-GGAAATTGGGGTAGGAAGGA-3TNF-α上游:5-TGGAACTGGCAGAAGAGGCACT-3下游:5-AGAGGCTGAGACATAGGCACCG-3β-actin上游:5-CCTAGGCACCAGGGTGTGAT-3下游:5-TTGGTGACAATGCCGTGTTC-3
1.2.4视网膜组织病理学观察各组小鼠于建模12wk后,处死摘取左眼球(每组10只左眼),将角膜缘环形剪开,甲醛固定24h,常规梯度乙醇脱水,石蜡包埋,连续切片,厚度约4μm,行HE染色,用光学显微镜观察各组视网膜组织病理学变化。
1.2.5免疫组织化学检测切片常规脱蜡后,用柠檬酸进行高温下组织抗原修复,加入H2O2,以灭活内源性过氧化物酶,将正常山羊血清加入,37℃孵育60min,加入山羊抗小鼠CD34单克隆抗体,37℃孵育60min,PBS冲洗3次,DAB显色,蒸馏水冲洗、复染、脱水、透明、封片,用PBS替代一抗作为阴性对照。微血管密度(MVD)计数参考文献[6]:于低倍镜下寻找新生血管密集区,换用高倍镜分别选取5个视野计数微血管数,取均值作为MVD,标准为任何被染成棕褐色的单个内皮细胞或细胞簇记为1个MVD,对于组织结构不相连的分支结构亦作为1个MVD,但排除肌层较厚或管腔直径超过8个红细胞的血管。每张切片均由两位病理科副主任医师单独阅片,MVD计数差值超过10%则重新阅片。
1.2.6利用实时荧光定量PCR检测各组小鼠视网膜组织中HIF-1α、VEGF、NF-κB、IL-1、IL-6、TNF-α mRNA表达取各组小鼠右眼视网膜组织(每组10只右眼),剪碎后,加入细胞裂解液,用Trizol总RNA提取试剂盒对总RNA进行提取,利用紫外分光光度计对总RNA纯度进行检查,以A260/A280≥1.80作为合格样品。将总RNA逆转录为cDNA,以cDNA为模板进行PCR。各引物序列见表1。PCR反应条件:95℃ 1min,92℃ 30s,92℃ 30s,58℃ 30s,73℃ 30s,连续进行38次循环,每个样品均设置3个平行反应复孔。用2-△△Ct法对各组小鼠视网膜组织中HIF-1α、VEGF、NF-κB、IL-1、IL-6、TNF-α mRNA相对表达量进行分析。
1.2.7 Western blot法检测各组小鼠视网膜组织中HIF-1α、ET-1、vWF蛋白表达取各组小鼠右眼视网膜组织(每组10只右眼),剪碎后,加入细胞裂解液,用总蛋白提取试剂盒获得总蛋白,用BCA蛋白浓度检测试剂盒对总蛋白浓度进行检测。取25μg总蛋白,行SDS-PAGE电泳,电转移至PVDF膜,10%脱脂奶粉封闭2h,分别将一兔抗鼠HIF-1α多克隆抗体、兔抗小鼠ET-1多克隆抗体、兔抗小鼠vWF单克隆抗体加入(稀释比1∶1200、1∶800、1∶1000),4℃过夜孵育,TBST漂洗3次,将二抗加入,室温下孵育2h,TBST漂洗3次,用ECL化学发光试剂盒避光反应25min。拍照,用Image-Pro Plus图像分析软件进行分析,计算视网膜组织中HIF-1α、ET-1、vWF蛋白相对表达量。

图1各组小鼠视网膜组织病理学表现(HE×200)A:正常组;B:糖尿病组;C:siRNA-NC组;D:siRNA-HIF-1α组。

图2各组小鼠视网膜组织免疫组织化学检测(免疫组化染色×400)A:正常组;B糖尿病组;C:siRNA-NC组;D:siRNA-HIF-1α组。黑色箭头示CD34表达阳性。
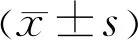
2结果
2.1各组小鼠一般情况糖尿病组、siRNA-HIF-1α组和siRNA-NC组小鼠经腹腔注射链脲佐菌素,7d时检测血糖,血糖值均>11.1mmol/L,成功率100%。建模12wk后,处死前再次检测体质量和血糖,糖尿病组、siRNA-NC组和siRNA-HIF-1α组大鼠的体质量均低于正常组,而血糖水平均高于正常组,差异均有统计学意义(P<0.05),见表2。
2.2各组小鼠视网膜组织病理学表现HE染色结果显示,正常组小鼠视网膜中各层细胞结构清楚、排列规整、形态正常(图1A),糖尿病组和siRNA-NC组小鼠视网膜中各层细胞排列杂乱,细胞核出现肿胀、视网膜组织水肿(图1B、C);siRNA-HIF-1α组小鼠视网膜中各层细胞排列趋于规则,细胞核肿胀减轻(图1D)。
2.3各组小鼠视网膜组织免疫组织化学检测免疫组织化学检测结果显示,正常组小鼠视网膜血管内皮细胞CD34呈弱阳性表达(图2A);糖尿病组和siRNA-NC组小鼠视网膜血管内皮细胞CD34表达阳性细胞数增多(图2B、C);siRNA-HIF-1α组小鼠视网膜血管内皮细胞CD34表达细胞数较糖尿病组和siRNA-NC组减少(图2D)。
正常组、糖尿病组、siRNA-NC组和siRNA-HIF-1α组小鼠视网膜组织中MVD分别为6.8±1.3、19.7±2.2、20.4±2.6和12.8±1.9个,差异有统计学意义(F=56.952,P<0.01),两两比较,糖尿病组和siRNA-NC组均高于正常组,而siRNA-HIF-1α组均低于糖尿病组和siRNA-NC组,差异均有统计学意义(P<0.05)。

图3各组小鼠视网膜组织中HIF-1α、VEGF、NF-κB、IL-1、IL-6、TNF-α表达aP<0.05vs正常组;cP<0.05vs糖尿病组;eP<0.05vssiRNA-NC组。
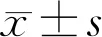

组别n体质量(g)血糖(mmol/L)正常组1030.91±2.544.55±0.32糖尿病组1023.24±3.02a24.67±2.34asiRNA-NC组1023.51±3.42a24.31±2.17asiRNA-HIF-1α组1023.12±2.83a25.14±2.63a F17.146197.464P<0.01<0.01
注:aP<0.05vs正常组。
2.4各组小鼠视网膜组织中HIF-1α、VEGF、NF-κB、IL-1、IL-6、TNF-α表达比较与正常组相比,糖尿病组、siRNA-NC组和siRNA-HIF-1α组小鼠视网膜组织中HIF-1α、VEGF、NF-κB、IL-1、IL-6、TNF-α mRNA相对表达量均升高,差异均有统计学意义(P<0.05),与糖尿病组和siRNA-NC组相比,siRNA-HIF-1α组小鼠视网膜组织中HIF-1α、VEGF、NF-κB、IL-1、IL-6、TNF-α mRNA相对表达量均降低,差异均有统计学意义(P<0.05),见表3、图3。
2.5各组小鼠视网膜组织中HIF-1α、ET-1、vWF蛋白表达比较与正常组相比,糖尿病组、siRNA-NC组和siRNA-HIF-1α组小鼠视网膜组织中HIF-1α、ET-1、vWF蛋白相对表达量均升高,差异均有统计学意义(P<0.05),与糖尿病组和siRNA-NC组相比,siRNA-HIF-1α组小鼠视网膜组织中HIF-1α、ET-1、vWF蛋白相对表达量均降低,差异均有统计学意义(P<0.05),见表4,图4。
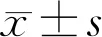

组别nHIF-1αVEGFNF-κBIL-1IL-6TNF-α正常组101.08±0.091.16±0.131.12±0.081.05±0.101.08±0.071.16±0.09糖尿病组101.86±0.11a2.27±0.16a1.95±0.13a1.78±0.11a1.73±0.14a1.89±0.13asiRNA-NC组101.89±0.15a2.24±0.14a1.97±0.14a1.76±0.08a1.71±0.11a1.91±0.15asiRNA-HIF-1α组101.25±0.12a,c,e1.71±0.11a,c,e1.68±0.12a,c,e1.53±0.13a,c,e1.47±0.10a,c,e1.55±0.12a,c,e F127.624114.32949.037112.17393.47079.985P<0.001<0.001<0.001<0.001<0.001<0.001
注:aP<0.05vs正常组;cP<0.05vs糖尿病组;eP<0.05vssiRNA-NC组。
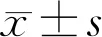

组别nHIF-1α蛋白ET-1蛋白vWF蛋白正常组100.21±0.060.17±0.050.13±0.03糖尿病组100.68±0.09a0.61±0.08a0.54±0.06asiRNA-NC组100.71±0.12a0.59±0.07a0.55±0.08asiRNA-HIF-1α组100.49±0.08a,c,e0.38±0.06a,c,e0.34±0.05a,c,eF50.24671.690133.307P<0.01<0.01<0.01
注:aP<0.05vs正常组;cP<0.05vs糖尿病组;eP<0.05vssiRNA-NC组。

图4各组小鼠视网膜组织中HIF-1α、ET-1、vWF蛋白表达。
3讨论
DR作为糖尿病患者常见的眼部并发症,发病机制较为复杂,且发病率高、致盲率高,严重影响患者生活质量。研究表明[6],长期高糖状态导致血管内皮功能异常及微循环障碍在DR发病中发挥关键性作用。本研究参考文献[7]的方法,利用腹腔注射链脲佐菌素制备小鼠糖尿病模型,7d时血糖值均>11.1mmol/L,出现了“多饮多食、体质量减轻”的症状,提示成功构建了小鼠糖尿病模型,建模12wk后,HE染色观察视网膜组织形态发现,糖尿病组小鼠视网膜中各层细胞排列杂乱,细胞核出现肿胀、视网膜组织水肿,提示高糖导致小鼠视网膜发生病理性改变。免疫组化染色结果显示,糖尿病组小鼠视网膜血管内皮细胞CD34阳性表达数增加,MVD计数增加,而CD34是新生小血管特异性分化抗原[8],提示血管新生参与了糖尿病小鼠视网膜病变。
研究表明[9],糖尿病所致机体高糖环境会导致视网膜供血不足而处于相对缺氧状态。HIF-1α作为机体重要的氧含量感受器及调控蛋白,在调节血管新生、细胞外基质代谢、炎症反应等过程中发挥重要作用[10],本研究利用siRNA技术特异性将HIF-1α沉默,并注入玻璃体腔,PCR和Western blot结果均显示,siRNA-HIF-1α组视网膜组织中HIF-1α mRNA和蛋白表达降低,提示视网膜组织中HIF-1α基因被沉默。本研究显示,siRNA-HIF-1α组小鼠视网膜中各层细胞排列趋于规则,细胞核肿胀减轻,视网膜血管内皮细胞CD34表达细胞数和MVD计数均较糖尿病组和siRNA-NC组减少,说明特异性沉默HIF-1α基因可减轻糖尿病小鼠视网膜病变以及微血管新生。VEGF作为促进血管新生的关键性因子,在调控血管新生中发挥主导作用[11],同时,VEGF是HIF-1α信号通路下游重要的靶基因[12],本研究显示,糖尿病组小鼠视网膜组织中HIF-1α、VEGF mRNA相对表达量增加,而siRNA-HIF-1α组均被抑制,说明特异性抑制HIF-1α基因可能通过抑制VEGF而减少糖尿病小鼠视网膜血管新生。
有研究指出[13],机体高糖状态可导致大量炎症因子释放而引发炎症反应。炎症反应可导致血管内皮功能损伤[14]。ET-1作为血管收缩因子,主要由血管内皮细胞分泌,与一氧化氮形成动态平衡而维持和保护内皮细胞功能[15],有研究指出[16],HIF-1可直接激活ET-1表达。vWF作为内皮细胞损伤因子,与内皮损伤程度呈正相关[17],是血管内皮受损的标志物之一。本研究显示,糖尿病组小鼠NF-κB、IL-1、IL-6、TNF-α mRNA相对表达量均升高,且ET-1、vWF蛋白相对表达量均升高,说明糖尿病小鼠机体发生炎症反应而导致视网膜组织中血管内皮功能损伤,本研究显示,siRNA-HIF-1α组小鼠视网膜组织中VEGF、NF-κB、IL-1、IL-6、TNF-α mRNA相对表达量均降低,ET-1、vWF蛋白相对表达量均降低,说明特异性沉默HIF-1α基因可通过减轻炎症反应而减少视网膜血管内皮功能损伤。
综上所述,特异性沉默HIF-1α基因可保护糖尿病视网膜病变小鼠视网膜,其机制可能通过减少VEGF表达抑制血管新生,以及减少炎症反应减轻血管内皮损伤有关,有望成为DR基因治疗的新靶位。本研究后续将进一步对HIF-1α作用靶点及具体的分子机制开展研究,以明确其在抗炎、减少血管内皮损伤中的相关机制。
