不同来源食源性致病菌脂多糖诱导巨噬细胞炎症相关因子表达研究
2019-12-09南京市食品药品监督检验院扬州大学食品科学与工程学院
□ 蒋 卉 南京市食品药品监督检验院 万 凯 扬州大学食品科学与工程学院
革兰氏阴性食源性致病菌作为最常见的病原菌,已成为严重威胁到食品安全和公众健康。虽然高温高压可以杀死细菌,但细菌内毒素(脂多糖,LPS)不会随着细菌的死亡而消失或被破坏,细菌死亡后释放的LPS仍可能威胁人类健康。LPS由内至外由3个部分共价连接:疏水的类脂A、核心寡糖和亲水的O-抗原。LPS引起炎症反应,可导致多种感染或致命的脓毒性休克综合症[1-3]。研究表明,脂多糖可诱导巨噬细胞炎症反应[4-5],促进炎症相关因子表达。但是不同种类革兰氏阴性菌的LPS结构不同,其免疫活性也有很大差别[6-8]。本文通过考察大肠杆菌O26:B6、肠炎沙门氏菌、铜绿假单胞菌10来源的LPS诱导Raw264.7细胞炎症相关因子表达的情况,对不同来源食源性致病菌LPS的免疫活性进行比较研究。
1 仪器与试剂
1.1 主要实验仪器
生物安全柜(美国Thermo公司);3111型二氧化碳培养箱(美国Thermo公 司 );CFX96 Optics Module型扩增仪(美国BIO-RAD公司);UV5Nano超微量分光光度计(瑞士METTLER TOLEDO公司);Allegra X-30R离心机(美国BEXKMAN 公 司 );SpectraMaxμ M3多功能酶标仪(美国Molecular Devices公司);Axio Vert.A1倒置式显微镜(德国Carl Zeiss公司)。
1.2 主要实验试剂
Raw264.7小鼠单核巨噬细胞白血病细胞购自中国科学院细胞库;DMEM 培 养 基(C11995500BT)、胎牛血清(10099141C)购自美国Gibco公司;大肠杆菌O26:B6来源LPS(L2654)、肠炎沙门氏菌来源LPS(L7770)、铜绿假单胞菌10来源LPS(L9143)购自美国Sigma公司;Prime Script™ RT reagent Kit with gDNA Eraser(RR047A)、TB Green ™ Premix Dimer Eraser™(RR091A)购自Takara公司;总RNA提取试剂(B511321)购自生工生物工程(上海)股份有限公司;CCK-8试剂(C0037)、一氧化氮检测试剂盒(S0021)购自碧云天生物技术有限公司;IL-1β、IL-6、TNF-α、IL-1α、iNOS和β-actin基因引物由南京金斯瑞生物工程有限公司合成。
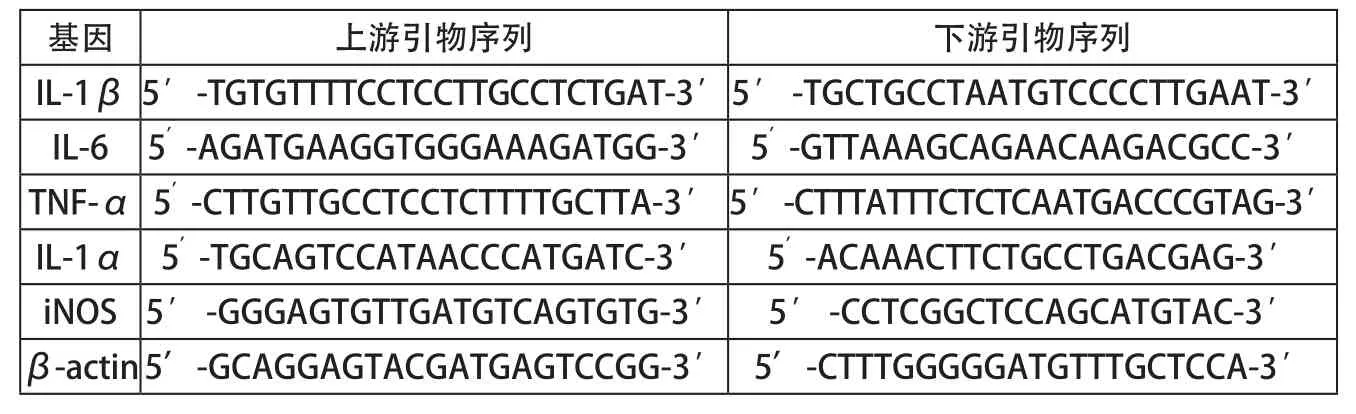
表1 目的基因及内参的引物序列表
2 方法
2.1 细胞培养
细胞培养液:90% DMEM,10%(v/v)胎牛血清。Raw264.7细胞于37 ℃、5% CO2条件下培养。
2.2 细胞活性实验
将细胞接种于96孔板,每孔5 000个细胞。分别给予0(对照组)、0.001、0.01、0.1、1、10、100、1 000 ng/mL与10 000 ng/mL的大肠杆菌O26:B6、肠炎沙门氏菌、铜绿假单胞菌10来源LPS,于37 ℃、5% CO2的条件下处理24 h。提前4 h加入CCK-8溶液,使用酶标仪在450 nm处测量吸光度。实验平行测定3次。
2.3 细胞中IL-1β、IL-6、TNF-α、IL-1α和iNOS mRNA的检测
采用RT-qPCR法检测细胞中的炎症相关因子IL-1β、IL-6、TNF-α、IL-1α和iNOS mRNA的表达。相关基因引物序列见表1。
将细胞分为对照组(不加LPS)、大肠杆菌O26:B6来源LPS组(LPS终浓度0.1、1、10 μg/mL)、肠炎沙门氏菌来源LPS组(LPS终浓度0.1、1、10 μg/mL)、铜绿假单胞菌10来源LPS组(LPS终浓度0.1、1、10 μg/mL),每组均设置3个复孔,于37 ℃、5% CO2条件下处理6 h后倒掉孔板中的培养液液,收集孔板底部的细胞,用于提取总RNA。细胞总RNA按照UNlQ-10柱式Trizol总RNA抽提试剂盒说明操作,用UV5Nano超微量分光光度计测定总RNA纯度和浓度。将符合A260/A280=1.8-2.0的RNA样品进行逆转录,逆转录反应按照逆转录试剂盒说明操作。将合成得到的cDNA作为模板,进行PCR反应。PCR反应的仪器设置参数:Stage 1:预变性95 ℃、30 s循环1次;Stage 2:PCR 反应 95 ℃、5 s,55 ℃、30 s,72 ℃、30 s循环40次;Dissociation Stage:95 ℃、15 s,60 ℃、30 s,95 ℃、15 s循环1次。反应结束后确认RT-qPCR的扩增曲线和溶解曲线,根据公式计算出目标基因的相对表达水平,计算公式[9]参考式(1)。

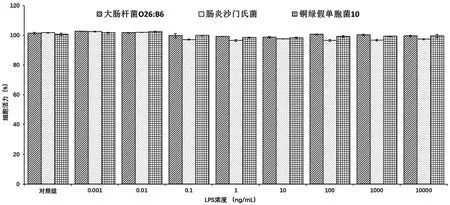
图1 不同来源LPS刺激下Raw264.7细胞的存活率图
2.4 NO的检测
将细胞接种于96孔板,分别给予0(对照组)、0.001、0.01、0.1、1、10、100、1 000、10 000 ng/mL 的大肠杆菌O26:B6、肠炎沙门氏菌、铜绿假单胞菌10来源LPS于37 ℃、5%CO2条件下处理6 h、24 h,每组均设置3个复孔。采用NO试剂盒检测细胞上清液中NO稳定氧化代谢产物亚硝酸盐()水平。吸取50 μL上清液于96孔板中,按照一氧化氮检测试剂盒说明书加入相应试剂,使用酶标仪在540 m处测量各孔吸光度,根据标准曲线计算出NO的含量。
2.5 统计学方法
采用SPSS统计软件进行分析,两组间比较采用独立样本t检验,p<0.05为差异有统计学意义。
3 实验结果
3.1 LPS对Raw264.7细胞存活力的影响
经 0.001、0.01、0.1、1、10、100、1 000、10 000 ng/mL的 大 肠杆菌O26:B6、肠炎沙门氏菌、铜绿假单胞菌10来源LPS刺激24 h后,Raw264.7细胞的生长并未受到影响,各组与空白对照组相比均无统计学差异(见图1)。因此,所选LPS浓度可用于后续实验。
3.2 不同来源食源性致病菌LPS诱导Raw264.7细胞表达IL-1β、IL-6、TNF-α、IL-1α、iNOS mRNA的情况
如图2所示,与对照组相比,经各浓度大肠杆菌O26:B6、肠炎沙门氏菌来源LPS刺激6 h后炎症因子IL-1β、TNF-α、IL-1α、iNOS mRNA的表达量均有显著升高(p<0.05,n=3),IL-6 mRNA的表达量有一定程度的升高,但无统计学差异(1 μg/mL和10 μg/mL肠炎沙门氏菌来源LPS处理组除外)。与对照组相比,铜绿假单胞菌10来源LPS刺激6 h后仅有10 μg/mL LPS处理组的iNOS mRNA的表达量有显著升高(p<0.05,n=3),其余组各种炎症因子稍有升高,但均无统计学差异。
刺激Raw264.7细胞6 h后,大肠杆菌O26:B6来源LPS组与肠炎沙门氏菌来源LPS组相比,各种炎症因子mRNA的表达量均无统计学差异。而铜绿假单胞菌10来源LPS组的各种炎症因子mRNA的表达量(0.1 μg/mL LPS处理组的IL-6 mRNA的表达量除外)均显著低于大肠杆菌O26:B6来源LPS组、肠炎沙门氏菌来源LPS组(p<0.05,n=3)。
不同来源食源性致病菌LPS诱导Raw264.7细胞表达IL-1β、IL-6、TNF-α、IL-1α和iNOS mRNA的量有所差异。铜绿假单胞菌10来源LPS诱导Raw264.7细胞表达炎症相关因子的能力明显低于大肠杆菌O26:B6来源LPS、肠炎沙门氏菌来源LPS。大肠杆菌O26:B6来源LPS与肠炎沙门氏菌来源LPS诱导Raw264.7细胞表达炎症相关因子的能力无统计学差异。
3.3 不同来源食源性致病菌LPS诱导Raw264.7细胞释放NO的情况
采用Griess法检测了分别在大肠杆菌O26:B6、肠炎沙门氏菌、铜绿假单胞菌10来源LPS刺激6 h、24 h下Raw264.7细胞释放NO的情况。研究结果如图3所示,在相同的LPS浓度下,大肠杆菌O26:B6来源LPS与肠炎沙门氏菌来源LPS诱导Raw264.7细胞产生的NO量无统计学差异;大肠杆菌O26:B6、肠炎沙门氏菌来源LPS诱导Raw264.7细胞产生的NO量明显多于铜绿假单胞菌10来源的LPS(p<0.05,n=3)。随着刺激时间的延长,Raw264.7细胞NO释放量增加。刺激6 h时,不同来源LPS诱导Raw264.7细胞释放NO具有明显的剂量依赖性(见图3a)。值得注意的是,刺激24 h时,各浓度大肠杆菌O26:B6、肠炎沙门氏菌来源LPS诱导后Raw264.7细胞的NO释放量均呈现较高水平,而铜绿假单胞菌10来源LPS诱导Raw264.7细胞释放NO依然具有明显的剂量依赖性(见图3b)。这说明,长时间的LPS刺激可使Raw264.7细胞NO的释放量稳定,且不再与LPS浓度相关。
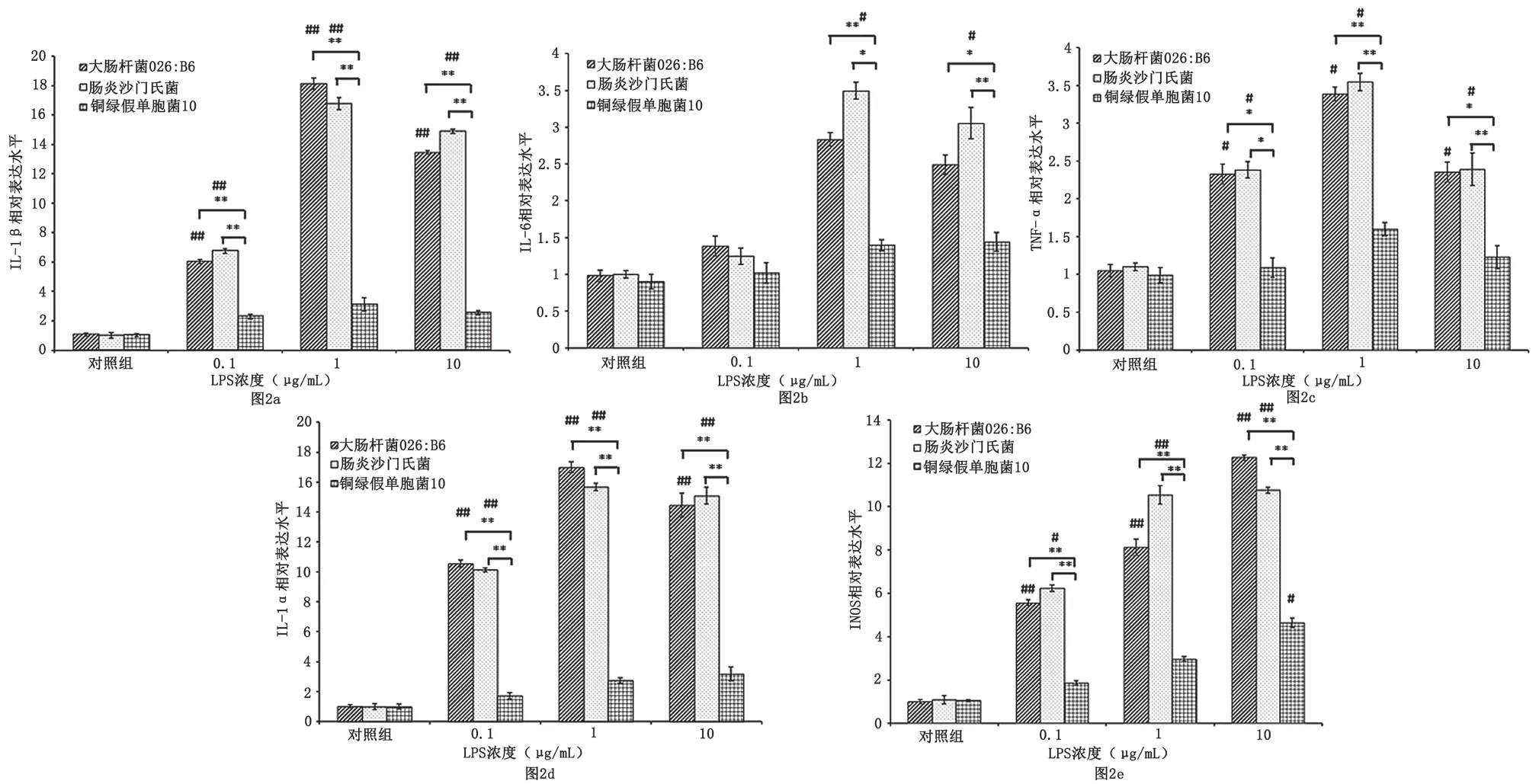
图2 不同来源LPS诱导Raw264.7细胞表达炎症相关因子的情况图

图3 不同来源LPS诱导Raw264.7细胞释放NO的情况图
4 讨论
LPS为革兰氏阴性菌的主要成分,是介导系统性炎症反应综合症的主要启动因子[10]。巨噬细胞可分为经典的M1型、M2型巨噬细胞,还有肿瘤相关巨噬细胞、CD169+巨噬细胞、TCR+巨噬细胞[11]。当细胞接受LPS刺激时,LPS通过巨噬细胞表面的Toll样受体4(TLR4)来活化核转录因子KappaB(NF-κB),发生经典的M1型巨噬细胞激活,从而诱导大量的炎症因子和细胞因子的表达[12],包括TNT-α、IL-6和IL-1α等产生炎症[13-15],并能够高表达诱生型一氧化氮酶(iNOS)。
本文选择Raw264.7巨噬细胞(M1)为细胞模型,初步研究了不同来源食源性致病菌LPS诱导巨噬细胞炎症相关因子IL-1β、IL-6、TNF-α、IL-1α、iNOS mRNA的表达及NO的释放情况。结果表明,铜绿假单胞菌10来源LPS诱导Raw264.7细胞表达炎症相关因子的能力及NO的释放明显低于大肠杆菌O26:B6来源LPS、肠炎沙门氏菌来源LPS。这与革兰氏阴性菌LPS的结构,主要与类脂A的结构有关。类脂A酰化程度对LPS与巨噬细胞中MD-2和TLR4的结合具有很大的影响[16-17],进而影响LPS的免疫活性。虽然所有革兰氏阴性菌细胞壁均有LPS,但是脂多糖的结构是不同的。据文献报道,大部分肠杆菌科细菌的LPS均含有六个酰基链[6],如大肠杆菌、沙门氏菌等。而铜绿假单胞菌10来源的LPS含有五个酰基链[7-8]。六酰化(含有六个酰基链)类脂A表现出的免疫活性最强[6]。与之相比,五酰化类脂A活性要低100倍,而四酰化类脂A无活性[7-8]。故铜绿假单胞菌10来源的LPS是一种较弱的TLR4受体激动剂,其免疫活性较弱。来自肠杆菌科的食源性致病菌LPS可诱导巨噬细胞炎症相关因子mRNA的高表达,具有较强的免疫活性。
