DNMT1抑制剂DC_517对胶质瘤细胞增殖和侵袭的影响
2019-12-06徐雅娣卞尔保纪兴虎杨志豪万经海
徐雅娣,赵 兵,卞尔保,纪兴虎,杨志豪,汤 锋,万经海
胶质瘤是中枢神经系统最常见的恶性肿瘤,术后易复发,患者术后常需辅以放疗及化疗[1-2]。DNA甲基化是一种由甲基化转移酶(DNA methyltransferases,DNMTs)介导的化学修饰,与胶质瘤的发生、发展密切相关[3]。因此,抑制DNA甲基化转移酶的功能可能作为治疗胶质瘤的靶点。近年来,DNMT抑制剂在临床试验中得到充分验证,如阿扎胞苷联合替莫唑胺可抑制IDH突变型胶质瘤的增殖[4]。DC_517是一种新的DNA甲基转移酶1(DNA methyltransferase-1,DNMT1)抑制剂,研究[5]显示,DC_517可显著抑制肿瘤细胞的增殖,但其在胶质瘤中的作用尚未可知。该文以人脑胶质瘤细胞LN18细胞系作为研究对象,探讨DC_517对LN18细胞系的增殖、迁移侵袭能力的影响及其可能的分子机制。
1 材料与方法
1.1 主要试剂与仪器DC_517购自美国MedChemExpress (MCE)公司;胎牛血清购自美国Gbico公司;胰蛋白酶、SDS-PAGE蛋白上样缓冲液(5×)购自上海碧云天科技公司;山羊抗兔、山羊抗鼠抗体购自北京博奥森生物技术有限公司;高糖培养基(DMEM)购于美国Hyclone公司;CCK-8试剂盒购自上海贝博生物有限公司;Transwell小室购自美国Corning公司;基质胶购自美国BD公司;β-actin、增殖相关蛋白增殖细胞核抗原(proliferating cell nuclear antigen,PCNA) 和G1/S-特异性周期蛋白-D1 (G1/S-specific cyclin-D1,Cyclin D1)等抗体购自美国Abcam公司;基质金属蛋白酶-9 ( matrix metalloproteinase-9,MMP9)抗体购自北京博奥森生物技术有限公司;TS100型倒置显微镜购自日本Nikon公司;超净工作台购自苏州净化设备公司;ST-360酶标仪器购自上海科华实验系统有限公司。
1.2 方法
1.2.1细胞培养 人脑胶质瘤LN18细胞购自上海中科院。细胞培养在含10%胎牛血清的DMEM培养基中,置于37 ℃、5%CO2恒温培养箱内培养。在显微镜下观察到细胞汇合率达到80%以上,即进行细胞传代。当细胞处于对数生长期时用于实验。
1.2.2CCK-8法检测DC_517对脑LN18胶质瘤细胞增殖的影响 取处于对数生长期的细胞,用胰蛋白酶消化并制成细胞悬液。每孔按4×103个接种至96孔板中,每组设置6个复孔,置于细胞培养箱中培养,待细胞贴壁后加入相应浓度的DC_517,继续培养至相应时间后,弃去含药培养基,每孔加入新鲜配制的含10 μl CCK-8溶液的培养基,置于培养箱中继续培养4 h后,在酶标仪上选择 450 nm 波长测定各组细胞吸光度(OD)值。实验重复3次,取实验结果的平均值作为最终实验结果。按公式计算细胞存活率=[(实验组OD值-空白组OD值)]/[(对照组OD值-空白组OD值)]×100%,以分组为横坐标,细胞存活率为纵坐标,绘制柱状图。
1.2.3细胞迁移、侵袭实验 取经不同浓度DC_517处理不同时间后的细胞,胰蛋白酶消化后用培养基重悬。调整细胞密度至1×105~10×105个/ml,加入事先处理好的Transwell小室,迁移实验每孔加入1×104个细胞,侵袭实验每孔加入7×104个细胞,24孔板下室加入500 μl含10%胎牛血清的培养基,注意不要产生气泡。培养箱分别培养24 h、48 h后,对附着在小室底部膜下侧的细胞用4%多聚甲醛固定后结晶紫染色,显微镜下拍照并计数细胞。
1.2.4蛋白免疫印迹实验 将DC_517处理好的细胞提取蛋白,并根据BCA法测定蛋白浓度,以蛋白体积 ∶5×SDS上样缓冲液体积=1 ∶4的比例加入蛋白上样缓冲液后100 ℃煮沸10 min。制备凝胶,加入等量的蛋白样品,每组加2组复孔。开始电泳,先80 V 电泳30 min,待电泳至分离胶时,改为120 V继续电泳60 min。电泳完成后切胶,切下目的蛋白,根据所切胶的大小,将PVDF膜用剪刀剪出比胶面积略大的PVDF膜,甲醇激活后敷在胶上,注意不要产生气泡。将胶置于转膜夹子中夹紧,转膜槽中转膜,时间根据目的蛋白分子量大小调整。转膜完成后,用5%脱脂牛奶封闭1 h,TBST洗5 min×5次,膜置于相应一抗中4 ℃过夜。第2天TBST洗5 min×5次后,用辣根过氧化物酶标记的相应二抗孵育约1 h,继续TBST洗5 min×5次,最后显影仪下进行化学发光检测,得到相应蛋白条带。

2 结果
2.1 DC_517加药处理后对LN18细胞增殖的影响与对照组比较,用浓度为1 μmol/L的DC_517作用于LN18细胞48 h后,细胞相对存活率明显下降,差异有统计学意义(F=6.714,P<0.05),而作用24 h后效果不明显(F=6.714,P>0.05),见图1A。用不同浓度DC_517(浓度分别为0、1、5 μmol/L)处理LN18细胞48 h后,CCK-8法检测结果显示DC_517对细胞增殖的抑制率呈现浓度依赖性(F=45.078,P<0.01),见图1B。
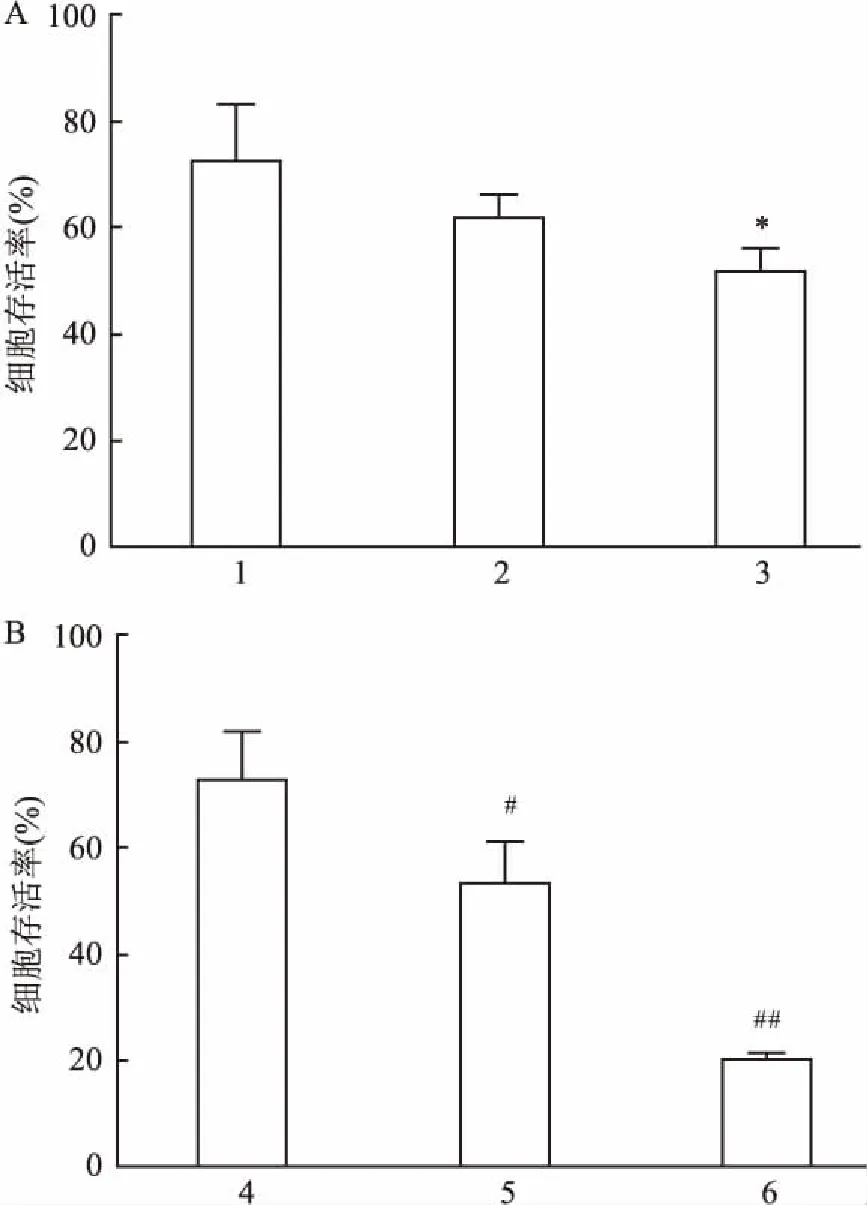
图1 不同浓度DC_517处理LN18细胞不同时间后对细胞增殖及DC_517对LN18细胞增殖的影响
A: 1 μmol/L DC_517处理LN18细胞后对细胞增殖的影响;1: 0 h-1 μmol/L组;2: 24 h-1 μmol/L组;3: 48 h-1 μmol/L组; 与0 h-1 μmol/L组比较:*P<0.05; B: DC_517处理LN18细胞48 h后对细胞增殖的影响; 4: 48 h-0 μmol/L组;5: 48 h-1 μmol/L组;6: 48 h-5 μmol/L组; 与48 h-0 μmol/L组比较:#P<0.05,##P<0.01
2.2 DC_517加药处理后对LN18细胞增殖相关蛋白表达的影响如图2A,用浓度为1 μmol/L的DC_517作用于LN18细胞,与对照组比较,PCNA和Cyclin D1相对表达量在作用48 h后降低,差异有统计学意义(F=13.520、F=96.005,P<0.01);作用24 h后,Cyclin D1蛋白相对表达量降低,而PCNA蛋白相对表达量无明显变化(F=96.005,P<0.05;F=13.520,P>0.05)。如图2B,用不同浓度DC_517处理LN18细胞48 h后,各DC_517处理组PCNA和Cyclin D1 蛋白表达水平显著低于对照组(F=170.010、F=79.676,P<0.01),且随DC_517浓度的升高,两种蛋白的表达水平相应降低。
2.3 DC_517加药处理后对LN18细胞迁移、侵袭力的影响如图3A所示,用浓度为1 μmol/L的DC_517分别作用于LN18细胞0 h、24 h、48 h,与对照组比较,DC_517作用24 h后细胞迁移数未见明显减少,而作用48 h后,细胞迁移数明显减少(F=27.952,P>0.05;F=27.952,P<0.01)。用不同浓度DC_517处理LN18细胞48 h后,与对照组比较,各DC_517处理组细胞迁移数减少,且细胞迁移数随着DC_517浓度升高而减少(F=93.278,P<0.01),见图3B。除此之外,DC_517对LN18细胞侵袭力的影响呈现出与其对细胞迁移相似的结果(F=22.013,P>0.05;F=22.013,P<0.01;F=37.597,P<0.01),见图4。
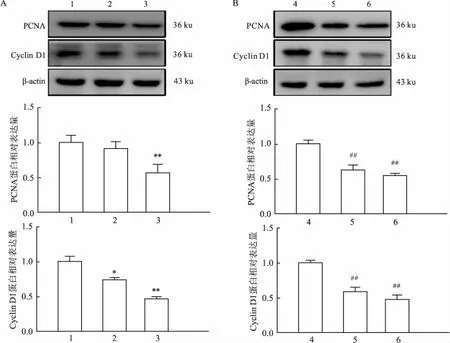
图2 DC_517对LN18细胞增殖相关蛋白的影响
A: 1 μmol/L DC_517处理LN18细胞后对增殖相关蛋白的影响;1: 0 h-1 μmol/L组;2: 24 h-1 μmol/L组;3: 48 h-1 μmol/L组; 与0 h-1 μmol/L组比较:*P<0.05,**P<0.01; B: DC_517处理LN18细胞48 h后对增殖相关蛋白的影响;4: 48 h-0 μmol/L组;5: 48 h-1 μmol/L组;6: 48 h-5 μmol/L组; 与48 h-0 μmol/L组比较:##P<0.01
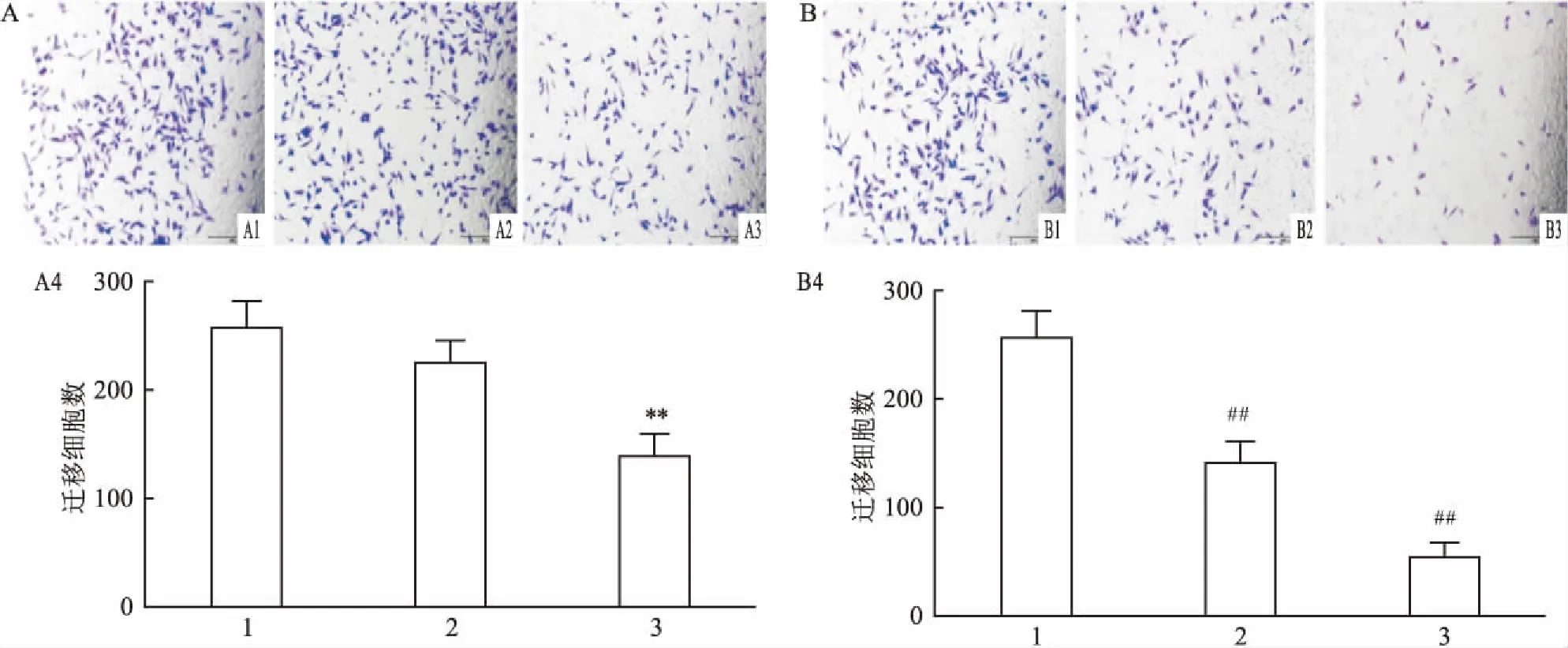
图3 DC_517对LN18细胞迁移的影响 ×100
A: 1 μmol/L DC_517处理LN18细胞后对细胞迁移的影响;A1: 0 h-1 μmol/L组;A2: 24 h-1 μmol/L组;A3: 48 h-1 μmol/L组; A4:各组直方图;与0 h-1 μmol/L组比较:**P<0.01; B: DC_517处理LN18细胞48 h后对细胞迁移的影响;B1: 48 h-0 μmol/L组;B2: 48 h-1 μmol/L组;B3: 48 h-5 μmol/L组; B4:各组直方图;与48 h-0 μmol/L组比较:##P<0.01
2.4 DC_517加药处理后对LN18细胞迁移、侵袭相关蛋白表达的影响用浓度为1 μmol/L的DC_517作用于LN18细胞,与对照组比较,迁移侵袭相关蛋白基质金属蛋白酶-9(MMP9)蛋白相对表达量在作用24 h后未见明显变化,而在作用48 h后相对表达量明显降低(F=15.202,P>0.05,F=15.202,P<0.01),见图5A。用不同浓度DC_517处理LN18细胞48 h后,与对照组比较,浓度为1 μmol/L和5 μmol/L组MMP9蛋白表达水平降低,且随着DC_517浓度升高,MMP9蛋白表达水平逐渐降低(F=67.840,P<0.01)。
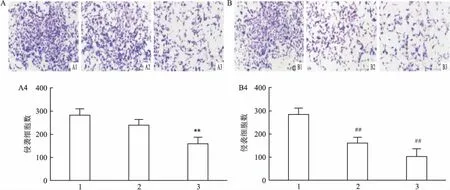
图4 DC_517对LN18细胞侵袭的影响 ×100
A: 1 μmol/L DC_517处理LN18细胞后对细胞侵袭的影响;A1: 0 h-1 μmol/L组;A2: 24 h-1 μmol/L组;A3: 48 h-1 μmol/L组;A4:各组直方图;与0 h-1 μmol/L组比较:**P<0.01; B: DC_517处理LN18细胞48 h后对细胞侵袭的影响;B1: 48 h-0 μmol/L组;B2: 48 h-1 μmol/L组;B3: 48 h-5 μmol/L组;B4:各组直方图;与48 h-0 μmol/L组比较:##P<0.01
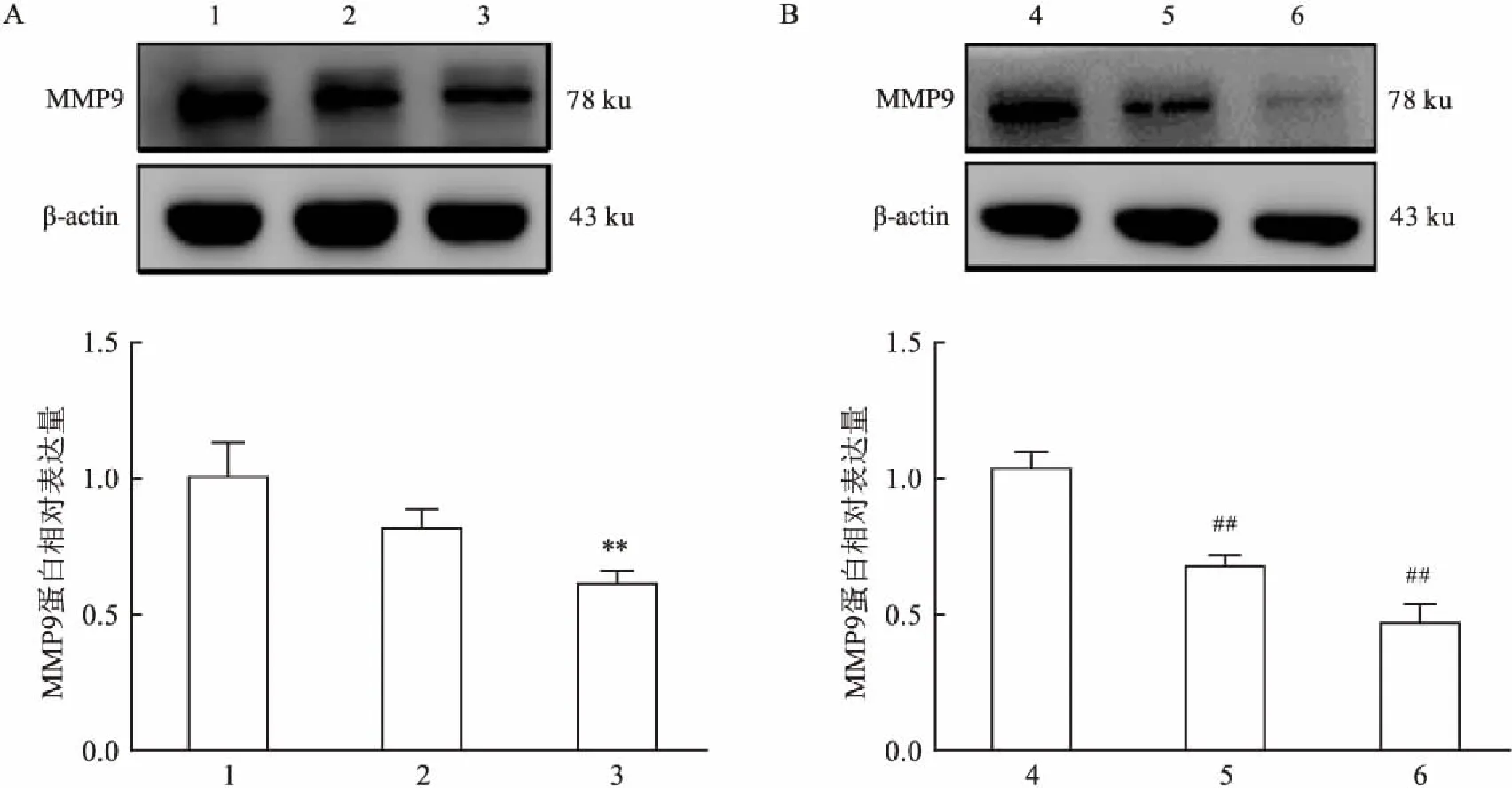
图5 DC_517对LN18细胞迁移侵袭相关蛋白的影响
A: 1 μmol/L DC_517处理LN18细胞后对迁移侵袭相关蛋白的影响;1: 0 h-1 μmol/L组;2: 24 h-1 μmol/L组;3: 48 h-1 μmol/L组; 与0 h-1 μmol/L组比较:**P<0.01; B: DC_517处理LN18细胞48 h后对迁移侵袭相关蛋白的影响;4: 48 h-0 μmol/L组;5: 48 h-1 μmol/L组;6: 48 h-5 μmol/L组; 与48 h-0 μmol/L组比较:##P<0.01
3 讨论
恶性胶质瘤是最常见和最致命的原发性恶性脑肿瘤,亟需有效的治疗[6]。目前胶质瘤的治疗仍以手术切除为主,辅以放射治疗及化学治疗,主要的化疗药物为替莫唑胺,但部分患者的化疗效果并不理想,文献[4,7]报道替莫唑胺联合DNMTs抑制剂阿扎胞苷可抑制IDH突变型胶质瘤的增殖,表明DNMTs抑制剂可能作为一种新的化疗辅助药物。
DNA甲基化是指在DNMTs的催化下,S-腺苷甲硫氨酸(SAM)作为甲基供体,将胞嘧啶转变为5-甲基胞嘧啶(5mC)的一种反应,研究表明异常的DNA甲基化可以调控胶质瘤的发生、发展[3]。 DNMTs在DNA甲基化中发挥关键的催化作用,其主要包括DNMT1、DNMT2、DNMT3A、DNMT3B和DNMT3L,其中DNMT1是最早被研究且研究范围最广的DNA甲基转移酶[8]。大量的研究[5,9-11]表明,DNMTs抑制剂可通过抑制DNMTs的功能进而抑制异常的DNA甲基化发生,最终抑制肿瘤的进展。本课题组的前期研究[9]发现,DNA甲基转移酶抑制剂5-AZA可以特异性抑制DNMT1活性,抑制异常的甲基化发生,激活沉默的抑癌基因DOK7,逆转胶质瘤细胞的生物学特征。据报道DNMTs抑制剂zebularine可抑制肝癌细胞的增殖[10]。此外,Borges et al[11]报道DNMT抑制剂可以降低乳腺癌细胞的侵袭力。DC_517是一种新的DNMT1抑制剂,并可显著抑制肿瘤细胞的增殖[5]。本实验研究表明用不同浓度的DC_517处理LN18细胞48 h后,DC_517抑制胶质瘤细胞的增殖、迁移侵袭能力的作用随其浓度的增加而增强。此外用DC_517处理LN18细胞48 h后,DC_517可通过抑制增殖相关蛋白PCNA、CyclinD1表达进而显著抑制胶质瘤细胞的增殖,通过抑制迁移侵袭相关蛋白MMP9表达进而抑制胶质瘤细胞的迁移侵袭。以上结果表明DNMT1抑制剂DC_517可通过抑制增殖相关蛋白PCNA、CyclinD1和侵袭相关蛋白MMP9的表达分别抑制LN18胶质瘤细胞的增殖和侵袭。
目前国内外已经报道的DNMTs抑制剂主要分为核苷类似物和非核苷类似物,核苷类代表药物主要有地西他滨和阿扎胞苷;非核苷类主要包括普鲁卡因、普鲁卡因胺、肼屈嗪和米托蒽[12-13]。核苷类似物具有化合物不稳定、细胞毒性大、副作用大等缺点,而非核苷类似物由于不破坏细胞RNA结构,结构稳定,特异性强,具有更广阔的临床应用前景,而本实验所用的DNMT1抑制剂DC_517即属于非核苷类似物类[5,14]。近年来,DNMTs抑制剂在临床试验中也得到充分验证,如阿扎胞苷可用于治疗骨髓增生异常综合征(MDS)和急性髓细胞白血病,说明抑制DNMTs的功能可能成为治疗肿瘤的靶点[15]。本实验的研究结果表明,非核苷类似物类DNMT1特异性抑制剂DC_517可显著抑制胶质瘤LN18细胞的增殖和侵袭,为临床胶质瘤的化疗提供一定的借鉴。
