高脂饮食诱导CYP4A高表达参与小鼠非酒精性脂肪肝病程研究
2019-12-06高惠芳曹雅茹夏宏光朱项羽
高惠芳,曹雅茹,夏宏光,朱项羽,金 涌
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)患者常表现为高血脂、高极低密度脂蛋白和BMI升高[1]。NAFLD时脂肪组织释放的游离脂肪酸酯化成甘油三酯(triglyceride,TG)储存在肝细胞中,并以极低密度脂蛋白的形式运输到外周[2]。TG本身是没有毒性作用的,但是脂质代谢途径的失调产生的脂毒性是疾病发生的主要因素[3]。碳水化合物、糖类、脂肪酸等增加肝脏代谢导致有毒脂质积累,而代谢产物诱导肝细胞氧化应激、损伤和死亡[4]。细胞色素P450(cytochrome P450,CYP)依赖还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)提供的电子氧化脂肪酸产生活性氧(reactive oxygen species,ROS)是导致肝细胞损伤的重要原因[5]。 CYP4家族ω-羟基化脂肪酸,该代谢途径能产生关键的脂质介质20-羟基二十烷四烯酸(20-hydroxyeicosatetraenoic acid,20-HETE)[6]。该研究利用高脂乳剂灌胃造成小鼠NAFLD,探究CYP4A高表达时对NAFLD病程的影响。
1 材料与方法
1.1 材料
1.1.1实验动物 健康雄性C57BL/6小鼠50只,体质量18~22 g,购自安徽医科大学实验动物中心。小鼠饲养于12 h光照循环的房间并自由饮食,实验开始前适养1周。
1.1.2主要试剂 谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、TG试剂盒(南京建成公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(上海Beyotime公司);20-HETE(美国MedChemExpress公司);CYP4A单克隆抗体(美国abcam公司);β-actin多克隆抗体、二抗(北京中杉金桥);荧光倒置显微镜(日本Olympus公司);RIPA(上海Beyotime公司);PVDF膜(美国Milipore公司);ECL发光试剂盒(美国Thermo公司)。
1.2 方法
1.2.1高脂乳剂的制备 高脂乳剂含40%的脂肪能量,主要成分包含以下成分:油相:猪油400 g、胆固醇80 g、聚山梨酯-80 50 ml;水相:食用盐10 g、胆酸钠10 g、丙硫氧嘧啶10 g、丙二醇175 ml、冰糖156 g、蒸馏水100 ml;水相于60 ℃水浴锅中加热后加入到油相中溶解并进行混合。将混合均匀的乳剂进行分装并存于4 ℃冰箱,用时55 ℃水浴加热溶解。
1.2.2小鼠分组 将小鼠随机分为5组,每组10只;采用自制的高脂乳剂进行非酒精脂肪肝造模,设置正常对照组、4周、6周、8周、10周组。眼球取血处死,血液静置30 min后离心取上清液。肝脏被立即取出并置于冰上,切取部分肝左叶保存于4%多聚甲醛溶液中,剩余组织立即保存在-80 ℃冰箱。
1.2.3肝组织HE染色 肝组织小块浸泡于4%多聚甲醛溶液中固定24 h后置于一系列浓度梯度的酒精中做脱水处理,脱水后的肝组织浸入蜡液中包埋,然后转入纯二甲苯中浸渍透明数小时。蜡块在轮式切片机上进行切片,厚度在4~7 μm,切出一片接一片的蜡带,用毛笔轻托轻放在纸上。将切片贴在洁净的载玻片上,45 ℃恒温箱中干燥后进行脱蜡及水化处理,最后进行苏木精伊红染色。
1.2.4鼠血清生化检测 血清样本中TG、ALT、AST、MDA 和SOD含量水平的测定采用相应试剂盒的生化检测法,并按操作说明检测。血清样品无需前处理可直接用于测定。最后使用酶标仪在各适宜的波长处检测样品与试剂的反应液的吸光度,根据OD值计算其浓度。
1.2.5Western blot法检测CYP4A含量的表达 用裂解液裂解肝组织匀浆提取全蛋白,BCA法定量。10% SDS-PAGE垂直电泳分离蛋白质,电转到PVDF膜上;用5%脱脂奶粉封闭2 h;CYP4A(1 ∶2 000)、β-actin(1 ∶1 000)抗体4 ℃孵育过夜。后经TBST洗涤3次,每次10 min;室温孵育辣根过氧化物酶标记二抗1 h;TBST洗膜3次,每次10 min。ECL化学发光法显示目的蛋白,蛋白条带用Image J软件进行分析。
1.2.6肝组织ROS检测 肝组织ROS表达采用冰冻切片免疫荧光法进行分析,每组至少检测3只小鼠的肝组织。步骤如下:① 染色:冰冻切片稍甩干后用组化笔在组织周围画圈(防止抗体流走),在圈内滴加ROS染液,避光恒温箱37 ℃孵育30 min。② DAPI复染细胞核:玻片置于PBS(pH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后在圈内滴加DAPI染液,避光室温孵育10 min。③ 封片:玻片置于PBS(PH 7.4)中在脱色摇床上晃动洗涤3次,每次5 min。切片稍甩干后用抗荧光淬灭封片剂封片。④ 镜检拍照:切片于荧光显微镜下观察并采集图像。
1.2.7液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC/MS/MS)检测肝组织20-HETE含量 样品预处理步骤如下:取肝脏组织50 mg并用PBS溶液冲洗,加入250 μl甲醇和5 μl甲酸,混匀后用匀浆仪匀浆。超声(冰浴中进行)破碎,超声条件:工作时间3 s,间隙时间2 s,工作60次,功率< 400 W。14 000 r/min离心10 min,吸取上清液转入新的EP管中。加入350 μl双蒸水和0.5 ml乙酸乙酯,涡旋30 s,以12 000 r/min 离心10 min取出有机相。有机相用氮气吹干,上样前用甲醇复溶。使用Waters BEH-C18柱(1.7 μm×210 mm)色谱柱,流动相:甲醇∶0.1%甲酸水=90 ∶10,流速:0.3 ml/min,柱温:35 ℃,进样量为10 μl。ESI离子源,负离子MRM模式,毛细管电压:3 kV,源电压:40 V,去溶剂气流量:500 L/h,去溶剂气温度:400 ℃,离子源温度:150 ℃。

2 结果
2.1 肝组织HE染色染色结果见图1。与对照组比较,高脂乳剂灌胃4周后小鼠肝组织并没有出现脂肪变性;灌胃6~8周后细胞核周围出现明显的脂质物质堆积;灌胃持续到10周后肝细胞内出现明显的脂肪大泡。HE染色结果表现为随着高脂乳剂灌胃时间的延长肝细胞脂质堆积逐渐增加。
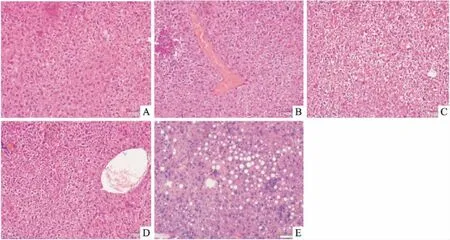
图1 C57BL/6小鼠肝组织HE染色×200
A:对照组;B:模型4周组;C:模型6周组;D:模型8周组;E:模型10周组
2.2 小鼠血清TG表达水平与对照组比较,模型8周组的血清TG水平开始明显升高(F=5.29,P<0.05),模型10周组血清TG水平出现最高水平。见图2。
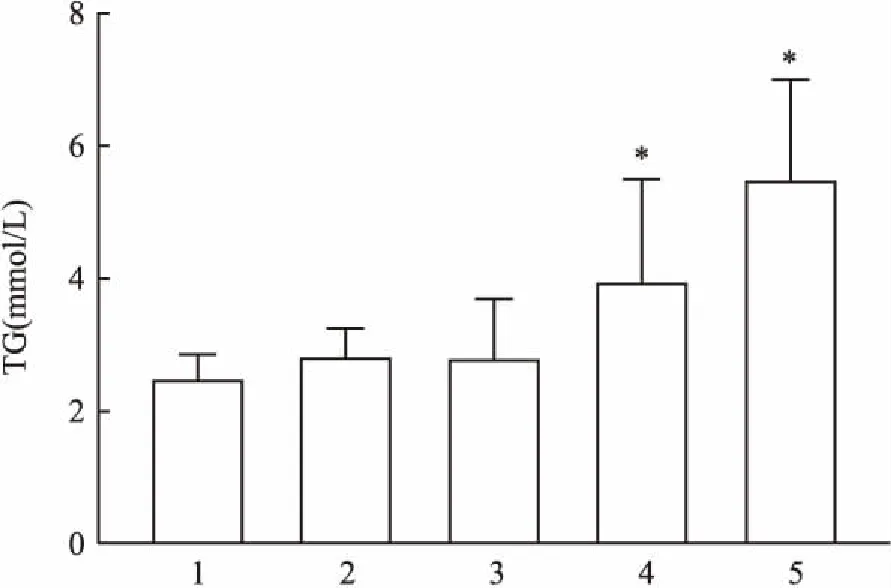
图2 C57BL/6小鼠血清TG含量水平
1:对照组;2:模型4周组;3:模型6周组;4:模型8周组;5:模型10周组;与对照组比较:*P<0.05
2.3 高脂乳剂灌胃后血清转氨酶ALT和AST的表达变化与对照组比较,模型6周组的ALT水平开始明显升高(F=2.70,P<0.01)。与对照组比较,模型6周组的AST水平亦明显增长(F=3.16,P<0.01),并且模型10周组AST水平已明显高于4周组(P<0.05)。见表1。

表1 各组C57BL/6小鼠血清ALT及AST的分泌水平
与对照组比较:**P<0.01;与模型4周组比较:#P<0.05
2.4 肝组织CYP4A蛋白表达含量小鼠肝组织主要表达CYP4A10、4A12、4A14,在本研究中是对总CYP4A酶的检测。与对照组比较,CYP4A蛋白表达含量在第6周时增加1.4倍,第8周和第10周时比第4周分别增加1.4倍和1.5倍。小鼠经过高脂乳剂灌胃后CYP4A蛋白表达水平表现为随灌胃时间延长而逐渐增加(P<0.01)。见图3。
2.5 肝组织20-HETE含量检测采用LC/MS/MS测得的20-HETE表达水平,与对照组比较,模型8周组20-HETE水平开始明显升高(F=28.64,P<0.01),20-HETE的表达与CYP4A蛋白表达趋势相一致。见图4。

图3 肝组织CYP4A蛋白表达
1:对照组;2:模型4周组;3:模型6周组;4:模型8周组;5:模型10周组;与对照组比较:**P<0.01;与模型4周组比较:#P<0.05,##P<0.01

图4 肝组织合成的20-HETE水平
1:对照组;2:模型4周组;3:模型6周组;4:模型8周组;5:模型10周组;与对照组比较:**P<0.01
2.6 肝组织ROS表达检测各组组织荧光染色情况见图5。应用Image J软件测得每组平均荧光密度。对照组(0.038±0.006),模型4周组(0.040±0.008),模型6周组(0.050±0.012),模型8周组(0.050±0.011),模型10周组(0.060±0.013);与对照组比较,模型10周组ROS荧光强度明显增强(F=2.04,P<0.05)。
2.7 血清MDA和SOD的水平MDA水平检测结果显示,与对照组比较,模型4周组MDA水平明显升高(F=62.16,P<0.01);与模型4周组比较,模型6周组MDA水平开始明显升高,并且随灌胃时间延长而逐渐增加(P<0.05),8周组的SOD活力水平开始明显低于对照组(F=5.79,P<0.05),肝组织SOD分泌水平表现为随MDA沉积增多而逐渐降低。见表2。
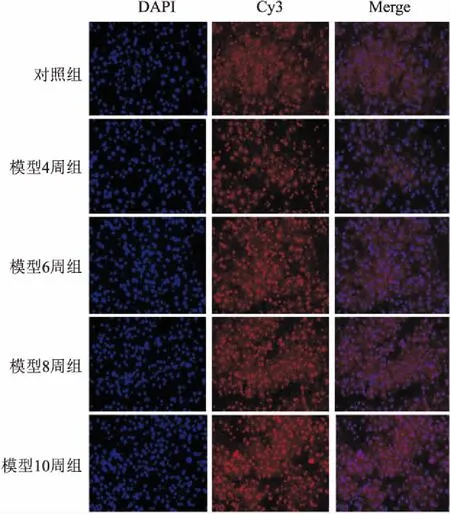
图5 肝组织ROS荧光染色 ×400

表2 各组C57BL/6小鼠血清MDA和SOD的含量水平
与对照组比较:*P<0.05,**P<0.01;与模型4周组比较:#P<0.05,#P<0.01
3 讨论
CYP4A被证明在非酒精性脂肪肝的发展中起到关键的作用,CYP4A基因表达可通过饥饿、过氧化物酶体增殖物、高脂饮食和糖尿病被诱导[7]。非酒精性脂肪肝时存在线粒体功能紊乱和内质网应激,因此CYP4家族能ω-羟基化脂肪酸引起ROS的产生[8]。
根据对鼠NAFLD模型影响的探索[9],高脂饮食后鼠血清会有TG、TC、ALT和AST的升高。在本研究中采用高脂乳剂灌胃诱导鼠NAFLD,肝组织HE染色结果分析可以知道灌胃10周可造成较为严重的肝细胞脂质堆积。同时血清中游离的TG、ALT和AST水平会相应的升高。这些结果提示该模型适用于NAFLD研究。甘油三酯水平的增加伴随着CYP4A蛋白表达水平的增长;并且CYP4A能促进脂质的摄取,CYP4A增加肝脏对脂质的摄取被报道为通过增加FAT/CD36的表达实现[10]。
对NAFLD患者的血清脂肪酸分析可知,血清FFA水平升高主要是由二十二碳六烯酸、棕榈酸、亚油酸、二十碳三烯酸和花生四烯酸组成[11]。花生四烯酸可经过细胞色素的代谢产生大量的ROS而对肝细胞产生氧化应激损伤,从而对NAFLD发挥重要的作用[12]。20-HETE是花生四烯酸经细胞色素CYP4 ω-羟基化的产物。在该研究中20-HETE升高,说明在NAFLD时增加的CYP4A参与了游离脂肪酸的氧化处理。
氧化应激和脂质过氧化伴随着NAFLD的发展过程;氧化应激主要由大量的ROS诱导发生。氧化应激导致脂质过氧化物升高和抗氧化系统损伤,从而进一步加重肝细胞的损伤。在本研究中肝组织ROS水平最高时脂质过氧化物MDA水平明显上升而SOD水平明显降低,这表明CYP4A ω-羟基化作用产生的ROS能引起肝细胞损伤,从而促进NAFLD的发展。CYP4A ω-羟基化脂肪酸产生ROS的特异性将通过体外诱导CYP4A表达实验来进一步探索。
综上,高脂乳剂灌胃诱导鼠肝组织CYP4A表达,并随着脂质堆积的增加而增加。CYP4A ω-羟基化脂肪酸促使ROS的产生引起氧化应激和脂质过氧化而导致肝细胞损伤,因此CYP4A在NAFLD的发展中扮演着重要的角色。据此绘制CYP4A参与NAFLD发展的机制图(图6)。
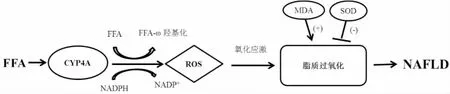
图6 CYP4A ω-羟基化脂肪酸产生的ROS损伤肝细胞的机制图
