基于多功能超声造影剂的肿瘤分子成像和可视化联合精准治疗的专家共识
2019-12-06山东省中西医结合学会超声专业委员会
山东省中西医结合学会超声专业委员会
超声造影技术是现代超声领域研究的热点之一,其具有无电离辐射、低成本、可实时成像等优势,还能够在超声辐照下产生声孔效应,使更多治疗药物进入细胞内发挥作用[1-2]。超声靶向微泡破坏技术已被用于溶栓治栓、药物递送、基因治疗、肿瘤耐药逆转等临床领域[3-6]。随着超声分子成像技术和生物纳米技术的迅猛发展,纳米级超声造影剂成为近年来分子影像学领域的研究热点之一,其可有效克服传统肿瘤药物治疗靶向性差、全身毒副作用大等缺点,具有很强的穿透力,能穿过肿瘤组织血管壁间隙,其开发和应用还有利于进一步发展靶向性、高效性、小型化且具有辅助治疗作用的新型超声造影剂。纳米级超声造影剂是超声分子影像学发展的重要方向,也是肿瘤靶向性、可视化精准治疗及实现诊疗一体化的新方向[7]。近年来,虽然纳米超声造影剂作为新型靶向给药系统及实现诊疗一体化的重要意义已取得共识,但如何制备具有更高生物安全性及稳定性的纳米超声造影剂等问题,亟待进一步规范,为此制定了多功能纳米超声造影剂用于肿瘤分子成像和诊疗一体化的专家共识,以规范多功能纳米超声造影剂的制备、安全性评价及诊疗一体化应用等问题。
1 新型纳米级超声造影剂的制备及表征
为了降低由于制作材料毒性带来的健康损害和安全隐患,用于组装超声纳米泡(nanobubbles,NBs)材料的生物相容性、可降解性和安全性至关重要[8-10]。多糖壳聚糖由于其天然来源、生物降解性、生物相容性、极低的免疫原性、抗菌活性及实用性而备受关注[11-13]。本共识中设计的NBs 以天然壳聚糖材料为外壳,加入卵磷脂和棕榈酸2 种生物安全性高的天然物质作为辅助材料[14-16]。
1.1 负载阿霉素的壳聚糖NBs 的制备 根据先前描述的方法[17-19],以中等分子量壳聚糖(100~300 kD)作为壳材料,全氟丙烷用作NBs 的核心,制备了新型负载阿霉素(doxorubicin,DOX)的壳聚糖NBs。先将适量DOX 溶解在超纯水中,用涡旋混合器混合后,加入到壳聚糖水溶液中。将DOX-壳聚糖溶液放置在65 ℃温箱内温育1 h。另将棕榈酸溶于超纯水中,再把含有Epikuron 200 的乙醇溶液加入棕榈酸溶液里,加入适量超纯水,使用涡旋混合器将棕榈酸-Epikuron 200 系统均化。随后,将棕榈酸-Epikuron 200 溶液分装于数个1.5 mL eppendorf(EP)管中,用10 mL 注射器把EP 管中的空气替换为全氟丙烷。每个密封EP 管在银汞调和器中振荡120 s。在冰浴状态下,将EP 管中所有液体依次倒入盛有DOX-壳聚糖溶液的离心管中,轻轻上下晃动离心管混合均匀。最后,将制成的NBs 在4 ℃下温育30 min。再在玻璃棒轻轻搅拌下将微量Pluronic F68(0.01%,w/w)水溶液作为稳定剂加入上述混合液中。以超滤离心方式进行透析提纯NBs,除去溶液中残留的游离DOX 和其他材料。
1.2 DOX-NBs 的物理化学表征 制备的NBs 显示出球形形态,在倒置显微镜下,呈离散且完整的球形轮廓(图1a),这与荧光显微镜成像一致(图1b)。DOX-NBs 溶液的代表性透射电子显微镜图像见图1c。NBs 的物理性质由粒度和zeta 电位分析仪确定。DOX-NB 的平均直径为641 nm,PI 0.256。DOX-NBs的zeta 电位为(67.12±2.1)mV,足以使它们相互排斥,有助于预防NBs 聚集以维持其长期稳定性。

图1 DOX-NBs 的物理表征 图1a 光学显微镜下观察到的NBs(放大倍数1 000 倍)图1b DOX-NBs 的荧光显微镜图像 图1c DOX-NBs的透射电子显微镜图像
1.3 DOX-NBs 的稳定性和载药效率 DOX-NBs 在室温4 ℃放置24 h 及48 h,粒径大小无显著变化。在25 ℃储存6 h 后,磷酸盐缓冲液和人血清中DOX-NBs的粒径均略增大。使用UV 分光光度计(UV-2450,SHIMADZU)测量DOX 的荧光强度,测得DOX-NBs的最终DOX 负载量为64.12 mg/g DOX-NBs,相当于药物包封效率为54.18%。
1.4 DOX-NBs 的超声成像能力及稳定性检测 DOXNBs 的超声增强显像效果和稳定性用超声诊断仪GE Logiq E9 进行体外验证(图2),结果显示,DOXNBs 获得了良好的超声增强效果;NBs 悬浮液中的超声衰减过程相对较慢,表明DOX-NBs 的超声信号可足够稳定以用于成像和对比度增强。
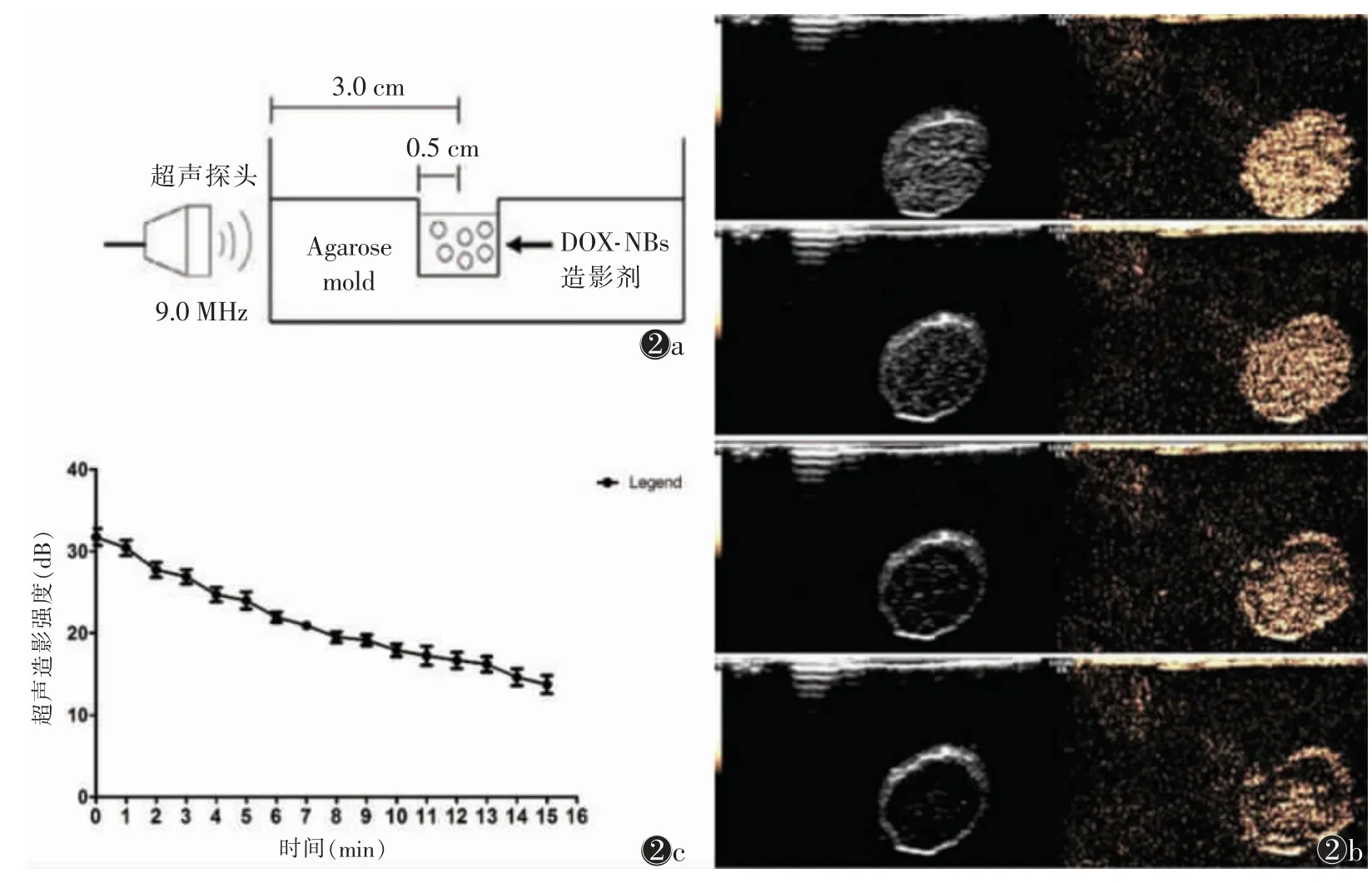
图2 体外验证 图2a 体外实验装置图2b体外实验装置分别在0、5、10 和15 min 时DOX-NBs 的超声增强显像 图2c 15 min 内DOX-NBs 的TIC
2 新型纳米级超声造影剂的体内、外安全性评价
2.1 NBs 的细胞毒性测定 使用70%占空比和100 Hz脉冲率的低强度超声治疗仪以1 MHz 的固定频率对加入不同浓度NBs 的乳腺癌MCF-7 细胞行超声刺激(表1)[20]。使用八肽胆囊收缩素(CCK-8)试剂盒(Sigma-Aldrich,USA)测试空壳聚糖NBs 的生物安全性。NBs 在一定的超声强度下几乎不影响细胞活力。当使用0.5 W/cm2的超声强度照射30 s 后,在含有10%NBs 悬浮液的培养基中有99.53%的MCF-7 细胞存活;在含有30%NBs 悬浮液的培养基中超过80%的细胞存活(图3)。可见,MCF-7 细胞活力的降低与NBs 的浓度具有剂量依赖性关系。此外,超声强度和辐照时间也是影响MCF-7 细胞活力的因素。为保证超声造影的生物安全性,超声强度0.5 W/cm2和辐照时间30、60 s 被用于细胞摄取实验。

图3 不同浓度的空白NBs 和超声强度在MCF-7 细胞中的体外细胞毒性
2.2 NBs 的体内安全性评价 选取健康清洁级小鼠按照给药方式和剂量的不同,随机分为a~f 共6组,每组10 只(表2)。参照文献[21-22],口服时按总剂量2 100 mg/kg 体质量、给药容积0.8 mL/只,分2 次进行,为当日(8 时、16 时);腹腔注射时,一次性注入总剂量240 mg/kg 体质量,给药容积0.5 mL/只;静脉注射时,小鼠尾静脉一次性注入总剂量80 mg/kg 体质量,给药容积0.5 mL/只。阴性对照组给予等量的灭菌蒸馏水作为对照。

表2 实验小鼠的分组
给药后观察小鼠的一般情况,饲养14 d 后检测小鼠的血生化指标(包括尿素氮、谷丙转氨酶、谷草转氨酶、总蛋白、白蛋白、三酰甘油、胆固醇、血糖等)、各脏器的病理学变化(包括心脏、肝脏、脾脏、肾脏、肺脏等)。结果显示,给药后各组小鼠均未出现死亡、体质量增长情况(表3),组间比较差异均无统计学意义(均P>0.05)。静脉注射组给药当日部分小鼠出现短暂的站立不稳、食欲下降和饮水量增多情况。其余各组及对照组小鼠均未出现异常。各组小鼠血生化指标均在正常范围;大体标本组织颜色、形态均未见显著异常,病理切片各脏器均未见异常改变(均P>0.05)。

表3 各组小鼠体质量增长情况
3 新型纳米级超声造影剂的靶向递药能力
3.1 DOX-NBs 杀伤能力的体外研究 将MCF-7 细胞分6 组:DOX 组;DOX-NBs 组;DOX+超声1(0.5 W/cm2,30 s)组;DOX-NBs+超声1 组;DOX+超 声2(0.5 W/cm2,60 s)组;DOX-NBs+超声2 组。
3.1.1 体外细胞内药物摄取 使用流式细胞技术测定DOX 的细胞内摄取[23]。分别给予刺激后,离心收集细胞,重悬后放置于FACS Calibur 流式细胞仪上分析。在无超声辐照状态下,用DOX-NBs 孵育的MCF-7 细胞的平均荧光强度远低于用游离DOX 孵育细胞的自发荧光强度(图4)。说明在非超声辐照部位,NBs 能够减少细胞对其负载药物的摄取,可通过降低化疗药物的摄取及其诱导的细胞损伤保护机体循环中的正常组织细胞。在超声辐照下,DOX-NBs孵育的MCF-7 细胞摄取DOX 显著增加,说明超声辐照DOX-NBs 能够显著提高MCF-7 细胞对DOX 的摄取率。
3.1.2 DOX-NBs 和超声辐射介导的体外DOX 递送及杀伤能力的增强 用CCK-8 细胞毒性试验定量评估DOX-NBs 及游离DOX 对MCF-7 细胞的杀伤能力[23],结果显示,未经超声辐照时,DOX-NBs 组细胞存活率(21.0%±2.2%)明显高于游离DOX 组(6.4%±0.7%)(P<0.01),说明以NBs 作为药物传递载体,能够显著改善DOX 在机体循环中诱导的非病变部位(无辐照部位)的组织细胞损伤。此外,与单独使用DOXNBs 治疗的细胞(21.0%±2.2%)相比,DOX-NBs+超声组(超声1 组、超声2 组)的细胞存活率(3.1%±0.8%,2.2%±0.9%)显著降低(P<0.01)。同时,DOXNBs+超声组(超声1 组、超声2 组)的细胞存活率也小于游离DOX 组(6.4%±0.7%)和游离DOX+超声组(超声1 组、超声2 组)(4.1%±0.8%,3.8%±0.6%)(图5)。结果表明DOX-NBs+超声显著增强了DOX在MCF-7 细胞中的细胞毒性作用。
3.2 DOX-NBs 杀伤能力的体内研究 将小鼠分为对照组、DOX 组、DOX+超声组、DOX-NBs+超声组、2×DOX-NBs+超声组,每组7 只,分别在小鼠种瘤后第7 天、第9 天、第11 天进行DOX-NBs 及等浓度的DOX 水溶液局部注射治疗,治疗剂量为0.1 mL NBs 或相应浓度的DOX 水溶液,第13 天处死各组小鼠,取出肿瘤组织。体质量记录为种瘤当天测量和治疗后处死前测量,比较差值。瘤体变化为种瘤后治疗时的大小与处死当天的瘤体大小差异。各组间体质量和瘤体积变化差异均有统计学意义(均P<0.05)。两两比较显示:DOX 组、DOX+超声组、DOX-NBs+超声组体质量变化均大于对照组(均P<0.05),DOXNBs+超声组体质量变化大于2×DOX-NBs+超声组(P<0.05),其他组间体质量变化差异无统计学意义(均P>0.05)。DOX 组、DOX+超声组、DOX-NBs+超声组、2×DOX-NBs+超声组瘤体积变化明显小于对照组(均P<0.05),DOX-NBs+超声组、2×DOX-NBs+超声组瘤体积变化小于DOX 组(均P<0.05),DOXNBs+超声组瘤体积小于DOX+超声组(P<0.05),其他组间瘤体积变化差异均无统计学意义(均P>0.05)(表4)。

图4 各组MCF-7 细胞摄取DOX 的荧光强度(超声1 组:超声强度0.5 W/cm2,辐照时间30 s,超声2 组:超声强度0.5 W/cm2、辐照时间60 s)图5 不同组中MCF-7 细胞活力的比较

表4 各组间体质量和瘤体积变化的比较
综上所述,本共识制备的负载DOX 的生物相容性壳聚糖NBs,其具有良好的超声增强显像能力和极高的生物安全性,并能有效包载DOX,实现靶向递送及增强其肿瘤杀伤能力。体内外研究结果均证明,DOX-NBs 是一种创新的药物递送系统,可用于获得有效的超声辅助DOX 递送,为实现肿瘤诊疗一体化提供了新思路,为规范多功能纳米超声造影剂的制备、安全性评价及诊疗一体化应用等奠定基础。
