LC3、P62在口腔黏膜下纤维性变组织固有层中的表达研究
2019-12-05戴卓吴颖芳朱冰玉喻晖乔吴凌云蒋琪
戴卓 吴颖芳 朱冰玉 喻晖乔 吴凌云 蒋琪
口腔黏膜下纤维性变(oral submucous fibrosis,OSF)是一种以黏膜下组织炎症和进行性纤维化为特征的口腔潜在恶性疾病[1],其病理表现主要为胶原堆积和微血管改变[2]。现有研究认为OSF的发生主要与咀嚼槟榔有关,其发病机理尚不明确。
细胞自噬(autophagy)是细胞将细胞器和细胞质形成膜结构与溶酶体融合进行降解的代谢过程。自噬被认为与人体控制稳态、炎症和免疫的生理过程密切相关[3]。有研究表明自噬可以通过抑制口腔鳞癌细胞的增殖和迁移发挥抗癌效应[4],通过促进血管生成对肥胖及其并发症的发生起推动作用[5],参与调控动脉粥样硬化[6]、腹主动脉瘤[7]、肺动脉高压[8]等血管疾病的发生发展。自噬是否通过调节血管功能参与OSF的发生发展目前尚无相关研究。本实验通过检测正常口腔颊黏膜组织及OSF早、中、晚期患者颊黏膜组织固有层中自噬相关微管蛋白1轻链3(microtubuleassociated protein 1 light chain 3,LC-3)和P62(sequestosome1/SQSTM1)的表达,分析自噬对OSF发生、发展的作用,为OSF的发病机理及临床治疗提供新思路。
1 材料与方法
1.1 主要仪器及试剂
石蜡(上海国药生物);中性树胶(Sigma,美国);苏木素、PBS(7.2-7.6)、枸橼酸盐缓冲液、二步法试剂盒、DAB试剂盒(中杉金桥);兔抗人LC-3抗体(CST,美国);兔抗人P62抗体、抗-兔、兔-IgG抗体-HRP多聚体(Proteintech Group公司,美国)。
1.2 实验步骤
1.2.1 收集标本 选取就诊于中南大学湘雅医院口腔医学中心,经临床和病理确诊的早、中、晚期OSF患者的口腔颊黏膜组织各30例作为实验组,同时收集正常口腔颊黏膜组织30例作为对照组。所有患者均签署知情同意书,研究方案经中南大学湘雅医院伦理委员会审批。患者均为男性,年龄23~66岁,平均年龄(45.43±13.03)岁,其中OSF早期组平均年龄(43.27±12.40)岁,OSF中期组平均年龄(47.73±12.88)岁,OSF晚期组平均年龄(45.30±13.41)岁,正常对照组平均年龄(42.47±13.31),各组平均年龄无统计学差异(P>0.05)。
1.2.2 纳入标准和排除标准 纳入标准:收集2016-08~2018-06中南大学湘雅医院病理科确诊为OSF并明确分期的病例,标本取自颊黏膜病变明显处,大小约1 cm×1 cm。排除标准:OSF合并有其他口腔黏膜病变患者;病变部位存在感染;曾经接受过局部注射或全身治疗;患者同时有其他全身疾病或遗传性疾病;标本不符合临床和病理诊断标准。正常组织:收集颌面部外伤或整形手术患者口腔颊黏膜组织。患者无咀嚼槟榔、烟酒嗜好,无口腔黏膜病和其他全身疾病(正常组织经病理证实)。
1.2.3 组织处理 组织标本以10%福尔马林液固定,常规石蜡包埋,4μm厚连续切片备用。
1.2.4 免疫组化染色 切片脱蜡,常规HE染色,二步法免疫组化染色采用微波处理修复抗原,已知阳性片做阳性对照,PBS液体代替一抗作空白对照。
1.2.5 结果判断 阳性染色为黄色或棕黄色染色。利用电脑采像并使用Image-Pro-Plus(IPP)软件进行图像分析,每张切片随机选取5个视野(400倍)及定标的空白区,计算视野下阳性表达部位的累积光密度值(integrating optical density,IOD)。
1.3 统计学分析
采用SPSS 16.0软件进行统计分析,计量资料统计结果以表示。计量资料采用单因素方差分析(one-way ANOVA),采用Spearman相关分析自噬关键蛋白LC3、P62间的相关性。以α=0.05作为检验水准,P<0.05有统计学意义。
2 结 果
2.1 正常及OSF颊黏膜组织HE染色结果
正常口腔黏膜组织上皮无萎缩和增生情况,上皮钉突形状规则,清晰可见,胶原纤维较少,排列有序,固有层血管丰富,炎症细胞数量极少。OSF患者颊黏膜组织(图1)上皮萎缩或异常增生,固有层胶原纤维玻璃样变,血管狭窄、闭塞,有大量炎症细胞浸润。且随着病变的发展,固有层血管逐渐减少直至消失。
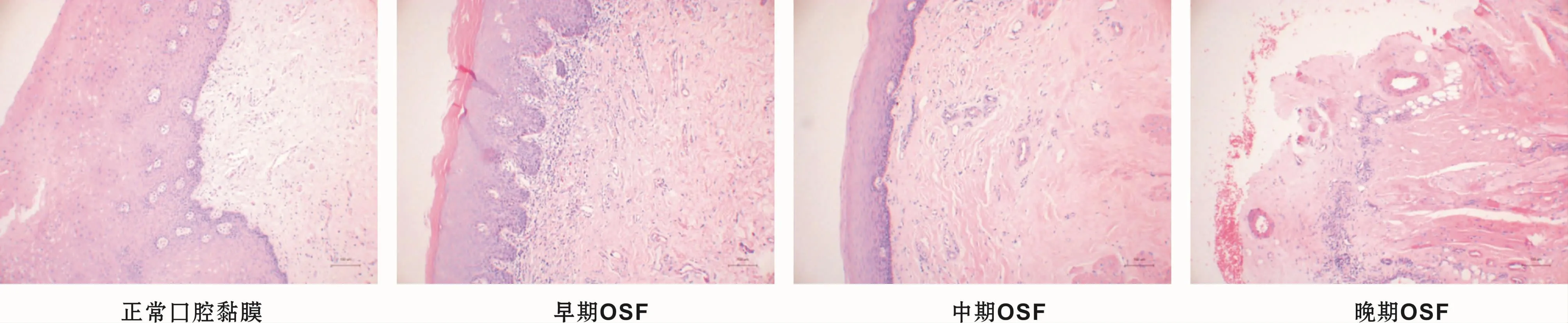
图1 正常及OSF颊黏膜组织HE染色 (×400)Fig 1 HE staining of normal and OSF buccal mucosa (×400)
2.2 免疫组化结果
LC3蛋白在黏膜组织固有层中的阳性表达为内皮细胞胞核、胞质内棕黄色染色(图2),LC3蛋白在正常口腔黏膜组织固有层内皮细胞中少量表达,在OSF病变组织固有层内皮细胞中表达明显,OSF各组表达均高于正常组,差异有统计学意义(P<0.05)。在OSF早、中、晚各期组织中,中、晚期组较早期组LC3表达上调,晚期组比中期组下调,各组间表达差异有统计学意义(P<0.05)(表1)。
P62蛋白在黏膜组织固有层中的阳性表达为内皮细胞胞质、包膜内棕黄色染色(图2),P62蛋白在OSF早、中期颊黏膜组织固有层内皮细胞中表达较少,在正常及OSF晚期颊黏膜组织固有层内皮细胞中表达明显。早、中期组较正常组P62表达下调,晚期组较正常组上调,差异有统计学意义(P<0.05),且OSF各组间差异有统计学意义(P<0.05)(表1)。

图2 LC3和P62蛋白在口腔黏膜固有层中的表达 (SP,×400)Fig 2 LC3 and P62 protein expression in the lamina propria of oral mucosa (SP,×400)
表1 LC3和P62在口腔黏膜组织固有层中的表达(n=30,)Tab 1 Expression of LC3 and P62 in the lamina propria of oral mucosa (n=30,)
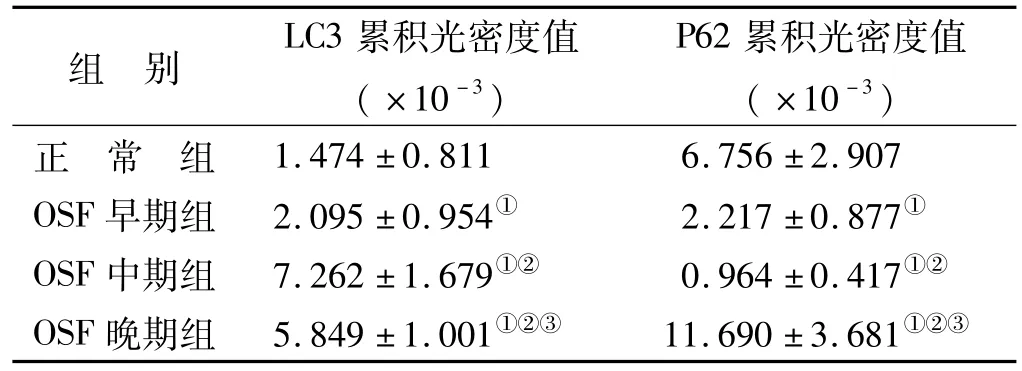
表1 LC3和P62在口腔黏膜组织固有层中的表达(n=30,)Tab 1 Expression of LC3 and P62 in the lamina propria of oral mucosa (n=30,)
注:①与正常组比较,P<0.05;②与早期组相比,P<0.05;③与中期组相比,P<0.05
组 别 LC3累积光密度值(×10-3)P62累积光密度值(×10-3)1.474±0.811 6.756±2.907 OSF早期组 2.095±0.954① 2.217±0.877①OSF中期组 7.262±1.679①② 0.964±0.417①②OSF晚期组 5.849±1.001①②③ 11.690±3.681正常组①②③
2.3 口腔黏膜固有层中LC3、P62蛋白表达的相关性
经Spearman相关性分析LC3蛋白与P62蛋白表达呈负相关(r=-0.172,P<0.05)。
3 讨 论
自噬广泛存在于酵母及哺乳动物真核细胞中,是细胞程序性死亡的一种形式。根据与溶酶体结合的传输机制不同细胞自噬分3种类型:巨自噬、微自噬、分子伴侣介导的自噬[9]。本实验涉及自噬类型是巨自噬,在哺乳动物和植物细胞中均存在,其过程表现为细胞内质网或高尔基体首先形成双层膜性结构,包裹细胞内蛋白质及部分细胞器形成自噬泡,随后沿微管蛋白轨道运输至溶酶体并与之结合,形成自噬溶酶体,其中的内容物随即被降解并循环到细胞质中[9]。自噬是一个复杂的动态过程,LC3和P62是其中2个重要的蛋白分子,自噬体的形成通常由LC3B(herein LC3)证实[10]。在自噬体形成过程中,LC3B被ATG4裂解产生LC3I,LC3I通过介导ATG12-ATG5复合物与磷脂酰乙醇胺结合而转化为脂质化形式LC3Ⅱ[11];LC3Ⅱ反应了自噬体和自噬溶酶体的水平,并行使靶向功能使自噬体与溶酶体结合,最终在自噬溶酶体消化完内容物后,LC3Ⅱ消失[12]。因此,在自噬过程中,LC3通常被作为判断自噬激活的一个指标,随着自噬过程的推进,表达量通常表现为上调。P62是由c-myc基因外显子2和3共同编码的磷酸化蛋白。P62蛋白在LC3和泛素化底物之间起连接作用[13]。P62可以将LC3和相应的泛素化底物整合到完整的自噬体中,并在自噬溶酶体中降解,因此P62成为判断自噬降解的一个指标,随着自噬过程的推进,P62表达量通常表现为下调。
口腔黏膜下纤维性变的病理变化主要为上皮组织萎缩,黏膜固有层及黏膜下层胶原纤维的堆积和玻璃样变,血管通透性增加,小血管闭塞、减少。在口腔黏膜下纤维性变的发生发展过程中,微血管病变是其中一个重要的病理变化。现有研究表明,OSF的发生发展和血管形成密切相关。吴颖芳等[14]的研究表明,在一定范围内,槟榔碱可以呈浓度依赖性抑制内皮细胞的增殖,这可能是OSF发生的原因之一。自噬对人体细胞的调节功能十分复杂,在受环境条件影响较少时,细胞自噬抑制细胞凋亡,然而,当自噬使细胞内蛋白和细胞器过量消耗,致使细胞无法继续生存下去时,细胞自噬即会转化成凋亡,其对血管生成的作用同样具有两面性[15]。自噬在口腔黏膜下纤维性变组织固有层血管病变中发挥的作用尚未见相关研究报道。
本实验对正常颊黏膜及OSF早、中、晚期颊黏膜组织固有层中的LC3和P62蛋白分别进行检测,结果显示LC3主要表达于内皮细胞的胞核、胞质内,P62主要表达于内皮细胞的胞质、包膜内,正常组和OSF组中均可见表达。在OSF早期组中,LC3表达上调,P62表达下调,可能在OSF发病早期,血管内皮细胞对外界刺激通过激活自噬这种适应性反应自我调节,为细胞提供氨基酸、核苷酸等营养物质,加强细胞的存活能力。自噬在OSF早期很可能对内皮细胞起保护作用,促进血管新生,从而抵抗纤维化的发展。在OSF中期组中,LC3表达最高,P62表达最低,提示该阶段自噬活性强,结合临床,OSF中期患者通常表现为口腔黏膜固有层血管减少,颜色呈片状灰白色改变,质地变硬,双翼下颌韧带及软腭可扪及纤维条索,推测这可能是因为细胞自噬过度消耗胞内蛋白和细胞器,引起内皮细胞功能障碍,抑制血管新生,加速了纤维化的发展。在OSF晚期组中,LC3表达下调,P62表达上调,提示在该阶段自噬活性减弱,且自噬降解功能受阻,导致P62在体内蓄积。其原因可能是因为外界刺激进一步加强,致使内皮细胞自噬转化为凋亡,凋亡的内皮细胞具有促凝血作用,可以增强血小板的黏附性,促进血栓的形成,进一步加重局部的缺血缺氧情况,加重纤维化的发展,甚至可能导致OSF的恶性转变。
综上所述,在OSF早期,自噬可能表现为对内皮细胞的保护作用,改善局部的微循环,从而抵抗纤维化的发展;在OSF中期,自噬异常活跃,引起内皮细胞功能障碍,促进纤维化的发展;在OSF晚期,自噬被抑制,纤维化进一步加重。但自噬在OSF组织中对内皮细胞及血管形成的作用仍需要进一步的实验验证。本实验为OSF的发病机理研究提供了新的思路。
