牙周炎伴口腔扁平苔藓中IL-17激活NF-kB调控hPDLFs促进MMPs的分泌
2019-12-05程凤峡孙喜龙杨玉鹏许彦枝
程凤峡 孙喜龙 杨玉鹏 许彦枝
牙周炎与口腔扁平苔藓同为口腔内的高发疾病,具有相互作用、相互影响以及伴随发生的特征[1-2]。相关炎症细胞因子在牙周炎伴口腔扁平苔藓中发挥重要作用[3-6],IL-17与组织的炎性损伤及自身免疫性疾病的发生有密切关系[7-8]。NF-kB可调节免疫和炎症反应中大量基因的表达。研究发现,NF-kB与MMPs关系密切,在MMPs基因启动子近端调控区有特异性NF-kB结合位点,可通过激活NF-kB信号通路促进MMPs升高。牙龈发生炎症时,龈沟液及唾液中MMPs的活性增加且其酶活性及产物与牙龈炎症严重程度呈正相关。因此,MMP通路是牙周组织破坏的关键通路之一。本研究探讨IL-17通过激活NF-kB信号通路促进人牙周膜成纤维细胞(hPDLFs)中MMPs的分泌从而影响牙周炎伴口腔扁平苔藓的病理发生及进程。
1 材料与方法
1.1 研究对象
选取自2016-02~2018-05就诊的43例(男性14例,女性29例)牙周炎伴口腔扁平苔藓患者为研究组,年龄范围21~67岁,平均年龄(44.1±21.3)岁。选取本院同期体检的健康志愿者43例为对照组,包括男性18例,女性25例,年龄范围22~65岁,中位年龄(46.2±18.6)岁,2组患者基线资料比较均无统计学差异(P>0.05)。
纳入标准:①口腔扁平苔藓患者均需符合《口腔黏膜病学》的诊断标准;②牙周炎患者均需符合国际牙周病新分类慢性牙周炎诊断标准;③入组患者均为口腔扁平苔藓和牙周炎两种疾病伴随发生者;④无全身系统性疾病及慢性疾病;⑤近3个月内未接受过相关药物治疗者。排除标准:①不能确诊为口腔扁平苔藓或牙周炎的患者②单一疾病患者;③哺乳或妊娠期女性;④接受过抗生素等药物治疗者;⑤患有慢性疾病或全身系统性疾病者。
1.2 外周血标本采集
根据入选标准和排除标准筛选合格的入组患者,并抽取纳入研究的患者及健康志愿者清晨空腹时的外周静脉血,采用一次性血清分离胶管,抽取外周静脉血约3 ml;静置10 min,待血清析出后,使用台式离心机以1 000 r/min离心10 min,抽取上层血清,分装后,保存至-80℃冰箱,备用。
1.3 唾液标本采集
于清晨采用棉签法采集受试者的唾液标本,在唾液采集前2 h受试者需空腹,不能喝水、喝酒、喝饮料、进食、抽烟、剧烈运动及情绪剧烈波动等。采样时受试者采取坐位、头稍前倾体位,采用棉签蘸柠檬酸刺激口腔唾液分泌,1.5 min后吐出唾液,用10 ml无RNA酶离心管收集唾液标本,立即于4℃,3 000 r/min,15 min离心取上层液体,将收集好的唾液上清冻存于-80℃冰箱,待检测。
1.4 常规牙周检查
详细记录所有研究对象牙周临床指标:牙周探诊深度(PD)、附着丧失(AL)、菌斑指数(PLI)、牙龈指数(GI)。根据探诊深度、牙龈指数、附着丧失、X线片显示牙槽骨吸收程度来衡量牙周炎的程度。
1.5 hPDLFs细胞培养
取因正畸完整拔除的双尖牙,常规组织块法原代培养hPDLFs,并传代。待第3代细胞贴壁后,将细胞培养基更换为矿化诱导培养基(含去酚红的DMEM、10%热非动化胎牛血清、10-8mol地塞米松、10 mmolβ-甘油磷酸钠、50μg/ml抗坏血酸)。传代至第4代时,以1.5×104/cm2的密度接种于6孔板中,待细胞融合度达90%后,更换不含血清的矿化诱导培养基,继续培养12 h后,收集细胞,准备实验使用。
1.6 ELISA检测
采用美国eBioscience公司的Human IL-17 Quantikine ELISA Kit,Human MMP-1 Quantikine ELISA Kit,MMP-2 Quantikine ELISA Kit,MMP-3 Quantikine ELISA Kit,MMP-9 Quantikine ELISA Kit分别检测标本中IL-17的含量,hPDLFs中MMP-1,MMP-2,MMP-3,MMP-9的含量,实验操作严格遵从试剂盒说明书。
1.7 Western Blot检测
首先从转染48 h后的细胞中提取总蛋白,采用BCA蛋白浓度测定试剂盒测定蛋白浓度,然后在SDS-聚丙烯酰胺凝胶小孔内添加50μg经过变性处理后的蛋白质,再进行浓缩胶层80 V恒压一段时间,当样品在分离胶层压成一条线时电压调至120 V,继续电泳,电泳后于冰上0.25 mA转膜2 h,丽春红染色10 min观察转移效果,满意后,TBST缓冲液洗膜后在5%脱脂奶粉与摇床上孵育2 h;加入一抗(1∶500兔抗人p21多抗,1∶5 000兔抗人GAPDH单抗)置于4℃封闭过夜;洗膜后加入羊抗兔IgG/HRP二抗(1∶2 000),室温孵育1 h,采用增强化学发光法(ECL)显影得到蛋白印记条带,用Tanon软件分析条带灰度值,相对定量结果以实验条带灰度值/β-actin条带光密度值表示,内参照为β-actin。
1.8 qRT-PCR检测
应用美国ABI StepOne Plus实时定量PCR仪,严格按照日本TaKaRa公司SYBR Premix Ex TaqPCR反应试剂盒的操作说明进行MMP-1,MMP-2,MMP-3,MMP-9,TIMP-1和TIMP-2的RT-PCR检测。
1.9 CCK8检测
采用IL-17(10 ng/ml)刺激hPDLFs,设为IL-17处理组;将未经任何处理的hPDLFs设为NC对照组。参照CCK8试剂盒(Invitrogen公司,美国)说明书步骤进行,各组转染24 h后,接种于96孔培养板,每孔加10μl CCK8,37℃培养2 h,酶标仪上480 nm波长处测定A值,表示细胞增殖能力。
1.10 观察指标
①对照组、研究组患者血清及龈沟液中IL-17蛋白表达水平;②检测并记录研究组患者牙周指标:牙周探诊深度(PD)、附着丧失(AL)、菌斑指数(PLI)、牙龈指数(GI)。将研究组患者龈沟液中IL-17表达水平与各牙周指标进行相关性分析;③比较IL-17处理组、NC对照组hPDLFs的CKK8检测结果,即480 nm波长处的A值;④qRT-PCR法检测并比较IL-17处理组、NC对照组hPDLFs中MMP1、MMP2、MMP3、MMP9、TIMP-1、TIMP-2的mRNA表达水平;⑤采用ELISA法检测并比较IL-17处理组、NC对照组hPDLFs中MMP1、MMP2、MMP3、MMP9的表达水平;⑥预先使用NF-kB的抑制剂PDTC去预处理hPDLFs,然后采用IL-17(10 ng/ml)分别刺激hPDLFs和PDTC预处理的hPDLFs(IL-17+PDTC处理组),12 h后通过Western blot及ELISA检测并比较NC对照组、IL-17处理组、IL-17+PDTC处理组的P65蛋白磷酸化、MMP1、MMP2、MMP3、MMP9的表达水平。
1.11 统计学分析
2 结 果
2.1 血清中IL-17蛋白表达水平
ELISA检测结果示研究组患者血清中IL-17蛋白表达水平为(22.56±2.33)ng/ml,明显高于对照组血清中IL-17蛋白表达水平(5.50±0.66)ng/ml,差异有统计学意义(t=46.195,P=0.000)。
2.2 龈沟液中IL-17的表达水平与临床牙周指标的相关性
统计结果示研究组PD、AL、PLI、GI均明显高于对照组,差异有统计学意义(P<0.05,表1)。进一步进行相关性分析结果显示,研究组龈沟液中IL-17的表达水平与各牙周临床指标均呈显著正相关(表2)。
表1 2组牙周临床指标比较 ()Tab 1 Comparison of periodontal clinical indicators between the 2 groups ()
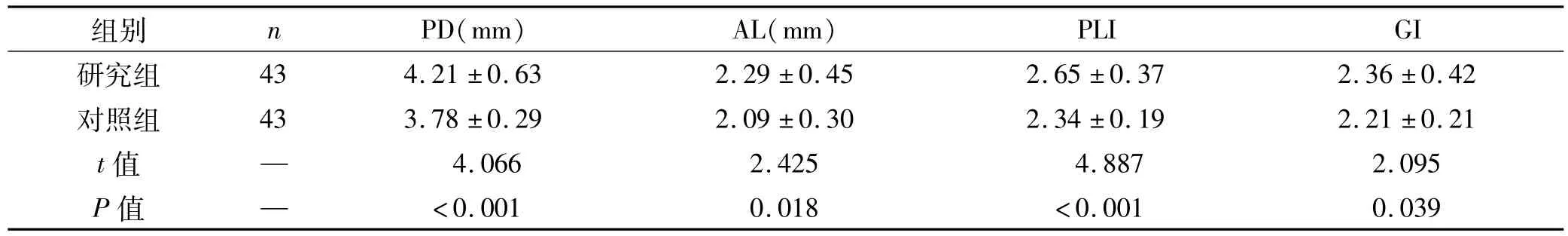
表1 2组牙周临床指标比较 ()Tab 1 Comparison of periodontal clinical indicators between the 2 groups ()
PLI GI研究组组别 n PD(mm) AL(mm)43 4.21±0.63 2.29±0.45 2.65±0.37 2.36±0.42对照组 43 3.78±0.29 2.09±0.30 2.34±0.19 2.21±0.21 t值 — 4.066 2.425 4.887 2.095 P值 — <0.001 0.018 <0.001 0.039
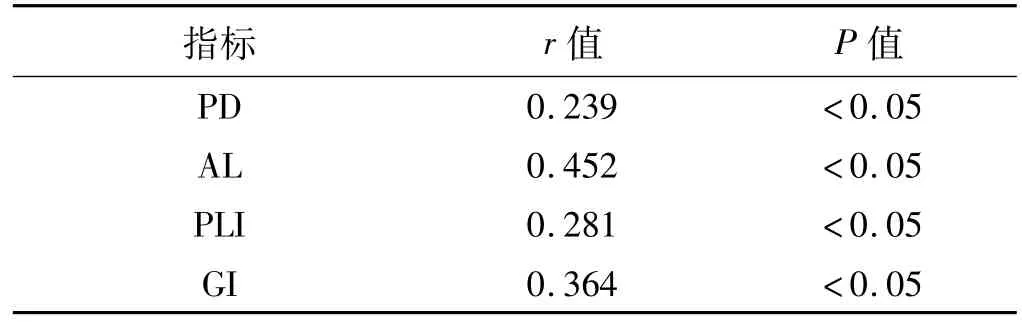
表2 龈沟液中IL-17的表达水平与临床牙周指标的相关性Tab 2 Correlation between the level of IL-17 in gingival sulcus fluid and clinical indicators
2.3 IL-17与hPDLFs增殖能力的相关性
细胞培养24 h后,在480 nm波长处,IL-17处理组A值为(1.876±0.581),NC对照组为(1.693±0.554),组间比较,t=1.495,P=0.139。
2.4 IL-17与hPDLFs中MMPs的mRNA表达水平的相关性
IL-17处理组中MMP1、MMP2、MMP3和MMP9的mRNA表达水平高于NC对照组(P<0.01)(表3)。
表3 2组MMPs的mRNA表达水平比较 ()Tab 3 mRNA expression levels of MMPs in the 2 groups ()
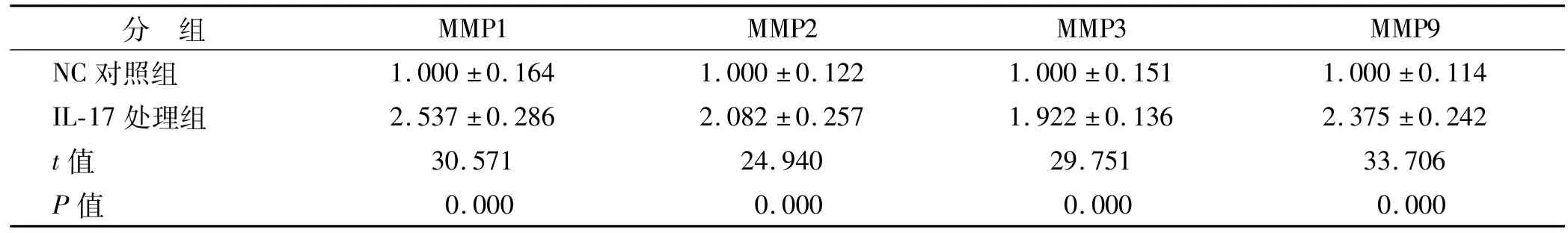
表3 2组MMPs的mRNA表达水平比较 ()Tab 3 mRNA expression levels of MMPs in the 2 groups ()
MMP1 MMP2 MMP3 MMP9 NC对照组 1.000±0.164 1.000±0.122 1.000±0.151 1.000±分 组0.114 IL-17处理组 2.537±0.286 2.082±0.257 1.922±0.136 2.375±0.242 t值 30.571 24.940 29.751 33.706 P值0.000 0.000 0.000 0.000
2.5 hPDLFs中TIMP-1和TIMP-2的mRNA表达水平
NC对照组与IL-17处理组的hPDLFs中,TIMP-1、TIMP-2 mRNA表达水平无显著差异(表4)。
2.6 hPDLFs中MMPs蛋白表达水平
IL-17处理组的hPDLFs中,MMPs蛋白的表达水平均明显高于NC对照组(P<0.01)(表5)。
2.7 IL-17通过激活NF-kB调节MMPs的表达
ELISA及Western blot检测发现,与NC对照组比较,IL-17处理组的NF-kB P65蛋白磷酸化的表达水平、MMP1、MMP2、MMP3和MMP9蛋白表达水平均显著高于NC对照组,差异有统计学意义(P<0.01)。IL-17+PDTC处理组的NF-kB P65蛋白磷酸化的表达水平、MMP1、MMP2、MMP3和MMP9蛋白的表达水平均显著低于IL-17处理组,差异有统计学意义(P<0.01)(图1)。
表4 2组hPDLFs中TIMP-1、TIMP-2 mRNA的表达()Tab 4 mRNA expression levels of TIMP-1 and TIMP-2 in hPDLFs of the 2 groups ()
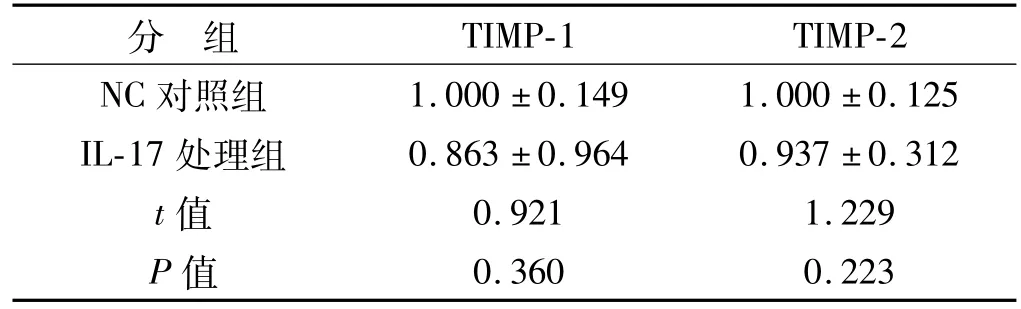
表4 2组hPDLFs中TIMP-1、TIMP-2 mRNA的表达()Tab 4 mRNA expression levels of TIMP-1 and TIMP-2 in hPDLFs of the 2 groups ()
分 组1.000±0.149 1.000±0.125 IL-17处理组 0.863±0.964 0.937±0.312 t值 0.921 1.229 P值TIMP-1 TIMP-2 NC对照组0.360 0.223
表5 2组MMPs蛋白表达水平比较 (pg/ml,)Tab 5 Proteins expression of MMPs in the 2 groups (pg/ml,)

表5 2组MMPs蛋白表达水平比较 (pg/ml,)Tab 5 Proteins expression of MMPs in the 2 groups (pg/ml,)
MMP1 MMP2 MMP3 MMP9 NC对照组 75.05±8.16 151.40±16.22 35.30±4.11 105.36±分 组10.14 IL-17处理组 166.37±17.28 256.78±30.57 131.44±15.16 215.37±23.24 t值 31.336 19.968 40.136 28.450 P值0.000 0.000 0.000 0.000
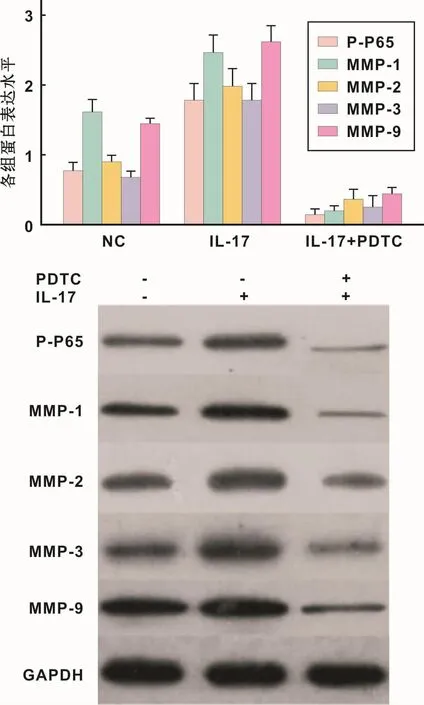
图1 IL-17通过激活NF-kB调节MMPs的表达Fig 1 Il-17 regulates the expression of MMPs by activating NF-kB
3 讨 论
TNF-α,IL-1β,IL-6,IL-8等炎症细胞因子在牙周疾病的发展进程中起着重要作用,与牙周炎及口腔扁平苔藓的发生发展关系密切。但IL-17与牙周炎伴口腔扁平苔藓的关系目前尚不明确。IL-17是一种复杂的多功能细胞因子,能够促进T细胞和NK细胞产生IFN-γ,增强Fas-FasL系统介导的细胞毒作用,调节促进Th1细胞发育分化,促进Th1细胞分泌多种细胞因子。有报道示IL-17能促进炎症因子和趋化因子的表达,进而发展成各种炎症性疾病。IL-17与相应IL-17R结合后,通过p38MAPK和JNK信号通路可诱导AP-1,NF-KB等转录基因表达,多种转录基因的表达增强,促进下游IL-6,IL-8等炎症细胞因子表达加强。许多免疫细胞包括单核细胞,巨噬细胞等都受IL-17的调控,因此,IL-17在炎症反应链中扮演着重要的角色。本研究中,与健康志愿者相比,牙周炎伴口腔扁平苔藓患者血清中IL-17蛋白表达水平升高,提示IL-17可能与牙周炎伴口腔扁平苔藓存在相关性。牙周炎伴口腔扁平苔藓患者唾液中IL-17的表达量与菌牙周探诊深度、附着丧失、菌斑指数、牙龈指数这些临床指标呈正相关,表示IL-17可能促进牙周破坏程度。
hPDLFs是牙周组织中的主要细胞成分,具有趋化,增生,黏附,分化为成牙骨质细胞,成骨细胞,形成矿化组织等功能。本研究发现,IL-17与hPDLFs的增殖能力无明显相关性,说明IL-17并不是通过影响hPDLFs的增殖而参与到牙周炎伴口腔扁平苔藓的发展过程。
MMPs在牙周组织破损过程中起着关键作用,其中MMP-1是胶原酶,可降解Ⅰ~Ⅲ型胶原及其他ECM,在病变的牙周组织中高表达;MMP-2是明胶酶,可降解明胶及Ⅰ~Ⅲ型胶原,在牙周组织破坏过程中发挥关键作用,调控牙周组织炎症过程;而另一种明胶酶MMP-9可降解明胶、Ⅳ型、Ⅴ型、Ⅶ型及Ⅹ型胶原,MMP-9的表达与牙周炎伴口腔扁平苔藓患者牙周组织破坏程度密切相关[9-11]。MMP-3是基质溶解素,可激活其他MMPs,促进炎症进程。相关研究表明,在牙周炎患者患病部位的龈沟液中,MMP-3和MMP-1含量明显增加,并与患者临床症状密切相关。研究发现,MMPs功能活性可以被TIMPs调节,在炎性牙周组织中,MMPs含量高于TIMPs,炎症程度越重,活性MMPs浓度越高[12]。与健康人群相比,牙周炎伴口腔扁平苔藓患者龈沟液及牙龈组织中MMP-1,MMP-2,MMP-3和MMP-9显著升高,而TIMP-1和TIMP-2显著降低[13-14]。本研究发现,IL-17可以促进hPDLFs中MMP1,MMP2,MMP3和MMP9的mRNA表达,但值得注意的是,IL-17不会对TIMP-1和TIMP-2的mRNA表达产生明显影响。IL-17可促进hPDLFs中MMP1,MMP2,MMP3和MMP9蛋白的分泌。表明IL-17可能通过上调MMP1,MMP2,MMP3和MMP9的表达从而促进牙周炎伴口腔扁平苔藓患者的病理发展。
NF-kB可调控IL-2,IL-6,IL-8,TNF-α,MMPs,GCSF等一系列细胞因子,是许多免疫炎症相关基因转录调控的枢纽,通过影响NF-KB的活性有可能直接调控机体的免疫状态。NF-kB和MMP-1有紧密的联系,MMP-1的基因启动子区域包含NF-kB的结合位点,NF-kB和位点结合后,启动MMP-1的基因转录,参与蛋白的表达。MMP-9有一个NF-kB的结合位点,阻断NF-kB信号通路可以下调MMP-9的表达。本研究发现,IL-17刺激后,NF-kB P65蛋白磷酸化的表达水平明显降低,MMP1,MMP2,MMP3和MMP9蛋白的表达水平受到抑制。表明IL-17可激活NF-kB信号通路,诱导MMP1,MMP2,MMP3和MMP9的表达量升高。
综上所述,IL-17在牙周炎伴口腔扁平苔藓患者的病理进程中扮演了重要角色,本研究数据表明,IL-17可通过激活NF-kB信号通路,使活化的NF-kB促进hPDLFs中的MMP1,MMP2,MMP3和MMP9的分泌,从而起到促进牙周炎伴口腔扁平苔藓的发展。因此,IL-17可能为牙周炎伴口腔扁平苔藓的诊断及治疗提供了新的研究方向与治疗靶点。
