miR-149-3p对糖尿病大鼠心肌细胞胰岛素抵抗的作用
2019-12-05何永丹
何永丹
随着人们饮食结构和生活方式的改变,糖尿病(diabetes mellitus,DM)作为一种常见的慢性代谢性疾病,其发病率在全世界范围内呈逐年升高的趋势[1]。据统计,我国糖尿病的发病较高,约达到9240万人口[2]。近年来,随着人们对心肌胰岛素抵抗的逐步认识,研究发现胰岛素抵抗在糖尿病的发生和进展过程中起到至关重要的作用[3,4]。miRNA是一类存在于真核生物体内、长度约为22~25个核苷酸的内源性非编码单链小分子RNA,其可以通过与靶基因配对引起靶基因降解或抑制其翻译,从而对靶基因的表达进行转录后水平的调控[5]。据报道,miRNA能够参与生命过程中一系列的生物学过程,但miRNAs在心肌胰岛素抵抗中是否发挥一定的作用及其潜在的机制有待继续研究[6]。因此,本研究探讨miR-149-3p对糖尿病大鼠心肌细胞胰岛素抵抗的干预作用及其具体机制,并为疾病的治疗提供新的治疗思路及靶点。
1.材料与方法
1.1 大鼠糖尿病模型的建立与鉴定 24只SD雄性大鼠购于上海维通利华公司。适应性饲养1周后,将SD大鼠随机分为对照(CTL)组和糖尿病模型(DM)组。对照组给予普通饲料喂养。糖尿病模型组给予45%脂肪热量的高脂饲料(Research Diet公司,美国)喂养,12周后,按照30mg/kg剂量腹腔注射链脲佐菌素(streptozotocin,STZ)(sigma公司,美国)。
1.2 细胞培养和传代 大鼠心肌细胞H9c2细胞购于中国科佰生物公司,并采用含有10%胎牛血清,1%青霉素-链霉素的DMEM培养液(Hyclone公司,美国)进行细胞培养,将细胞置于37℃、5% CO2培养箱(Thermo,美国)中。
1.3 细胞转染 转染前将细胞接种于培养板(Nest公司,中国)中,待细胞汇合度达到60%时,应用转染试剂脂质体Lipofectamine® RNAiMAX Reagent(Thermo公司,美国),进行细胞转染。分组分别为miR-149-3p mimic、miR-149-3p inhibitor以及随机对照序列(NC-mimic和inhibitor-NC),转染48h后进行后续实验。
1.4 RNA提取和real-time qPCR实验 按照Trizol试剂(Thermo,美国)使用说明书提取总RNA。参照逆转录试剂盒(ABI,美国)和SYBR试剂(罗氏,德国)说明书,并将1μg总RNA进行逆转录实验,并用于real-time qPCR实验。以U6作为内参基因,应用2-ΔΔCT方法检测miR-149-3p的表达情况,且以GAPDH为内参,检测FTO的表达情况。
1.5 高脂培养基的配制 称取牛胰岛素与棕榈酸钠(sodium palmitate,PA)(Sigma公司,美国)0.0137g,溶于1ml甲醇中,即配制成浓度为50mM的母液。称取脱脂BSA 1g,溶于10ml细胞培养专用PBS(Hyclone,美国)中,即配制成10% BSA母液。向DMEM培养基(Hyclone,美国)加入10% BSA母液,配制成含有1% BSA的培养基,然后加入适量50mM的PA母液,55℃水浴中振荡使之完全溶解。
1.6 2-脱氧荧光葡萄糖类似物(2-NBDG)吸收的测定 应用2-NBDG试剂盒(Invitrogen,美国)检测细胞葡萄糖摄取情况。首先,将细胞接种于96孔培养板(Nest,中国)中,应用无血清培养基饥饿6h,每孔加入200μL体积的、含有1μM2-NBDG、含或不含0.1μM胰岛素的无血清培养基,37℃培养箱中孵育1h,置于荧光酶标仪(Tecan,瑞士)上,检测细胞内荧光强度,用以评估心肌细胞摄2-NBDG的情况。每孔加入CCK-8试剂(同仁,日本)10μL孵育细胞,4h后在波长为490nm处检测吸光度值。
1.7 western blot实验 应用裂解液(碧云天,中国)裂解细胞15min,并用细胞刮刀刮净细胞,并以12000r/min的转速离心20min。取30μg样品加至SDS-PAGE凝胶电泳槽中进行电泳,并转膜。在4℃条件下,孵育FTO抗体(Abcam,美国)或β-actin抗体(Abcam,美国)过夜。次日,用PBST洗3遍,并在室温条件下孵育相应的二抗(Abcam,美国)1h。最终,经化学发光凝胶成像仪分析蛋白表达情况。
1.8 统计学方法 所有数据均使用统计软件GraphPad Prism 5(GraphPad,美国)分析,所有数据均使用均数±标准差表示,两组间差异选用配对t检验进行分析,P<0.05时认为差异有显著性意义。
2.结果
2.1 miR-149-3p在糖尿病大鼠心肌组织中的表达 称量两组大鼠体重,结果显示,糖尿病模型大鼠体重显著高于对照组,差异具有统计学意义(P=0.0004,图1A)。糖尿病模型组大鼠腹腔注射糖耐量实验中2h血糖显著高于对照组(图1B)。此外,糖尿病模型组大鼠血浆TC、TG和FFA水平均显著高于对照组(图1C~1E)。real-time qPCR实验结果表明,糖尿病模型组大鼠心肌中miR-149-3p的表达显著降低,且差异具有统计学意义(P=0.0171,图1F)。

图1 miR-149-3p在糖尿病大鼠心肌组织中显著升高
2.2 高糖高脂引起H9c2心肌细胞低表达miR-149-3p及糖摄取减少 在高糖高脂的培养环境下,细胞分组为对照组(CTL,含糖量为5.6mM)高渗对照组(HO,5.6mM葡萄糖+20mM甘露醇)、高糖培养组(HG,25mM葡萄糖)、高渗高脂培养组(HOHF,5.6mM葡萄糖+20mM甘露醇,300μMPA)以及高糖高脂培养组(HGHF,25mM葡萄糖,300μMPA),给予24h处理。应用real-time qPCR实验检测细胞中miR-149-3p的表达情况,结果显示,与HO组相比,HG组细胞内miR-149-3p的表达水平无明显改变(图2A)。HOHF组与HGHF组中miR-149-3p的表达显著降低,其中HGHF组下降最为显著。
此外,在HG培养的基础上采用不同浓度PA进行干预,结果显示miR-149-3p的表达随PA浓度升高而降低(图2B)。在后续实验中采用25mM葡萄糖+500μM PA的培养条件作为高糖高脂组(HGHF)条件,对照组(CTL)采用5.6mM葡萄糖+20mM甘露醇处理。另外,2-NBDG实验检测结果表明,细胞胰岛素敏感性随培养基中PA浓度升高而下降(图2C)。

图2 高糖高脂条件下H9c2心肌细胞中miR-149-3p的表达和糖摄取情况
2.3 miR-149-3p调控H9c2心肌细胞胰岛素刺激的糖摄取 2-NBDG荧光吸收强度检测结果表明,HGHF组细胞胰岛素刺激的糖摄取显著降低(图3A)。转染miR-149-3p mimic后,胰岛素刺激的葡萄糖摄取显著高于对照组(图3A)。转染miR-149-3p inhibitor后,胰岛素刺激的葡萄糖摄取显著低于对照组(图3B)。
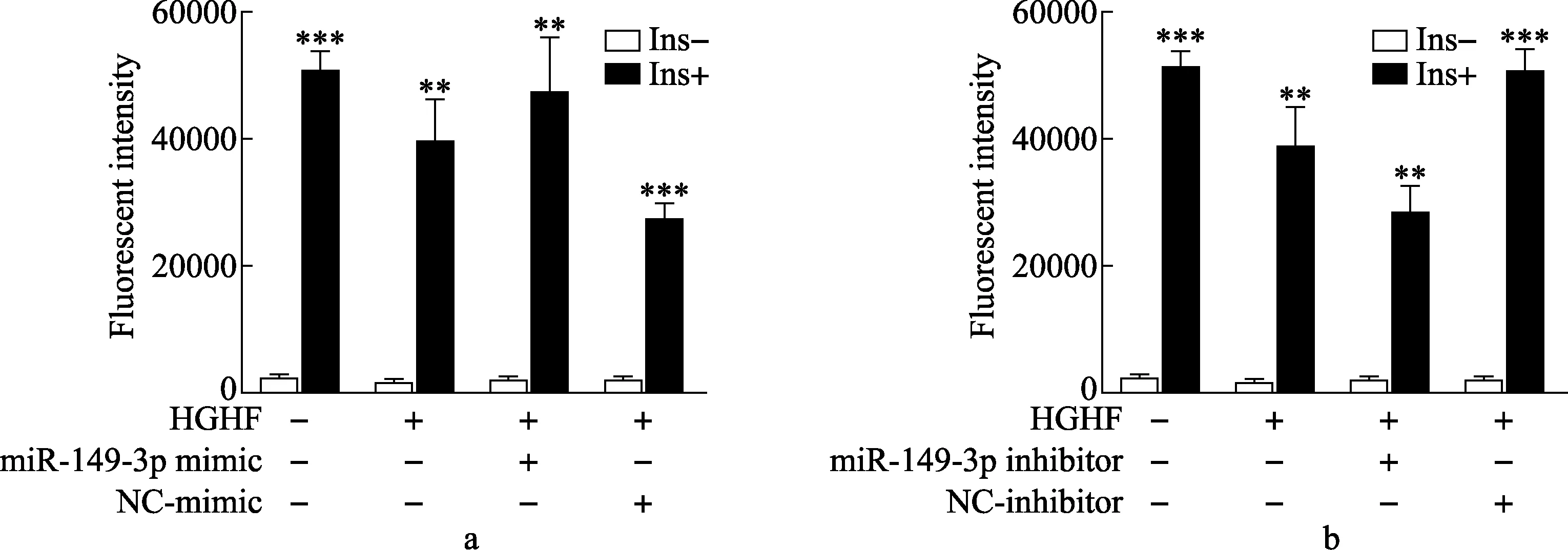
图3 miR-149-3p对H9c2心肌细胞胰岛素刺激的糖摄取作用
2.4 miR-149-3p通过抑制FTO水平负性调节胰岛素信号通路 在线网站TargetScan显示FTO和miR-149-3p具有结合位点(图4A)。应用real-time qPCR实验和western blot实验检测FTO的表达情况。结果显示,转染miR-149-3p mimic后,细胞中FTO表达显著降低,而转染miR-149-3p inhibitor后,细胞中FTO的表达情况显著升高(图4B和4C)。

图4 miR-149-3p对FTO的调控作用
3.讨论
近年来,随着人们生活水平的不断提高,糖尿病的发病率呈逐年上升的趋势[7,8]。胰岛素抵抗是2型糖尿病的主要特点,胰岛素抵抗状态下心肌细胞利用葡萄糖出现障碍,心肌细胞脂肪酸氧化代谢增强,心肌细胞凋亡率增加,从而引起心脏收缩功能障碍,此外,其可在心肌缺血再灌注损伤中引起左室功能恢复受抑制[9,10]。
随着人们对miRNAs的深入研究,越来越多的报道表明,miRNAs能够广泛参与诸多生命活动[11]。研究报道miR-149-3p能够抑制膀胱癌、宫颈癌、非小细胞肺癌等癌症细胞的增殖和迁移等,且其能够调控脂代谢[12],但未有研究报道其在糖代谢等方面是否发挥作用。此外,研究表明,miR-149-3p能够通过抑制FTO抑制脂代谢[13]。因此,我们猜想miR-149-3p可能在糖代谢方面也发挥一定的作用。
本研究中,糖尿病模型组大鼠腹腔注射糖耐量实验中2h血糖显著高于对照组,糖尿病模型组大鼠血浆TC、TG和FFA水平均显著高于对照组。real-time qPCR实验结果表明,糖尿病模型组大鼠心肌中miR-149-3p的表达显著降低。过表达miR-149-3p的水平可以一定程度恢复胰岛素刺激的糖摄取,敲减miR-149-3p的水平可以一定程度抑制胰岛素刺激的糖摄取,提示miR-149-3p可能参与了高糖高脂诱导的胰岛素敏性的改变。转染miR-149-3p mimic即可提高细胞对胰岛素的响应能力,而转染miR-149-3p inhibitor即可降低细胞对胰岛素的响应能力。进一步研究表明miR-149-3p可以通过下调FTO降低心肌细胞对胰岛素的敏感性。
综上所述,本研究结果显示miR-149-3p在糖尿病大鼠的心脏中表达水平降低,且其可通过下调FTO降低心肌细胞对胰岛素的敏感性,本研究为胰岛素抵抗相关疾病的诊断及治疗提供了新的思路。
