利用含丙烯酸的废水合成双氧水稳定剂的探讨
2019-12-04陆佳锦黄梦琪
陆佳锦,居 烨,黄梦琪,朱 泉,沈 丽
(东华大学化学化工与生物工程学院,上海 201620)
双氧水(H2O2)具有优良的氧化性能,漂白白度高,应用范围广,是常用于造纸、纺织等行业的环保漂白剂。但双氧水不稳定,在碱性环境及铜、铁、锰等重金属离子存在下极易分解,造成漂白液失效,因此,在氧漂过程中需要加入稳定剂来控制双氧水的分解速率[1-5]。氧漂稳定剂不仅要具备耐氧化、耐高温和耐碱的特点,同时又不损伤纤维或最大程度地减少纤维损伤。目前,复配型稳定剂的使用比较广泛,主要包括聚丙烯酰胺、有机磷酸酯钠盐及镁盐、聚羧酸或含羟基、氨基的多元羧酸与硅酸钠等[6-10]。
丙烯酸在工业上的应用日益广泛,产生了大量富含丙烯酸的废水,该废水酸性强,COD 值高,生产上通常采用催化焚烧的方式进行处理。这种处理方式不仅增加了企业的生产成本,而且对环境造成了一定的危害[11-12]。
本研究以含丙烯酸的废水为反应原料,对废水进行循环利用,符合环保理念。通过聚合反应制备聚丙烯酸钠,可用作双氧水稳定剂,并测试聚合物的钙、铁离子螯合性和分散性,探讨在高温、强碱和含有金属离子的条件下对双氧水稳定性能的影响。
1 实验
1.1 材料
含丙烯酸的废水(上海世龙科技有限公司),其他试剂均为分析纯;未退浆的棉坯布(29 tex/29 tex,广州美名纺织有限公司)。
1.2 聚合方法
在四口烧瓶中加入一定量含丙烯酸的废水,升温至一定温度,滴加含丙烯酸单体和(NH4)2S2O8引发剂的水溶液,滴加完毕后在一定温度下反应一段时间,冷却至50 ℃,用 NaOH 水溶液中和至 pH 为 7,得到浅黄色黏稠液体。
1.3 织物整理工艺
30%H2O26 g/L,用NaOH 溶液调节pH 为 10.5,不加稳定剂为空白,分别加入硅酸钠和自制双氧水稳定剂3 g/L,浴比1∶20,95 ℃保温60 min,织物取出后热水洗,冷水洗,烘干待测。
1.4 测试
相对分子质量[13]:配制含 1 mol/L NaCl 的水溶液,用毛细管内径为0.5~0.6 mm 的乌氏黏度计,在(25.00±0.05)℃下用一点法测定产品黏度。测定纯溶剂的流出时间t0和聚合物溶液的流出时间t,由下式计算特性黏度:
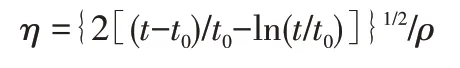
其中,ρ为产品溶液的质量浓度,g/mL。
聚合物的特性黏度和黏均分子质量之间的关系可用Mark-Hoodwink 方程表示:

Ca2+、Fe3+螯合值[14]:首先准确称取 1.000 g 样品,配成100 mL 溶液。然后移取10 mL 样液加入锥形瓶中,并加入40 mL 蒸馏水,用30%的NaOH 溶液调节pH 为 12。用 1 g/L Ca2+或 Fe3+标准溶液滴定,直至产生永久性混浊即为滴定终点(滴定过程中使pH 保持在12)。按上述步骤进行空白对照实验。标准溶液滴定时所消耗的Ca2+或Fe3+毫克数即为每克螯合剂络合Ca2+或Fe3+的毫克数。计算式如下:

式中:A为样品的 Ca2+/Fe3+螯合值,mg/g;V0为空白溶液消耗Ca2+/Fe3+标准溶液的体积,mL;V1为样品溶液消耗 Ca2+/Fe3+标准溶液的体积,mL;ρ为 Ca2+/Fe3+标准溶液的质量浓度,1 g/L;m为样品的质量,g。
分散值:准确称取4.00 g 聚合物(精确至0.01 g)配成100 mL 溶液,量取25 mL 至锥形瓶中,加入100 mL 10%的Na2CO3溶液和30 mL 蒸馏水,用0.1 mol/L乙酸钙标准溶液滴定至开始产生白色沉淀,30 s 后沉淀不消失即为滴定终点。计算式如下:

式中,V为样品滴定所消耗乙酸钙标准溶液的体积,mL;c为乙酸钙的浓度,mol/L;m为样品的质量,g;100.1为CaCO3的相对分子质量。
双氧水稳定效果:在相同条件下比较空白与加入自制稳定剂的双氧水分解率,对比高温(双氧水在达到温度后加入)、常温下的耐碱性以及常温下加入一定量金属离子后的双氧水分解率。30%双氧水用量为10 g/L,加入一定量稳定剂,混合摇匀,每隔一定时间吸取10 mL,用高锰酸钾标准溶液滴定,用下式计算H2O2分解率[7]。

式中:V始为原始漂白液消耗高锰酸钾标准溶液的体积,mL;V残为残余漂白液消耗高锰酸钾标准溶液的体积,mL。
白度:根据GB/T 8424.2—2001《纺织品色牢度试验相对白度的仪器评定方法》在Color-Eye 7000A测色系统上测定。
毛效:根据FZ/T 01071—2008《纺织品毛细效应试验方法》测定,测试时间30 min。
2 结果与讨论
2.1 丙烯酸用量对螯合值和分散值的影响
双氧水稳定剂的作用机理主要为吸附稳定理论和络合稳定理论两种。吸附型稳定剂中最典型的是水玻璃,水玻璃为网络型晶格结构胶体,有很大的比表面积,具有较强的吸附能力,能吸附重金属离子,封闭HO2-,从而起到稳定作用。络合稳定理论是通过多价螯合剂与重金属离子发生螯合作用而形成稳定的水溶性络合物,使重金属离子不发生催化作用[15],因此,双氧水稳定剂的螯合和分散性能与其稳定能力有密切关系。
作为原料的含丙烯酸废水来自于薄膜材料辐射接枝后的废液,成分为丙烯酸及丙烯酸低聚物,通过投料量与接枝率可以计算得到废水中丙烯酸及其低聚物的质量分数为17%。聚合反应中,单体用量小,聚合速率较低,相对分子质量较小;若继续增加单体用量,聚合反应速率过快,单体迅速聚集,聚合物相对分子质量快速增大,会影响聚合物的性能[16]。因此,以废水为原料,添加不同量的丙烯酸进行聚合反应。丙烯酸用量对螯合值和分散值的影响见图1。

图1 丙烯酸用量对螯合值和分散值的影响
从图1中可以看出,随着丙烯酸用量的增加,产物聚丙烯酸钠的钙、铁螯合值和分散值先增大后减小;当丙烯酸用量为37 g 时,合成聚丙烯酸钠的钙、铁离子螯合值和分散值最佳;测得聚合产物的相对分子质量为4 520,钙螯合值为296.34 mg/g,铁螯合值为365.97 mg/g,分散值为556.11 mg/g。螯合分散力可以通过相对分子质量的大小进行判断,相对分子质量太大会出现架构现象,分散能力减弱;但相对分子质量太小,分子链上可供吸附的活性基过少,产物的分散力也会减弱。
2.2 自制稳定剂对双氧水的稳定效果
2.2.1 耐高温分解率
温度是影响双氧水分解速率的重要因素之一,随着温度的升高,双氧水的分解速率增大[17],因此在加入稳定剂后将双氧水置于高温下分解。由图2可知,随着分解时间的延长,双氧水分解率略有上升,相比硅酸钠,自制稳定剂的稳定效果有较大提升,说明自制稳定剂有良好的耐高温能力,在高温下可以大大减少双氧水的无效分解。
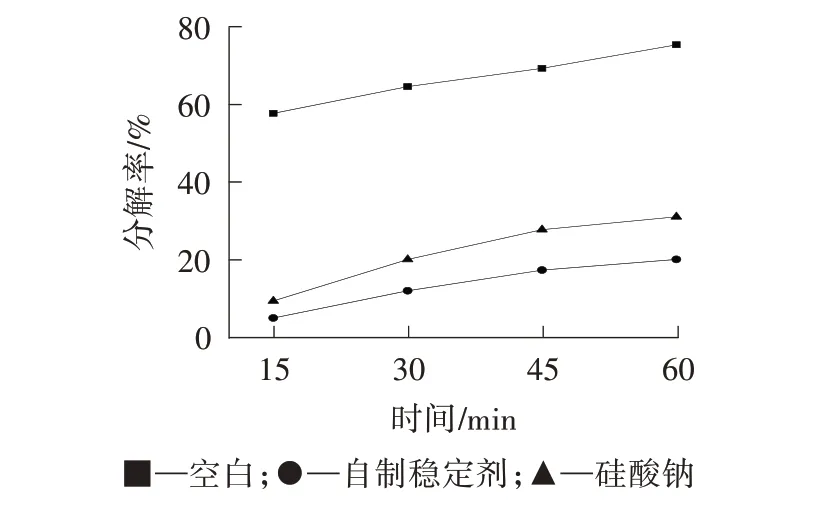
图2 稳定剂在高温(90 ℃)下对双氧水分解率的影响
2.2.2 耐碱分解率
由图3可知,随着时间的延长,双氧水分解率均呈上升趋势。加入自制稳定剂的双氧水分解率较小,稳定效果优于硅酸钠,说明自制双氧水稳定剂具有良好的耐碱能力。
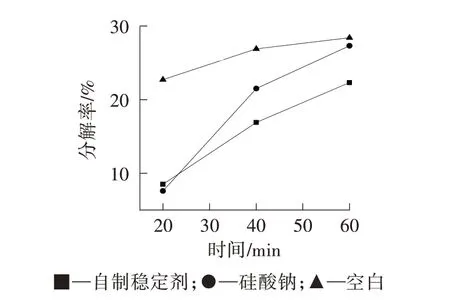
图3 稳定剂在10 g/L NaOH 条件下对双氧水分解率的影响
2.2.3 耐Fe3+分解率
双氧水在含Fe3+的体系中会与Fe3+发生氧化还原反应,从而加速双氧水的分解,使漂白效果变差,而自制稳定剂对Fe3+有螯合作用。Fe3+与H2O2反应产生强氧化性·OH 的过程被称为类 Fenton 反应[18],机理如下:
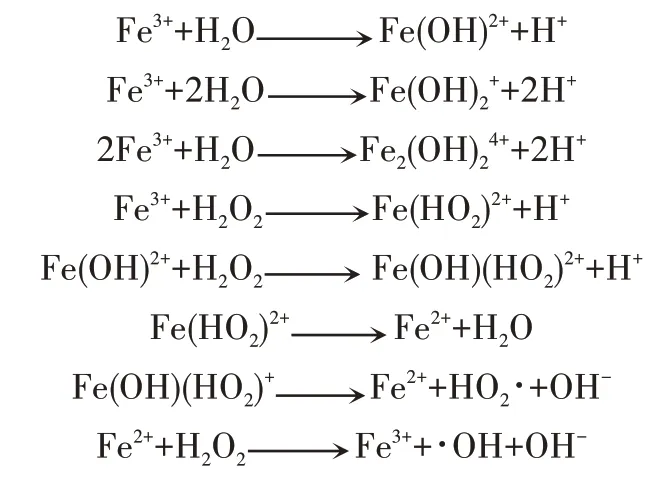
本实验在硬水体系中加入Fe3+,分别测定加入Fe3+前后双氧水的分解率,以此分析自制稳定剂耐Fe3+的效果。由图4可知,在硬水体系中加入Fe3+后,空白组双氧水分解速率加快,分解率提高,说明Fe3+加速了双氧水的分解;加入自制稳定剂和硅酸钠组双氧水分解率变化不大,说明二者对Fe3+的螯合力都较强,两者相比,自制稳定剂的稳定效果好于硅酸钠,说明自制稳定剂对Fe3+的螯合能力优于硅酸钠。
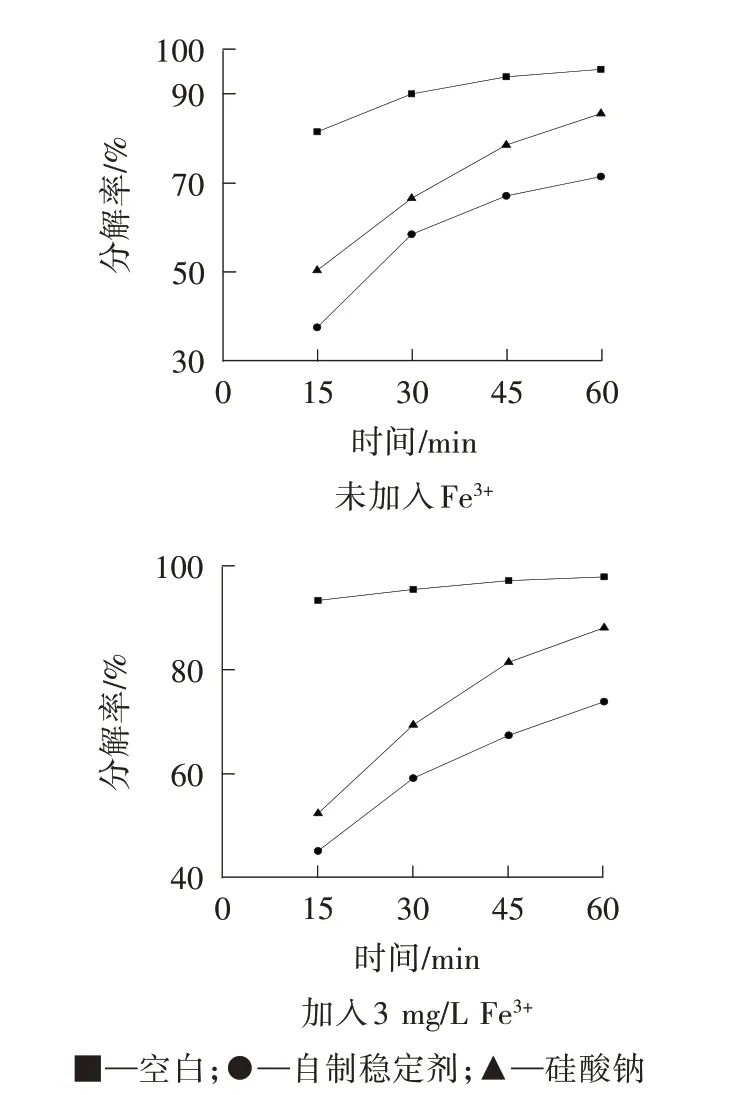
图4 硬水体系中加入Fe3+对双氧水分解率的影响
2.3 自制稳定剂对棉织物白度的影响
由表1可知,Fe3+的存在使织物白度下降,说明Fe3+加速了双氧水的分解,使漂白效果变差。含有稳定剂的实验组加入铁离子后,织物的白度和毛效值都有提高,说明稳定剂不仅对双氧水起到稳定作用,也对铁离子有螯合作用,降低了Fe3+对双氧水的催化分解速率,自制稳定剂的稳定效果优于硅酸钠。
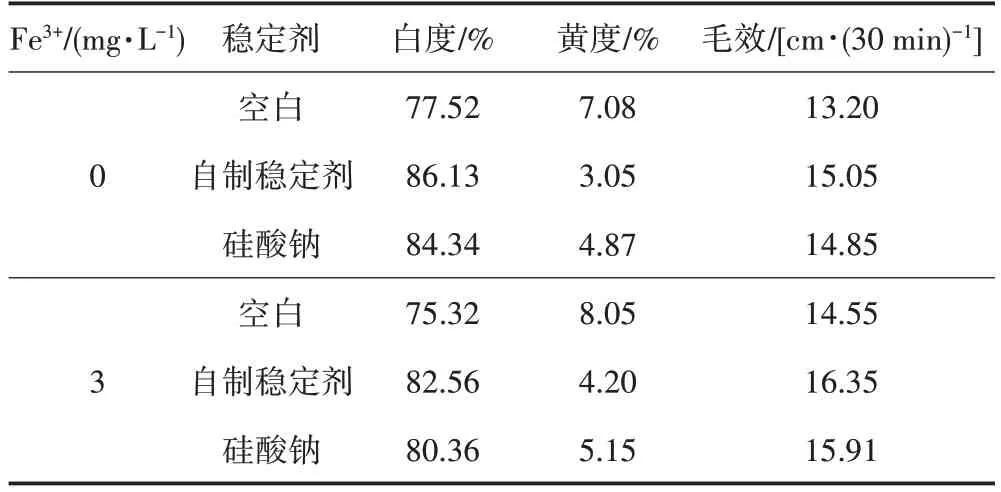
表1 不同稳定剂在硬水体系中的漂白效果
3 结论
以含丙烯酸的废水作为原料合成双氧水稳定剂,当丙烯酸用量为37 g 时,合成聚丙烯酸钠的钙、铁螯合值和分散值均最佳。测得聚合产物的相对分子质量为4 520,钙螯合值为296.34 mg/g,铁螯合值为365.97 mg/g,分散值为556.11 mg/g。在高温(90 ℃)、碱性以及Fe3+存在的条件下,合成样品对双氧水的分解能够起到有效的抑制作用。与硅酸钠对比,自制稳定剂的稳定效果更优。
