介孔二氧化硅在药物递送系统及其体内外研究进展
2019-12-04张文君吴梦婷吕春艳王晴陈泳霖
张文君 吴梦婷 吕春艳 王晴 陈泳霖
(哈尔滨商业大学药学院,哈尔滨150076)
随着纳米医学的迅速发展,纳米粒子在药物递送系统(Drug delivery system,DDS)的应用引起了人们的广泛关注。传统的纳米载体常以有机物为基础,如乳剂[1-2]、脂质体[3-4]、聚合物胶束[5-6]等,虽已展现出良好的载药性能,但同时存在稳定性差以及药物易泄露等缺陷,药物释放不能达到理想的目的[7]。相比之下,无机介孔二氧化硅纳米粒子(Mesoporous silica nanoparticles,MSNs)因介孔结构可调、框架结构稳定、比表面积较高、生物相容性良好以及易于功能化[8-10]等优点在药物递送系统研究中备受关注。然而,介孔二氧化硅稳定的框架结构造成其在体内难降解、难排泄,长时间在体内重要器官积蓄,从而造成损伤。有研究表明,介孔二氧化硅在模拟体液中降解速度非常缓慢,大约15 d才能完全降解[11]。因此,为保证这些纳米材料能够安全应用于临床,需明确它们在体内吸收、分布、代谢、排泄及生物相容性和毒性。本文介绍了近年来关于介孔二氧化硅在药物递送系统中及基因治疗方面的应用,及对MSNs 的药物代谢动力学、生物相容性和毒性进行了综述,旨为后续在生物医学的临床研究提供借鉴。
1 MSNs 在药物递送系统中的应用
MSNs 作为一种具有高比表面积、大孔隙率及表面易功能化的载体材料,在药物递送系统中获得了广泛的应用,如被用于改善水难溶性药物的溶解度,或作为控制药物、靶向及基因递送的载体。
1.1 改善药物溶解度
随着创新药物的不断开发,大部分候选新药表现出低溶解度[12]。研究发现纳米技术可明显改善水难溶性药物的溶解度,即将药物制成纳米粒或是将药物载入纳米材料中。在各种纳米材料中,无机介孔二氧化硅因高孔隙率、大比表面积等优点,可作为一种理想的载体材料。介孔二氧化硅的硅醇基可与药物分子形成氢键,提高药物粉末的润湿性和分散性,使其从晶态转变为非晶态,与晶态相比,非晶态具有更高的自由能和更大的分子迁移率,且介孔内的空间位阻可以减缓或阻止非晶态药物的再结晶[13-14],从而改善药物的溶解度和提高药物的溶出速率。He 等[15]发现紫杉醇的溶解度在装入MSNs后显著提高,MTT 实验表明,与紫杉醇原料药相比,经介孔二氧化硅纳米粒装载的紫杉醇对HepG2细胞具有明显的细胞毒性。Tzankov 等[16]以MCM-41 型介孔二氧化硅和中空型介孔二氧化硅(Hollow mesoporous silica,HMS)为载体,装载难溶性药物格列美脲(Glimepiride,GLI,BCS,II 类)。XRD 结果显示,在MCM-GLI 和HMS-GLI 上,结晶度分别为38%和20%,纯格列美脲样品的结晶度为88%,表明格列美脲的某些结晶转变为非晶态存在于载体的孔隙中。体外释放试验表明,两种载体在2 h 内几乎完全释放,而纯格列美脲的溶出率仅为30%。研究表明,经修饰后的MSNs 可进一步提高药物的溶解度,Meka 等[17]将伏立诺他(Vorinosta,VOR)分别装载入MSN(MCM-41)、经氨基修饰的MSN(MCM-41-NH2)和经磷酸酯修饰的MSN(MCM-41-PO3),经修饰后的MSNs 溶解度明显增加(图1),与游离药物相比,在MCM-41-VOR、MCM-41-NH2-VOR 和MCM-41-PO3-VOR 中的VOR 溶解度分别提高了2.6 倍、3.9 倍和4.3 倍,且对Caco-2 人结肠癌细胞的渗透性也明显增强,特别是经氨基修饰的MSN(MCM-41-NH2-VOR),其通透性提高了4 倍。
1.2 控制药物释放
介孔二氧化硅表面存在大量的硅烷醇基团,可通过各种有机官能团、聚合物和靶向基团对其进行修饰改性,使其具备控制药物的吸附、释放或靶向功能。其中,靶向型和刺激响应型MSNs 是控制药物释放的常用方法。
1.2.1 靶向型 靶向MSNs 是通过使用叶酸、多肽、蛋白/抗体、透明质酸等[18-20]不同配体对介孔二氧化硅载体表面进行修饰,使修饰后的载体与肿瘤细胞上的特异性受体结合,达到靶向治疗的目的[21]。Zhang 等[22]通过二硫键将透明质酸(Hyaluronic acid,HA)修饰到MSNs 表面,制备了CD44 靶向的药物递送系统。因肿瘤细胞含有过度表达的CD44 受体,这些受体可特异性识别HA,从而促进HA 功能化的MSNs 内吞作用,使药物在肿瘤组织中内化,提高药物的抗肿瘤效果。Wei 等[23]制备了一种经聚多巴胺(Polydopamine,PDA)和导向肽CSNRDARRC(PEP)修饰的MSNs,并负载阿霉素(Doxorubicin,DOX),与未经修饰的MSNs相比,DOX-loaded MSNs@PDA-PEP 能够特异性识别膀胱癌HT-1376 细胞,表现出良好的体外治疗效果。Mandal 等[24]通过酰胺反应将琥珀酸酐和具有靶向作用的抗-B220 抗体修饰到MSNs 表面,并负载蒽环类柔红霉素,可有效地与小鼠B220 阳性急性髓系白血病干细胞(AML LSCs)特异性结合,抑制病变细胞。此外,还可以将两种靶向剂(双靶向)修饰到同一纳米载体上,从而进一步提高其选择性[25]。López 等[26]制备了Janus 型介孔二氧化硅粒(J-MSNs),其可以不对称地携带两个靶向分子,即叶酸(Folic acid,FA)和三苯基膦(Triphenylphosphine,TPP),其中FA 可以靶向到叶酸受体,TPP 能够靶向到线粒体,FA 会增加J-MSNs 在肿瘤细胞内的积累,随后会在TPP 分子的引导作用下靠近线粒体(图2),从而实现双靶向的目的,双靶点策略可用于提高MSNs 抗肿瘤的治疗效果。
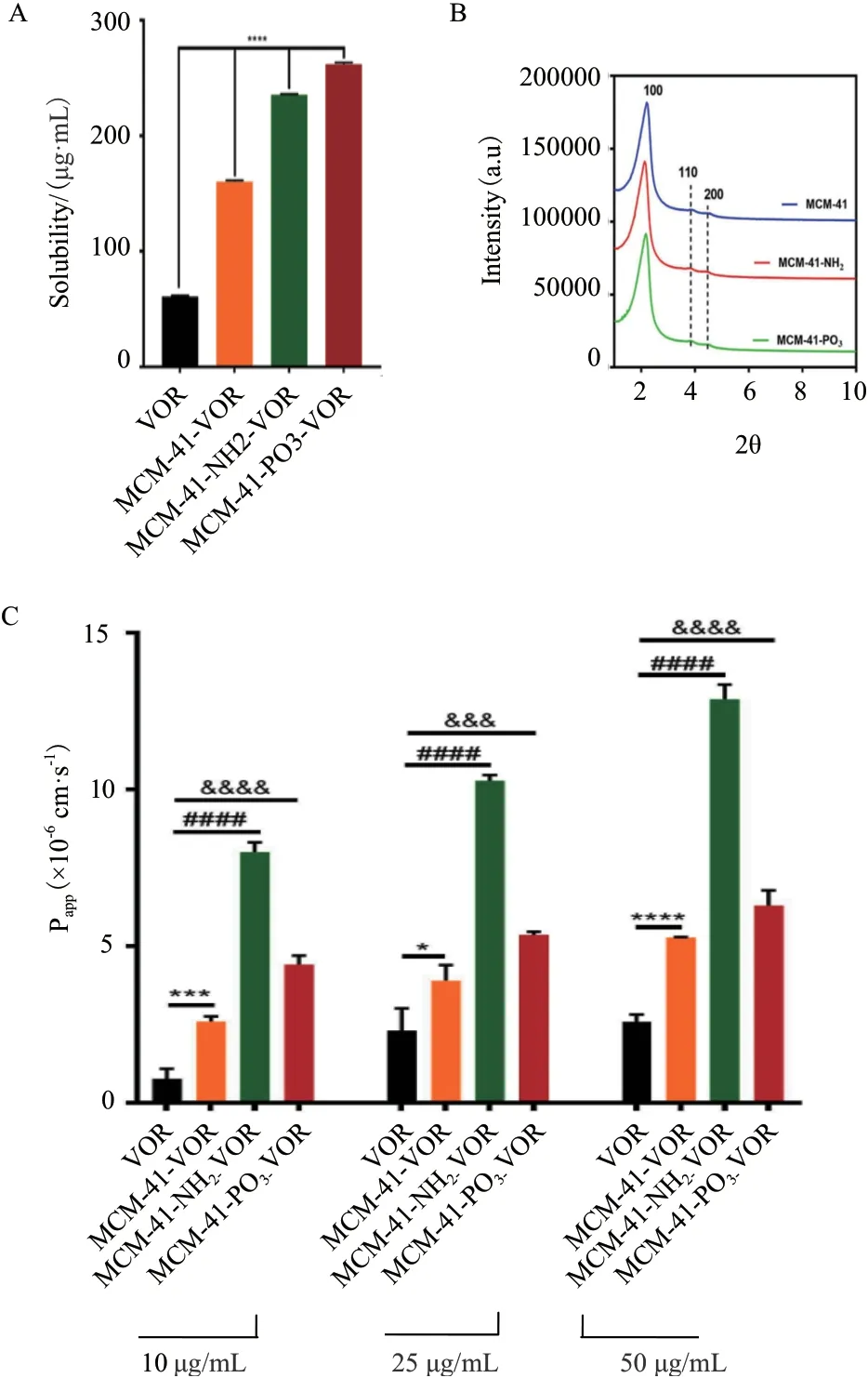
图1 伏立诺他及负载其MSNs 的溶解度和渗透性[17]
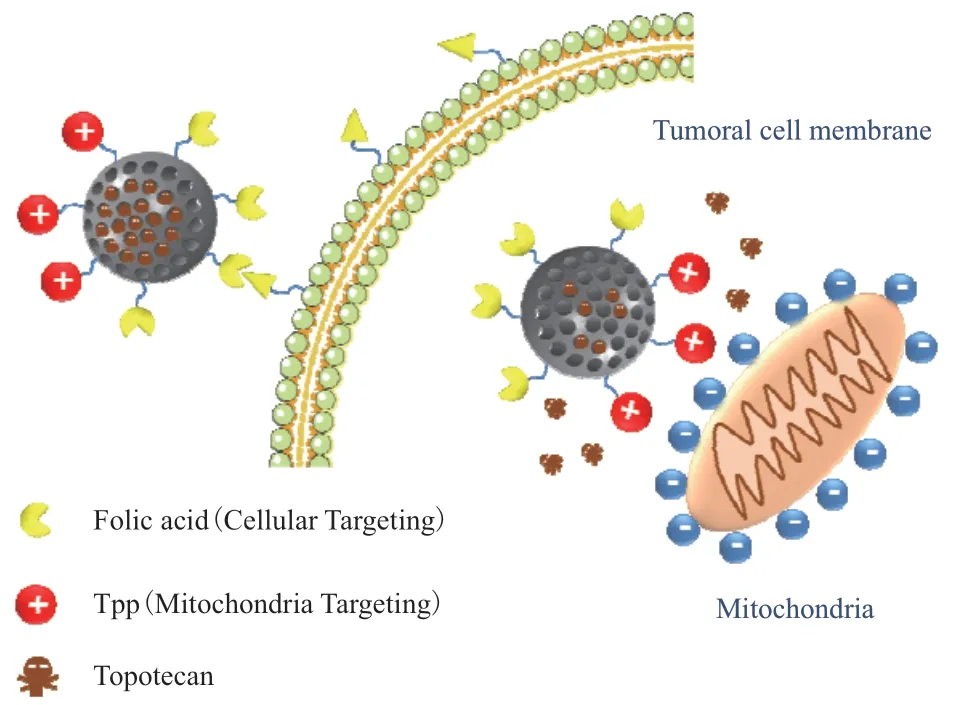
图2 双靶向MSN 的作用机制[26]
1.2.2 刺激响应型 刺激响应型是将MSNs 和响应成分相结合形成一种复合载体材料,以实现光响应、磁响应、温度响应、氧化还原响应、pH 响应、酶响应和多重响应等控制药物递送,达到“智能”释放的效果[27-30]。
由于光具有无创、分辨率高等特性[31],光响应是一种很有前途的外刺激触发控制药物释放策略。Chen 等[32]用螺吡喃与氟化硅烷修饰MSNs,并负载抗癌药物喜树碱(Camptothecin,CPT),在365 nm紫外光照射下,螺吡喃由封闭态向开放态的构象转换导致表面润湿,使CPT 从孔隙中释放出来。Li 等[33]制备了一种集光热治疗于一体化的介孔二氧化硅包覆金纳米棒(AuNR@MSN)系统,该系统由磺化杯[4]芳烃(SC[4]A)作为控制开关,在近红外光照射下,可激发AuNR 核等离子体加热,从而降低环柄结合亲和力,导致SC[4]A 环与茎分离,使纳米阀呈现打开的状态,释放出产物。肿瘤组织(pH 6.8)以及细胞内体/溶酶体(pH 5.5)表现为比正常组织(pH 7.4)更强的酸性,Chang 等[34]利用体内pH 间的差异制备了一种由PDA 修饰的MSNs 载药系统,并负载药物地昔帕明(Desipramine,DES),在pH 6.0、pH 5.0 的弱酸性条件下,DES 在24 h 的释放量大致为45%和70%。具有还原敏感性质的二硫键也可以用来构建化学刺激响应型MSNs。Wang 等[35]将聚乙二醇(Polyethylene glycol,PEG)与MSNs 通过二硫键连接,PEG 起到封堵药物的作用,当加入谷胱甘肽(Glutathione,GSH)后,PEG 失活且二硫键断裂,药物从载体内释放出来。Rijt 等[36]报道了一种以抗生物素蛋白分子作为封闭开关的MMP9 酶响应控释系统,由于基质金属蛋白酶(尤其是MMP2和MMP9)几乎在各种类型肿瘤细胞中都过度表达,因此,MSNs-MMP9 能够在高度表达的MMP9 肿瘤区域内被切割,从而释放出化疗药物。此外,还可将不同单响应组分结合在一起形成双响应或多重响应,Paris 等[37]制备了超声-热双响应体系(图3),即将热响应聚合物p(MEO2MA)-co-THPMA 接枝到MSNs 上,此聚合物具有超声可裂解的疏水四氢吡喃基,热响应聚合物在低温下可以实现药物的装载,当达到生理温度时,聚合物收缩关闭孔隙入口,药物被保留在载体中,在超声作用下聚合物发生裂解且疏水性发生改变,其构象呈线状打开释放药物,从而实现控释药物的目的。
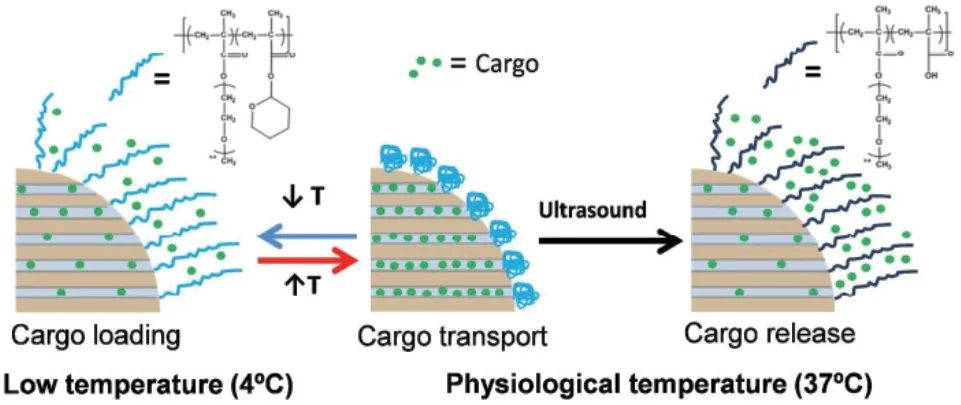
图3 双响应释放系统在水中的行为示意图[37]
1.3 基因治疗
介孔二氧化硅除了可以作为传统的药物载体外,还可作为基因转染的载体,从而达到基因治疗的目的。有效的基因传递在基因治疗中起着重要的作用,因为裸核酸几乎没有穿透细胞膜的能力,所以载体在基因传递中起着重要的作用[7,38]。MSN因表面可功能化、生物相容性良好、物理化学稳定性等优点,可作为基因传递载体,从而提高细胞的吸收和转染效率。基因治疗主要包括小干扰RNA(siRNA)、质粒DNA(pDNA)和反义寡核苷酸(Antisense oligonucleotides,ASOs)[39]。MSNs 表面通常带有负电荷,这使得带相同负电荷的核酸负载率低。因此,通常通过氨基化和阳离子聚合物功能化等方法修饰MSNs,使其携带正电荷,再通过静电引力作用促进基因的负载。Li 等[40]制备了一种双响应型基因递送系统CMSN-A,将二硫键和酰胺键同时修饰到氨基化的MSNs 上,细胞摄取研究表明,CMSN-A 可以同时将pDNA 和siRNA 转染到不同类型的肿瘤细胞中。阳离子聚合物如聚乙烯亚胺(Polyethyleneimine,PEI)[41]、聚氨基胺(Poly amino amine,PAMAM)[42]、聚L-赖氨酸(Poly-L-lysine,PLL)[43]、壳聚糖(Chitosan,CS)[44]等常用于修饰MSNs,因阳离子聚合物所提供正电荷,不仅可以与核酸高度结合,保护DNA 不被酶降解,还能与带负电荷的细胞膜之间存在较强的静电引力作用,从而促进细胞对MSNs 的吸收。Zarei[45]制备了PEI 包覆的磷脂化介孔二氧化硅(Phospholipids mesoporous silica,PMSN)用于递送DNA,转染研究结果表明,PMSN-PEI 是一种具有低细胞毒性的基因转染载体。
2 MSNs 的药物代谢动力学
MSNs 是一种很有前途的生物医学无机纳米材料。然而,MSNs 在体内的安全性还未明确。因此,了解MSNs 在体内的吸收、分布、代谢、排泄是生物医学应用MSNs 的首要前提。
2.1 MSNs在体内的吸收和分布
MSNs 的吸收和分布因给药途径的不同而存在很大的差异。Zheng 等[46]制备了不同纵横比的介孔二氧化硅纳米球(MSNSs)和介孔二氧化硅纳米棒(MSNRs),细胞研究结果表明,MSNRs 比MSNSs 具有更高的细胞摄取能力。Fu 等[47]通过静脉注射、皮下注射、肌肉注射和口服4 种不同的给药途径,系统研究了平均粒径为110 nm 的二氧化硅纳米粒的体内分布。结果表明,肌肉注射和皮下注射的部分MSNs 能通过不同的生物屏障进入肝脏,但吸收率较低,并且引起注射部位周围的炎症反应;经口服给药后,MSNs 被肠道吸收并滞留在肝脏;静脉注射的MSNs 主要存在于肝脏和脾脏。此外,体内分布情况还取决于MSNs 的形状、尺寸、孔隙率、表面功能化等[48-49]。如短棒MSNs 易被肝脏捕获,而长棒MSNs 分布于脾脏,经PEG 修饰后,两种形状的MSNs 在肺中的含量都有所提高[50]。此外,蛋白质电晕的形成也会影响纳米粒子在体内的分布,还会产生溶血活性[51-52]。但经PEG 修饰的MSNs,既能阻止蛋白质电晕的形成,还能增加体内血液循环时间[53],或可以通过带有功能化基团(通常是碱性-NH2或酸性-COOH 基团)与MSNs 硅烷化来调节表面电荷,从而降低蛋白质电晕的形成[54]。
2.2 MSNs在体内的排泄
纳米材料在体内的排泄途径也是一项重要的研究。经不同途径给药后,MSNs 主要通过尿液和粪便排出。Li 等[55]发现口服MSNs 大部分可通过胃肠道从粪便中迅速排出,但部分完整的MSNs 或其降解产物可通过肠粘膜吸收,进入系统循环,最终通过肾从体内排出,且纵横比越小的MSNs肾排泄率越高。静脉注射后,尿液中可检测出MSNs[56]。肾排泄已被确定为大多数类型的MSNs 的主要排泄途径[57],且排泄速率与MSNs 的降解性有关,随着MSNs 纵横比[55]或粒径[58]的减小,降解能力越高,排泄速度越快。
3 MSNs 的生物相容性和毒性研究
MSNs 的粒径、形状、表面性质等不同以及活性氧的产生、给药剂量和给药途径的不同,其生物效应也不同,因此了解MSNs 的生物相容性和毒性对其临床应用的有效性和安全性至关重要。
3.1 粒径和形状的影响
MSNs 的粒径大小对二氧化硅颗粒的毒性有很大的影响,且与其粒径大小呈负相关。与较大粒径的MSNs(200 nm)相比,粒径较小的MSNs(50 nm)可通过血管内的缝隙渗透,因此可能更频繁地干扰血流,从而产生毒性[59]。Ye 等[60]采用MTT还原法测定了粒径为21 nm 和48 nm 的二氧化硅纳米粒子对心肌细胞的毒性,结果显示,二氧化硅纳米粒子(21 nm 和48 nm)的CC50 分别为0.32 mg/mL 和1.29 mg/mL 左右,这说明粒径较小的二氧化硅纳米颗粒具有较高的细胞毒性。MSNs 的形状会影响溶血活性,Yu 等[61]发现MSNs 的纵横比越低,溶血活性越高,然而,磁性介孔二氧化硅纳米粒子(M-MSNPs)或通过表面功能化的MSNs 可以降低甚至完全避免这种溶血活性。Shao 等[62]制备了3 种不同纵横比(AR=1、2 和4)的M-MSNPs,由于细胞内吞途径的不同,长棒M-MSNP 在癌细胞和正常细胞内的内化程度明显高于短杆M-MSNP 和球状M-MSNP,但3 种形状的M-MSNPs 都具有良好的生物相容性,以及较低的细胞毒性和溶血活性。Zhao等[57]合成了3 种不同形状的MSNs,长杆MSNs 纳米粒(NLR)、短杆MSNs 纳米粒(NSR)和球形MSNs 纳米颗(NS),发现NLR 具有很强的克服网状内皮系统(Reticuloendothelial system,RES)快速清除的能力,在血液循环中表现出比NSR 和NS 更长的时间。
3.2 表面性质的影响
除粒径外,MSNs 的表面性质也被认为是影响其生物相容性的最重要因素。带正电荷的纳米粒子比带中性和负离子的纳米粒子能诱导更多的免疫反应和细胞毒性。在未进行表面修饰的情况下,带负电荷的MSNs 会迅速与血清蛋白结合,进入血流后被RES 中的巨噬细胞清除,而且大量的硅醇基还会使MSNs 的润湿性增加,引起严重的溶血[63]。然而,MSNs 的表面修饰在改变表面反应活性、提高生物相容性、延长体内循环时间等方面起着关键作用。Pisani 等[64]比较了磁性MSNs(M-MSNs)、PEG 修饰以及脂质体修饰的M-MSNs 发现,这3 种纳米粒均未对肝细胞产生毒性,经PEG 修饰的M-MSNs 细胞摄取速度较慢,可使血液循环寿命延长,排泄率降低。
3.3 给药剂量的影响
不同的给药剂量也会对MSNs 的生物相容性和毒性产生影响。Kim 等[65]用MTT 法评价二氧化硅纳米粒子的细胞毒性,分别对A549(图4-A 和4-B)、HepG2 上皮细胞(图4-C 和4-D)和NIH/3T3 纤维母细胞(图4-E 和4-F)给予10-500 μg/mL 的剂量24 h 和72 h 后,结果表明,对于60 nm 的二氧化硅纳米粒子,大剂量(200 μg/mL 和500 μg/mL)与其他剂量和尺寸相比,细胞存活率显著降低(图4),该结果表明60 nm 的二氧化硅纳米粒子在高剂量下有着明显的毒性作用。此外,二氧化硅纳米粒子的毒性还依赖于细胞类型,与A549 和NIH/3T3 纤维母细胞相比,纳米粒子暴露72 h 后HepG2 细胞的存活率与24 h 相比没有明显下降(图4-E 和4-F)。
3.4 给药途径的影响
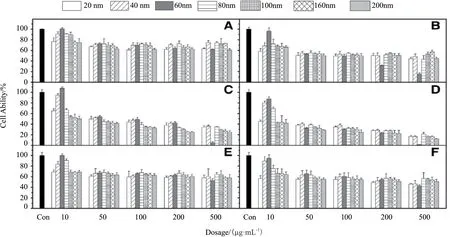
图4 不同粒径和剂量的MSN 在不同细胞暴露24 h(左)和72 h(右)的存活率[65]
纳米材料静脉注射是一种常用的给药途径,但血液相容性是其应用的关键问题。采取静脉注射MSNs 时,其在血液循环中具有较长的停留时间,且MSNs 与血液成分的相互作用,可能产生严重的毒性,如红细胞溶血、血栓形成或血蛋白吸附[66]。研究表明,表面修饰化可以明显改善MSNs 的血液相容性[67]。He 等[68]采用不同分子量(x=4、6、10和20)和链密度(0.05 wt%-3.75 wt%)的PEG 修饰MSNs,结果发现,MSNs 经过分子量为10 k、链密度为0.75 wt%的PEG 修饰后,THP-1 吞噬率为0.1%,HRBCs 溶血率为0.9%,远远低于MSN(8.6%和14.2%)。Li 等[63]研究动物口服MSNs 后的体重、临床症状和组织病理学,以检测经口服后其体内的潜在毒性,结果表明,MSNs 对体重增加无明显抑制作用。与对照组动物相比,处理组动物的心、肝、脾、肺、肾、脑等各项系数指标均在正常范围内,无明显差异。此外,心脏、肝脏、脾脏、肺及肾等主要器官与对照组相比也无结构变化或异常。
3.5 活性氧
二氧化硅表面的自由基可以与水反应产生活性氧(Reactive oxygen species,ROS),降低细胞内GSH 水平,引起氧化应激[69]。氧化应激可以损伤细胞成分,通过凋亡导致细胞死亡[70]。Passagne 等[71]合成了不同粒径(20 nm 和100 nm)的二氧化硅纳米粒子发现,20 nm 二氧化硅纳米粒子具有明显的细胞毒性,而100 nm 二氧化硅纳米粒子的毒性较小,通过对活性氧的产生评估分析氧化应激,结果表明氧化应激参与了粒径为20 nm 的二氧化硅的毒性作用,而粒径为100 nm 的二氧化硅低毒性的原因可能是由于抗氧化酶诱导细胞解毒的过程。Morishige等[72]发现粒径为100 nm 的二氧化硅(mSP 1000)诱导白细胞介素-1β(IL-1β)的产生依赖于ROS 的产生,IL-1β 可激活炎症复合物NLRP3,从而导致急慢性炎症疾病。此外,还比较了用不同官能团(-COOH,-NH2,-SO3H,-CHO)修 饰 的mSP 1000处理的THP-1 细胞中IL-1β 的产生水平,结果显示,经过表面修饰的mSP 1000 降低了ROS 的生成,从而抑制了IL-1β 的产生。除了通过破坏细胞膜和细胞器,ROS 还能通过破坏单链或双链DNA,影响其断裂和交联反应,诱导DNA 损伤,导致基因毒性。
3.6 基因毒性
MSNs 产生的基因毒性也是临床安全使用需要考虑的重要因素,已有研究发现,粒径为25 nm 和100 nm 的MSNs 在暴露24 h 后对人结肠癌HT-29 细胞产生有限的基因毒性效应[73]。当MSNs 的粒径小于8 nm 时,可以通过核孔复合体,在核内积聚,并在有丝分裂过程中与DNA 相互作用,产生基因毒性。微阵列分析显示,MSNs 显著改变了基因表达,与对照组人胚肾细胞(HEK293)相比,经浓度为120 μg/mL 的MSNs 处理后,579 个基因表达上调,1 263个基因表达下调,结果表明,MSNs 对正常人类细胞具有基因毒性,使某些基因的表达发生变化,导致细胞损伤或产生癌变细胞[74-75]。MSNs 的基因毒性还依赖于给药剂量。以50 mg/kg 的剂量连续三次静脉注射粒径为15 nm 的MSNs 给雄性大鼠,与单次注射25 mg/kg 的剂量相比,肝组织、肺组织和白细胞的DNA 损伤百分比随剂量增加而增加[76]。此外,MSNs 还可以跨越胎盘屏障,毒性潜伏在早期胚胎阶段。Pinto 等[77]发现磁性介孔二氧化硅纳米粒(粒径58 nm)能够通过胎盘屏障,且能够进入胎儿的血液中,可以被正在生长的器官代谢,并在胎儿的大脑、胃、胸腺、肝脏和肺吸收较高。表面功能化及电荷性对MSNs 基因毒性的影响还尚不明确,仍需要进一步的研究。
4 总结及展望
介孔二氧化硅现已被广泛用作药物载体,并在改善难溶性药物的溶解度、实现控制药物释放以及递送基因方面表现出了巨大的应用潜力。尽管MSNs已经得到了迅速的发展,但这些无机材料的生物学效应及安全性仍然不确定。第一,目前针对体内MSNs 及修饰后的MSNs 所引起的急性和慢性毒性的研究还不透彻,在进入临床应用之前,应掌握MSNs及功能化MSNs 的血液循环特性、体内清除时间、可能的免疫原性和组织内积累情况等必要信息。然而相关的毒性研究存在太多的变量,无法得出关于生物相容性的明确结论,还需要在以动物实验安全的基础上,增设人体内实验,密切关注MSNs 与体内细胞之间的生理作用,为MSNs 在生物医学领域的应用提供保障。第二,不同给药途径对MSNs 的药物代谢动力学和生物相容性有一定的影响。因此,除了静脉注射、皮下注射、肌肉注射、口服给药外,应探索更多的给药途径,如经皮给药、鼻腔给药等。此外,MSNs 的修饰、表面电荷性质、粒径大小、形状等对其药物代谢动力学、生物相容性和表面蛋白质电晕形成的影响也值得更加系统深入地研究。第三,MSNs 作为药物载体,可实现较高的载药量,但大规模生产是目前的一大难题。相信随着研究的不断深入和细化,这些问题都将会被解决,介孔二氧化硅材料真正用于药物递送系统和临床中指日可待。
