响应面法优化超声波提取浮萍多糖工艺研究
2019-12-04于忠娜王军刘桂伶王玉梅韩荣伟
于忠娜,王军,刘桂伶,王玉梅,韩荣伟*
(1.青岛农业大学海都学院,山东莱阳 265200;2.青岛农业大学食品科学与工程学院,山东青岛 266109)
浮萍(Common Duckweed Herb,Herba spirodelae)为浮萍科植物紫背浮萍(Spirodelapolyrrhiz(L.)Schleid)或青萍(LemnaminorL.)的全草,其生长周期短、繁殖快、喜阴喜湿等,其干燥的全草可以做家畜的饲料,在我国四川、浙江、湖北等地区的动物养殖中广泛分布并使用[1-3]。浮萍味辛,性寒,归肺经,有利尿消肿、发汗解表、止痒等功效。研究表明,浮萍中含有多糖、蛋白质、树脂、类脂、黄酮类化合物等多种物质,浮萍多糖是浮萍中重要的生物活性物质,具有免疫调节作用。而中兽药具有价格低廉、药物残留少、不会产生耐药性等优点,因而浮萍多糖在中兽药中的应用越来越受重视[4]。
国内对浮萍多糖的提取纯化方法研究较多,主要有堆热法、超滤法等,但这些方法对设备要求较高,技术工艺繁琐,费用较高[5-6]。本研究利用超声波的空化效应增加溶剂的穿透力,辅助浮萍多糖的提取[7-8],并通过Design-Expert软件进行响应面法设计,优化超声波辅助提取浮萍多糖的最佳提取工艺。
1 材料与方法
1.1 材料与试剂 浮萍干燥全草购于四川成都国际商贸城荷花池中药材专业市场,批号:20150416;去离子水,葡萄糖,浓硫酸,苯酚,乙醇,所用试剂均为分析纯,购于北京陆桥技术有限责任公司。
1.2 仪器与设备 FW100高速万能粉碎机,天津市泰斯特仪器有限公司;分样筛,浙江上虞市肖金化验仪器厂;SB25-12DTD型超声波清洗器,宁波新芝生物科技股份有限公司;302型电热鼓风干燥箱,中国山东龙口市先科仪器公司;TGL-16C高速台式离心机,上海安亭科学仪器厂;SHZ-Ⅲ型循环水真空泵,上海亚荣生化仪器厂;WFJ7200型紫外可见分光光度计,上海尤尼科仪器有限公司。
1.3 试验方法
1.3.1 提取方法 用高速万能粉碎机将干燥浮萍全草粉碎,过60目分样筛,备用。准确称取1.0 g浮萍粉末,加入去离子水,静置10 min,设定超声功率、时间、温度,进行超声波处理;超声处理后的样品8000 r/min离心10 min,收集上清液并抽滤,滤液中加95%乙醇(V∶V,1∶4)过夜后8000 r/min离心10 min得到沉淀;沉淀物放入60 ℃干燥箱中烘干得浮萍多糖粉末。
1.3.2 标准曲线的绘制 葡萄糖标准品在105 ℃烘干至恒重后,准确称取10.0 mg,加去离子水溶解并定容至100 mL,得到浓度为0.1 mg/mL的葡萄糖标准溶液。吸取葡萄糖标准溶液0 mL、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL,分别加入具塞试管中,加蒸馏水至2.0 mL,加5%苯酚1.0 mL,混匀,迅速加入5.0 mL浓硫酸,盖上塞,立刻摇匀,室温静置30 min后,以空白校正零点,用1 cm比色皿于490 nm处测定吸光度,平行3次并记录吸光度值,作出葡萄糖标准曲线,得到回归方程。多糖组分近似等于葡聚糖,故多糖回归方程为葡萄糖标准曲线回归方程系数乘以葡萄糖与葡聚糖间的转换系数0.9[9]。
1.3.3 多糖提取率的测定与计算 准确称取1.0 g过分样筛的干燥浮萍粉末,加入一定质量的去离子水,静置10 min,设置一定的超声功率、超声时间、温度,进行超声波处理,将经过超声波处理完的样品用台式离心机8000 r/min离心10 min,收集上清液并抽滤。应用苯酚-硫酸法测滤液中的多糖含量[10],多糖提取率计算方法见公式(1)。
(1)
式中:R为多糖提取率;c为滤液中的多糖浓度;n为稀释倍数;V为滤液总体积;m为浮萍原料质量。
1.3.4 产品纯度的测定与计算 精密称取所得浮萍多糖粉末50.0 mg,加去离子水溶解并定容至250 mL。吸取上述溶液1.0 mL加入具塞试管(蒸馏水,做空白对照),补水至2.0 mL,加入5%苯酚溶液1.0 mL,迅速加入5.0 mL浓硫酸,盖上塞,立刻摇匀,静置30 min后,于490 nm处测定吸光度。再以多糖为对照,通过标准曲线求得多糖含量,计算方法见公式(2)。
(2)
式中:C为样品纯度;m1为产品中的多糖质量;m2为待测样品质量。
1.3.5 单因素试验 按照1.3.1浮萍多糖提取工艺流程,考察料液比、超声波提取时间、超声波功率、提取温度以及提取次数等因素对浮萍多糖提取率的影响。具体操作如下:
(1)准确称取6份干燥浮萍粉末(1.0 g/份),设定超声波功率400 W、超声波提取时间 80 min、超声波提取温度50 ℃,提取次数1次等条件下,考察1∶20、1∶30、1∶40、1∶50、1∶60、1∶70等不同料液比对浮萍多糖提取率的影响。
(2)准确称取6份干燥浮萍粉末(1.0 g/份),设定料液比1∶50、超声波功率400 W、超声波提取温度50 ℃、提取次数1次等条件下,考察20 min、40 min、60 min、80 min、100 min、120 min等不同提取时间对浮萍多糖提取率的影响。
(3)准确称取6份干燥浮萍粉末(1.0 g/份),设定料液比1∶50、超声波提取温度50 ℃、超声波提取时间 80 min、提取次数1次等条件下,考察250 W、300 W、350 W、400 W、450 W、500 W等不同超声功率对浮萍多糖提取率的影响。
(4)准确称取6份干燥浮萍粉末(1.0 g/份),设定料液比1∶50、超声波功率400 W、超声波提取时间 80 min、提取次数1次等条件下,考察20 ℃、30 ℃、40 ℃、50 ℃、60 ℃、70 ℃等不同提取温度对浮萍多糖提取率的影响。
(5)准确称取4份干燥浮萍粉末(1.0 g/份),设定料液比1∶50、超声波功率400 W、超声波提取时间 80 min、超声波提取温度50 ℃等条件下,考察1次、2次、3次、4次等不同提取次数对浮萍多糖提取率的影响。
1.3.6 工艺优化试验设计 根据单因素实验结果,采用Design-Expert 8.0基于Box-Behnken中心组合的设计原理,料液比(A)、超声时间(B)和超声功率(C)为自变量(表1),以浮萍多糖提取率为响应值进行响应面设计[11],优化浮萍多糖的提取工艺,实验方案见表2。通过对实验数据进行回归分析,拟合如下模型:
Y=n0A2+n1B2+n2C2+n3AB+n4AC+n5BC+
n6A+n7B+n8C+n9
(3)
式中:Y为响应值,A、B、C为自变量,n0~n9为系数[12]。
2 结果与分析
2.1 标准曲线 由测定结果计算出葡萄糖标准曲线回归方程为:y=15.957x+0.00057,R2=0.99921。多糖组分近似等于葡聚糖,而葡萄糖与葡聚糖间的转换系数为0.9,故上述方程可校正为:y=14.361x+0.00051,R2=0.99921。以多糖浓度(mg/mL)为横坐标,吸光度A为纵坐标,绘制标准曲线,结果见图1。
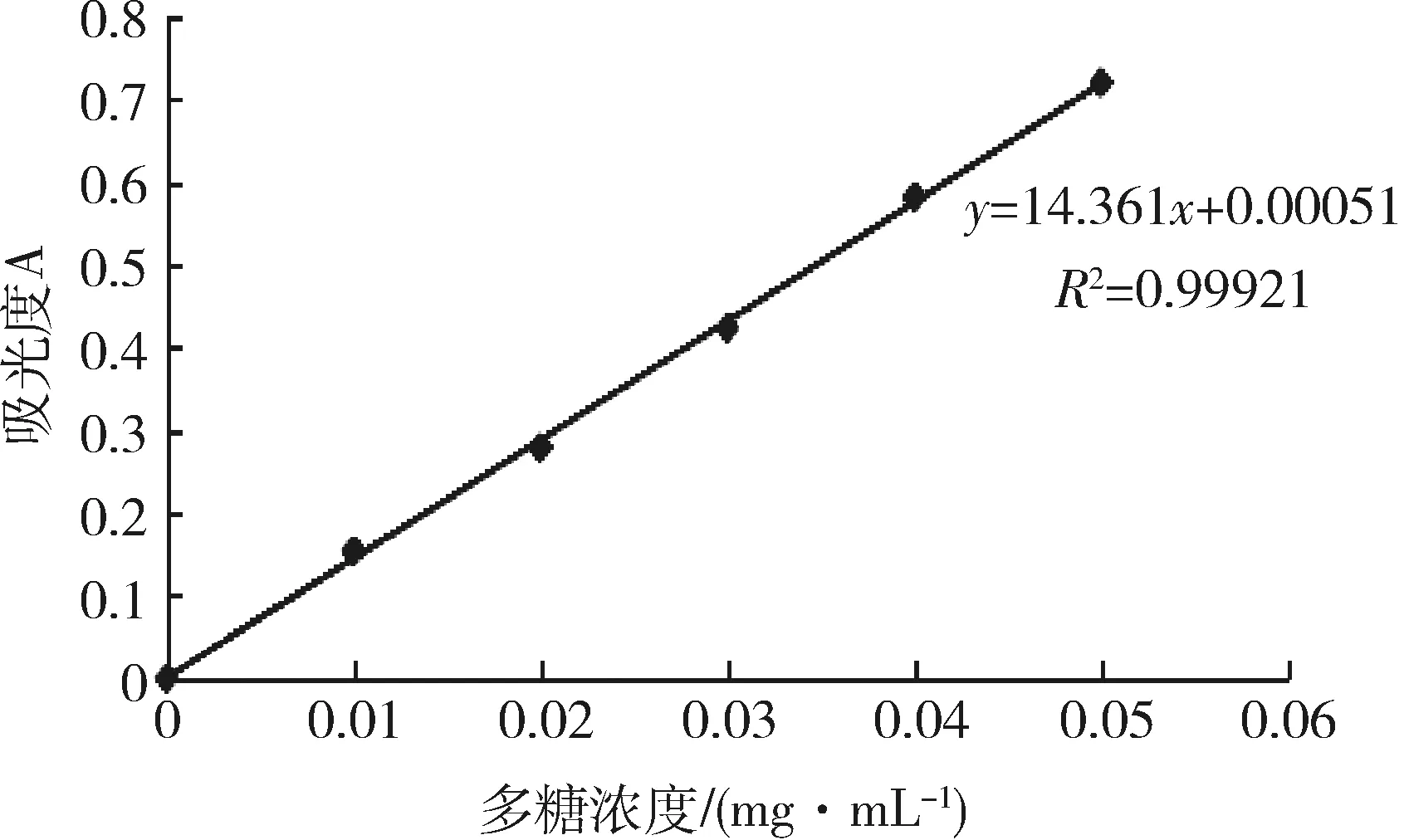
图1 标准曲线Fig 1 The standard curve
2.2 单因素试验结果分析
2.2.1 料液比对浮萍多糖提取率的影响 不同料液比对多糖提取率的影响结果见图2。
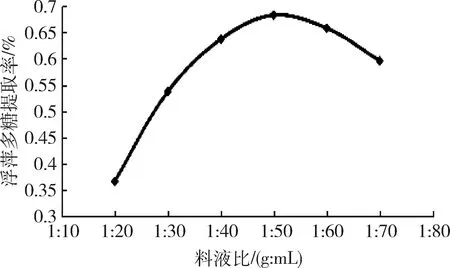
图2 料液比对浮萍多糖提取率的影响Fig 2 Effect of solid-liquid ratio on the extraction rate of polysaccharides duckweed
由图2可知,料液比在1∶20~1∶50之间时,浮萍多糖的提取率随料液比的增大而提高,在料液比为1∶50时达到最大,之后随料液比的增大而降低。这是因为随着溶剂量的增大,超声波需要处理的液体增多,使多糖的分离效率降低,多糖的损失率增加[13],故本试验选择料液比因素水平为1∶40、1∶50和1∶60。
2.2.2 超声波提取时间对浮萍多糖提取率的影响不同超声波提取时间对多糖提取率的影响结果见图3。
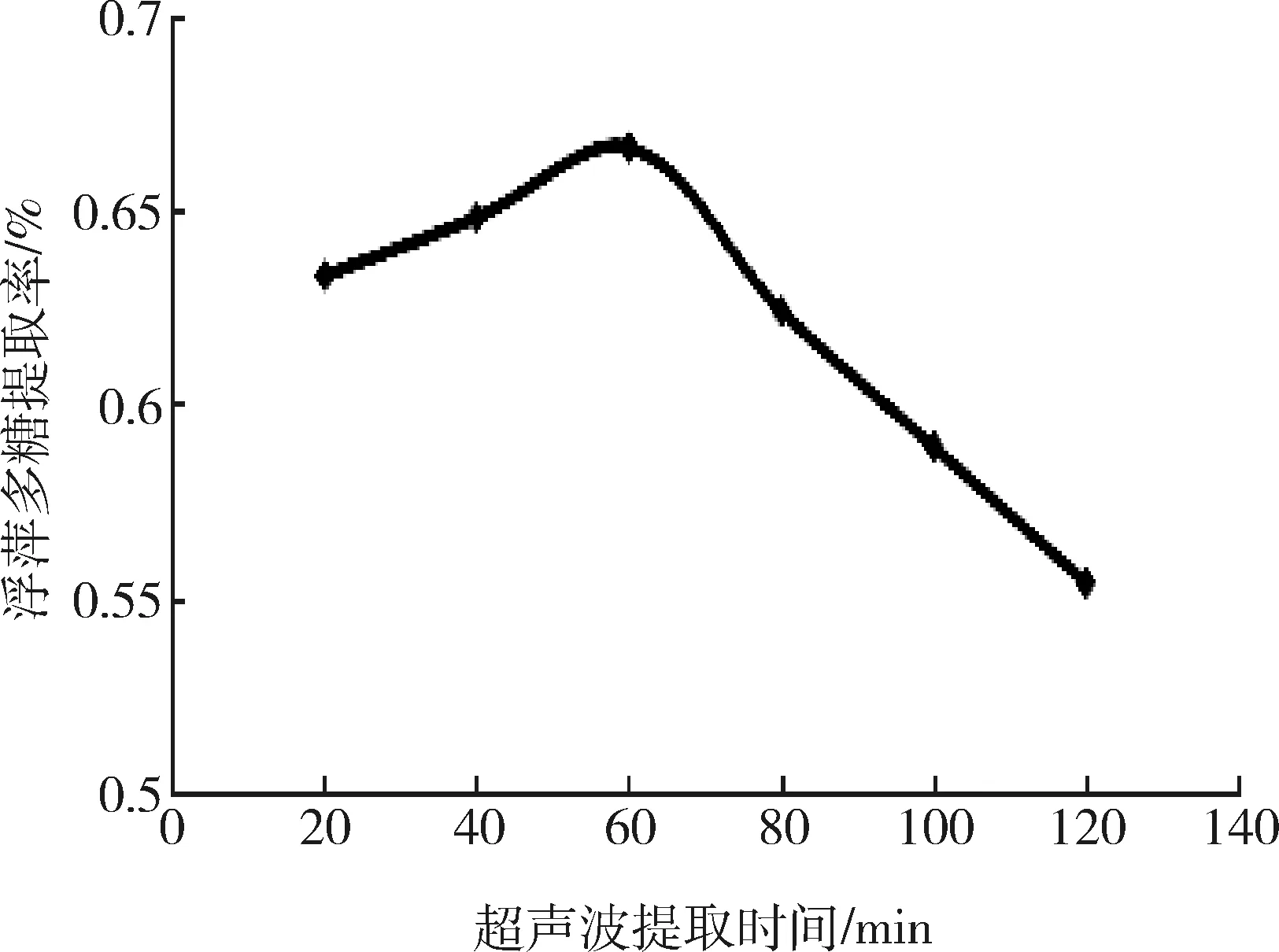
图3 超声波提取时间多浮萍多糖提取率的影响Fig 3 Effect of extraction time on the extraction rate of polysaccharides duckweed
由图3可知,在超声波提取时间试验条件范围内,浮萍多糖的提取率随着时间的延长呈现出先上升后下降的趋势,在超声波提取时间为60 min时达到最大。这是因为过长时间的超声波处理会引起热量积聚或机械剪切作用而破坏多糖的结构;同时,提取时间的增加也会导致能耗增加[14],因此本试验选择的超声提取时间因素水平为40 min、60 min和80 min。
2.2.3 超声波功率对浮萍多糖提取率的影响 不同超声波功率对浮萍多糖提取率的影响结果见图4。可见,在超声波功率试验条件范围内,浮萍多糖的提取率随着超声波功率的增加呈现出先上升后下降的趋势,并在超声波功率为350 W时达到最大。这是因为超声波功率过低,细胞破碎效能不足,而功率过大导致浮萍多糖结构发生破坏或者使其降解[15],所以本试验中的超声波功率因素水平定为300 W、350 W和400 W。
2.2.4 超声波提取温度对浮萍多糖提取率的影响不同提取温度对多糖提取率的影响结果见图5。
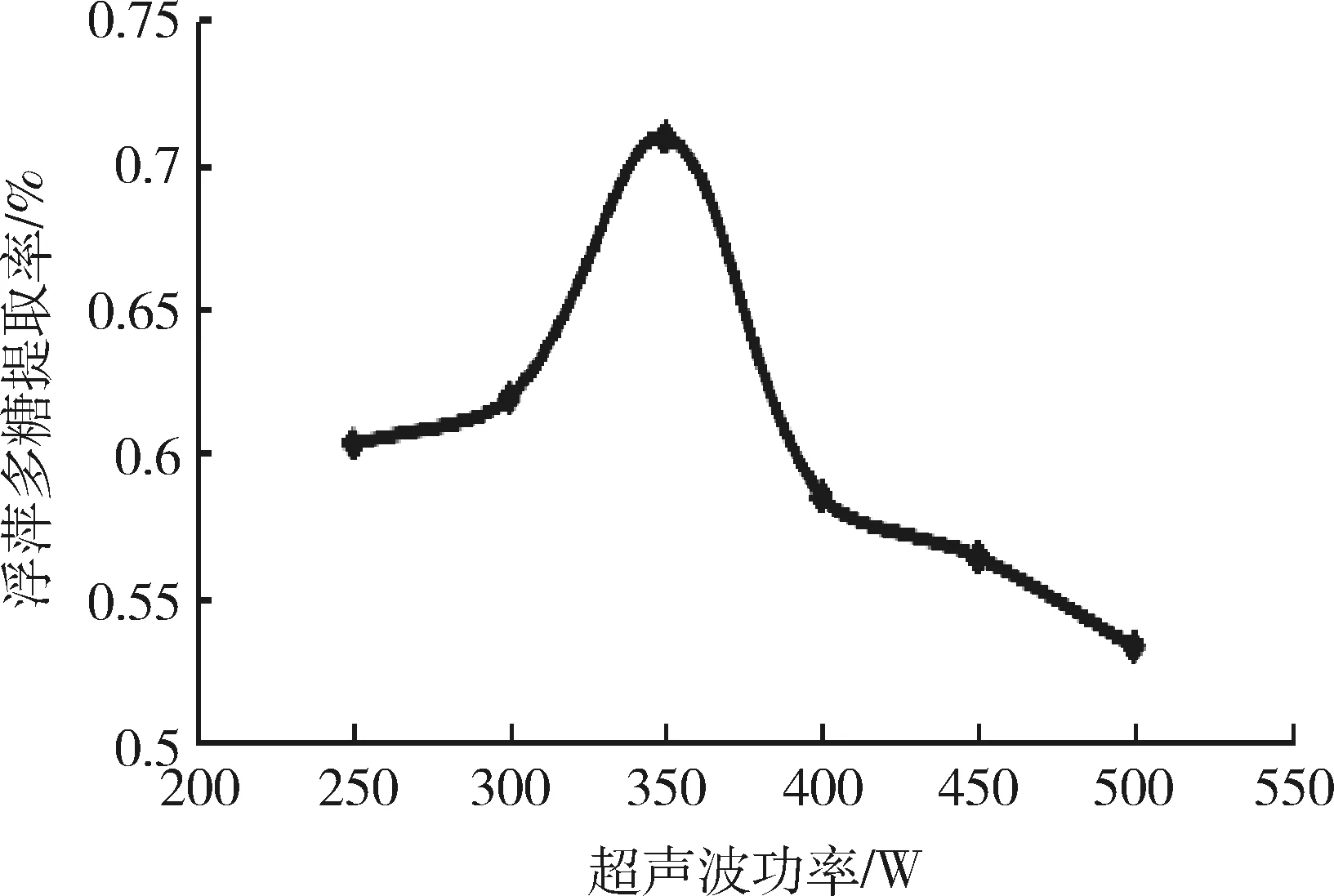
图4 超声波功率对浮萍多糖提取率的影响Fig 4 Effect of ultrasonic power on the extraction rate of polysaccharides duckweed
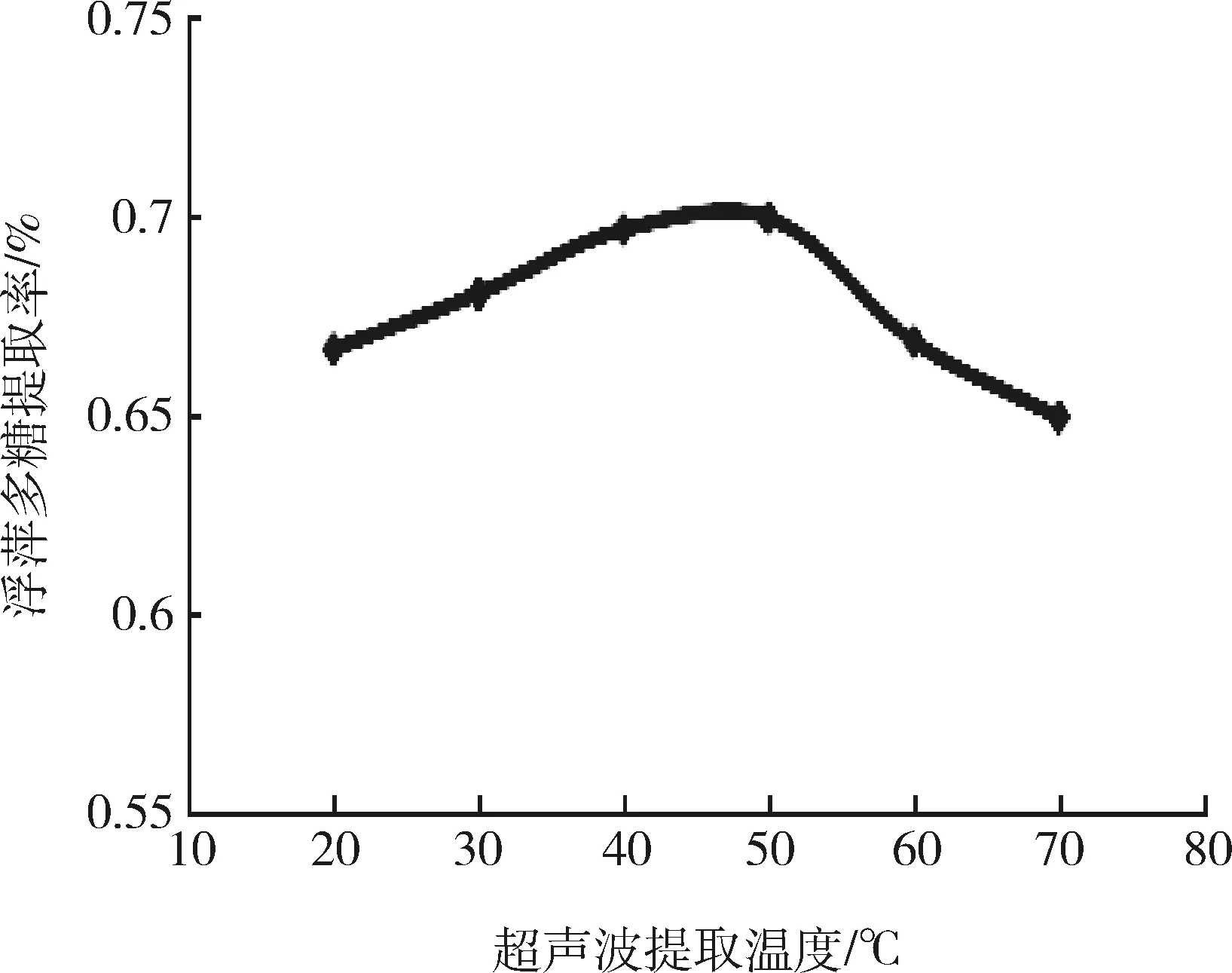
图5 超声波提取温度对浮萍多糖提取率的影响Fig 5 Effect of ultrasonic extraction temperature on the extraction rate of polysaccharides duckweed
由图5可知,在超声波提取温度试验条件范围内,浮萍多糖的提取率随着超声波温度的升高呈现出先上升后下降的趋势,并在超声波提取温度为50 ℃时达到最大。这是因为提取温度过高,多糖会发生降解,影响浮萍多糖的提取率[16],所以本试验中的最佳超声波提取温度选择为50 ℃。
2.2.5 提取次数对浮萍多糖提取率的影响 不同提取次数对多糖提取率的影响结果见图6。
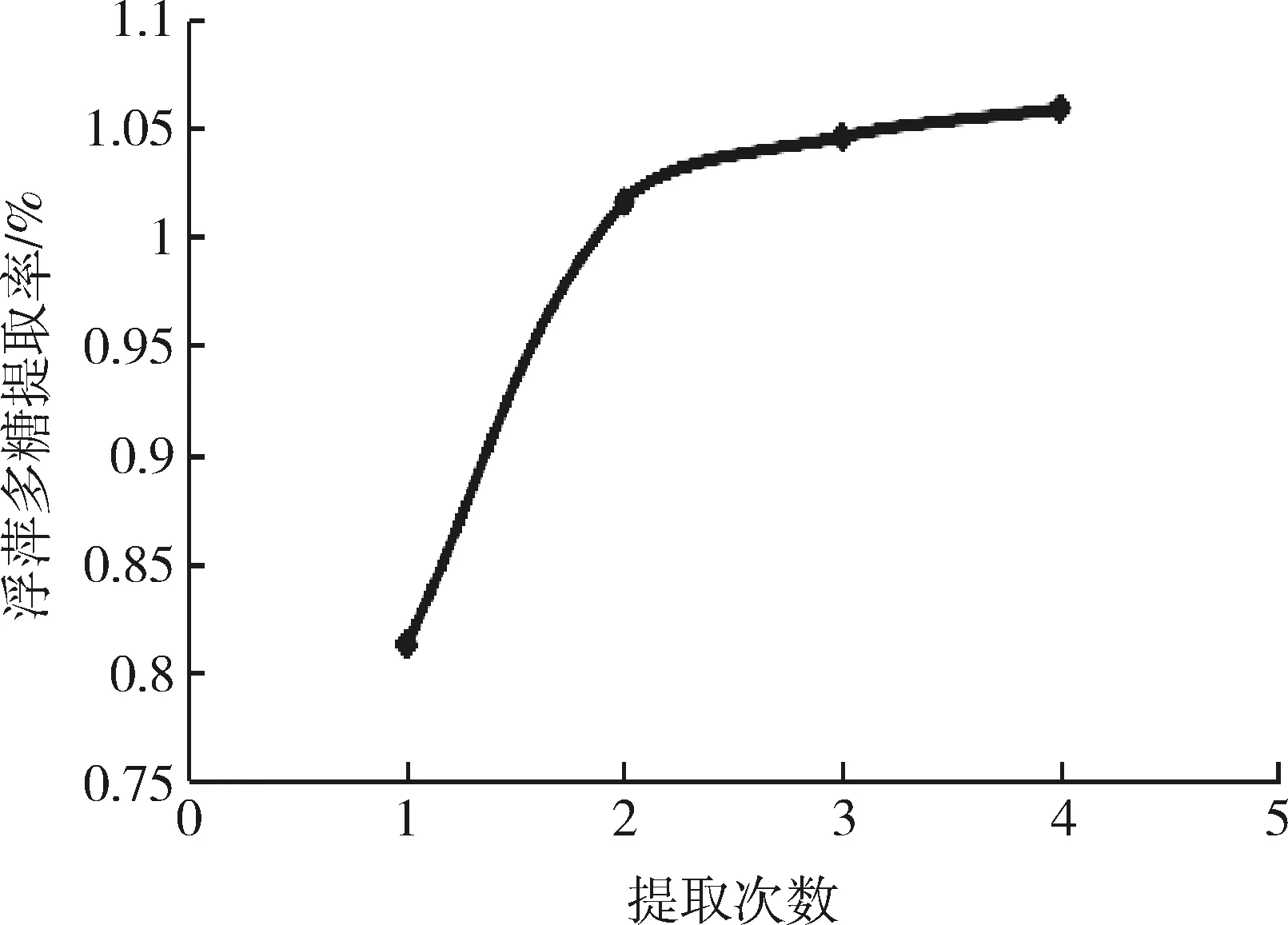
图6 提取次数对浮萍多糖提取率的影响Fig 6 Effect of extraction times on the extraction rate of polysaccharides duckweed
由图6可知,提取次数1~2次时,浮萍多糖的提取率有显著的提高,但第3、4次,浮萍多糖的提取率有提高,但不显著,结合实际成本考虑,故本试验选择提取2次为最佳提取次数。
2.3 响应面优化试验结果
2.3.1 优化实验因素的选取 根据单因素实验结果,选取料液比、超声时间和超声功率为自变量,以浮萍多糖提取率为响应值进行响应面试验设计(表1)。
2.3.2 响应面模型的建立及分析 运用Design-Expert进行三因素三水平的响应面试验设计,共17个试验点,其中12个为分析因子,5个为中心试验用以估计误差。试验结果见表2。
根据得到的试验数据,运用Design-Expert对试验结果进行多远回归拟合,得到浮萍多糖提取率对试验自变量的二次多项回归方程:多糖提取率Y=-0.019A2-0.0065B2+0.0025C2-0.0008AB-0.0013AC+0.016BC+0.060A-0.036B+0.055C+1.01。
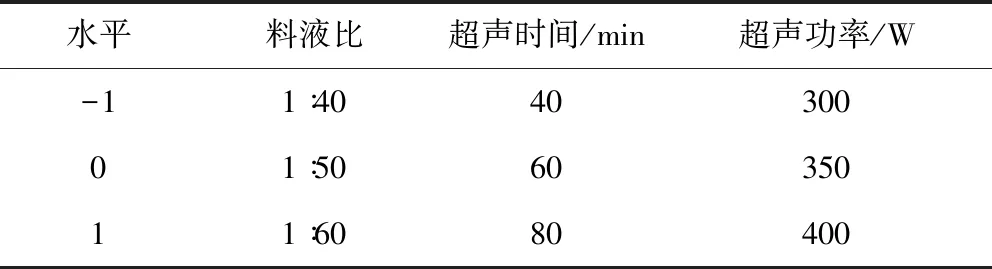
表1 响应面试验因素水平表Tab 1 The response surface experiment factors and levels

表2 响应面试验设计结果表Tab 2 Design and Results of the response surface experiment result
方程中各项系数绝对值的大小直接反映各因素对响应值的影响程度,系数的正、负反映了影响的方向[17]。由方程的一次项系数可以得出,影响浮萍多糖提取率的因素的主次顺序为:料液比、超声功率、超声时间,响应面试验结果方差分析见表3。

表3 响应面试验结果方差分析表Tab 3 ANOVA results of the response surface experiment
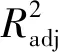
2.3.3 响应曲面分析 利用Design Expert 软件对表2数据进行拟合,所得到的响应面及其等高线图见图7-图9。通过等高线的形状可以判断因素之间交互效应的强弱,圆形标识两因素交互作用可以忽略,而椭圆形表示两因素交互作用显著[18]。根据浮萍多糖提取过程中各因素的两两交互作用确定各因素的最佳水平范围。
由图7等高线图可知水料比和超声时间的交互作用对浮萍多糖提取率的影响不显著。曲面图中显示,在所选的实验范围内存在多糖提取率的极值;水料比对于浮萍多糖提取率的影响较超声时间显著。
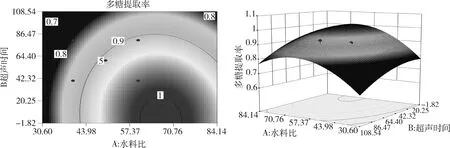
图7 水料比和超声时间的相互作用及等高线分析图Fig 7 The ratio of water and ultrasonic time interaction and contour analysis chart

图8 水料比和超声功率的相互作用及等高线分析图Fig 8 The ratio of water and the interaction of ultrasonic power and contour analysis chart
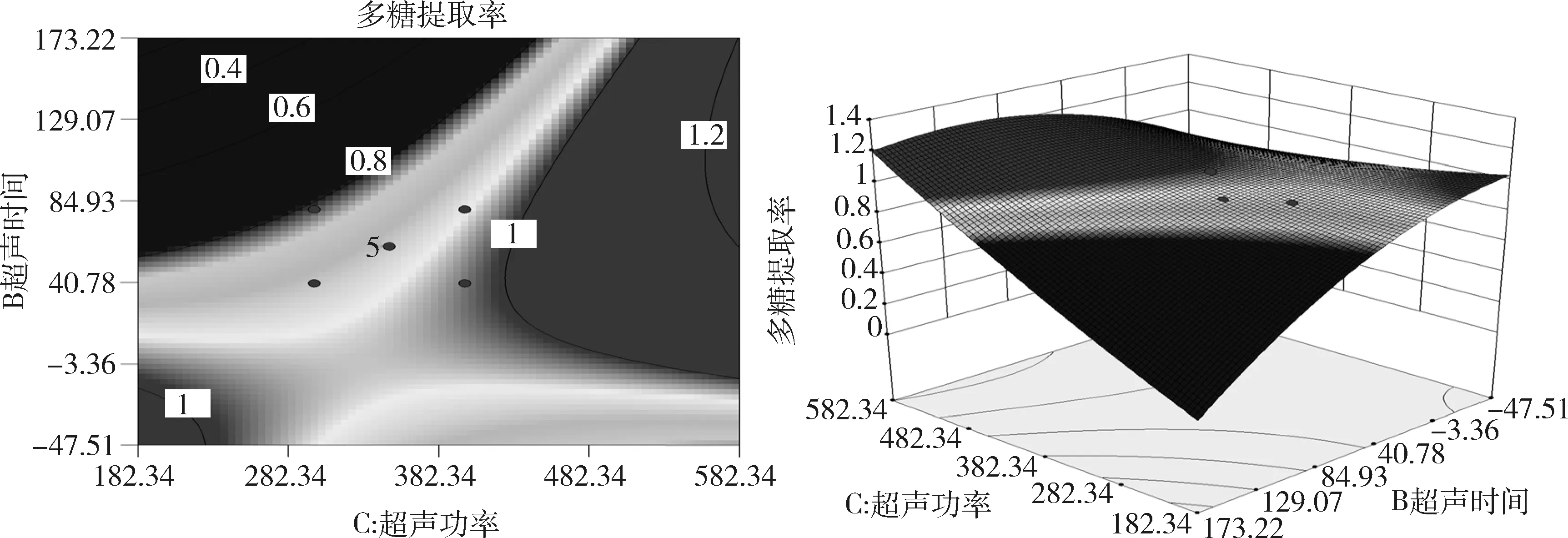
图9 超声时间和超声功率的相互作用及等高线分析图Fig 9 Interaction of ultrasonic time and ultrasonic power and contour maps
由图8等高线图和曲面图可知,水料比和超声功率的交互作用对浮萍多糖提取率影响较为显著,水料比对于浮萍多糖提取率的影响较超声功率显著。
由图9等高线图和曲面图可知,超声时间和超声功率的交互作用对浮萍多糖提取率的影响显著;超声功率对于浮萍多糖提取率的影响较超声时间显著。
综上可知,对浮萍多糖提取率的影响程度从大到小依次为料液比、超声功率和超声时间。通过响应面优化分析,得到浮萍多糖最大提取率为1.188%,提取浮萍多糖的最佳工艺条件为料液比1∶40.06、超声时间79.58 min、超声功率341.37 W。
2.3.4 响应面试验模型验证 在上述优化的提取条件下,浮萍多糖提取率的理论值可达到1.188%。为了检验此最佳工艺条件的可靠性,考虑到实际操作的便利,将最佳工艺条件改为:料液比1∶40、超声时间80 min、超声功率340 W,做3组平行试验,进行验证,结果如表4所示,得到的多糖提取率的平均值为1.125%,与模型理论预测值仅相差0.063%,因此,采用响应面分析优化得到的提取条件参数准确可靠,可用于实际操作。

表4 多糖提取验证试验结果Tab 4 Polysaccharide extraction and verification
2.4 多糖含量测定结果 根据响应面试验中得到的最佳提取条件,采用苯酚-硫酸法测定样品(粗多糖粉末)中的多糖含量,结果见表5。
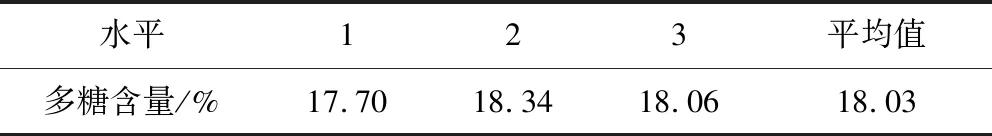
表5 多糖含量测定结果Tab 5 Polysaccharide content determination results
超声波法提取浮萍多糖测得的样品纯度为18.03%,国内堆热法提取浮萍多糖测得的样品纯度为15%~30%。相比可发现,提取的多糖的纯度仍需要提高。
3 讨 论
浮萍其营养价值很高,而蛋白、脂肪含量均超过其他水草[19]。本研究运用超声波辅助提取浮萍多糖,运用了超声波的空化效应,大大地增加了溶剂的穿透力,加深需提取成分的在溶液中的释放扩散,提高了物质的提取速度和工作效率。
通过响应面设计,优化浮萍多糖的提取工艺,试验值与模型理论预测值仅相差0.063%。因此采用响应面分析优化得到的提取条件参数准确可靠,可用于实际操作。葛星星等曾用该方法对豆薯多糖进行工艺优化[20], 徐仰丽等也用该方法对虾壳进行脱盐处理[21],都获得了较高的提取率和纯度,说明该方法切实可行。所以在浮萍多糖提取方面需要继续优化工艺,这也是该实验正在进行的后续探索。
超声波法提取浮萍多糖测得的样品纯度与国内堆热法[5]和超滤法提取浮萍多糖[6]测得的样品纯度相比可发现,在多糖提取率和多糖纯度方面仍需要提高,但本实验降低了设备需求,技术流程相对简单,更适合工业应用。另外,在葛星星、徐仰丽等进行的实验中,他们在单因素实验选取数据进行响应面优化时选择的数据段与该实验不同,可能这是导致该实验纯度相对较低的原因。后续工作将在不破坏多糖活性的前提下,改进试验过程,提高样品提取率和纯度。
