巨大芽孢杆菌L2发酵产物对魔芋软腐病菌的抑菌机制
2019-12-03赵妗颐吉玉玉
赵妗颐,肖 洋,杨 龙,张 素,吉玉玉,李 祝,*
(1.贵州大学生命科学学院/农业生物工程研究院,山地植物资源保护与保护种质创新教育部重点实验室,山地生态与农业生物工程协同创新中心,贵州 贵阳 550025;2.贵州省产品质量检验检测院,贵州 贵阳 550003)
魔芋(Amorphophallus konjacK. Koch)又名蒟蒻、鬼芋等,隶属天南星科魔芋属,为多年生草本植物[1],为我国西南地区重要经济作物。魔芋球茎中含有葡甘聚糖、淀粉、粗纤维和各种氨基酸、蛋白质等物质[2-3],其加工产物魔芋胶、魔芋粉等已被广泛用作天然、健康、安全的食品原料[4]。但魔芋球茎水分含量高,易破损、腐烂、病变,在保藏期间对湿度、温度的要求高,容易受到病原菌的侵染[5],其中胡萝卜软腐欧文氏菌(Erwinia carotovorasubsp.carotovora)引起的细菌性病害——魔芋软腐病是导致贮藏期魔芋腐烂变质的主要原因之一,病菌可从伤口侵入魔芋体内[6-7]。而目前贮藏期魔芋软腐病主要依靠农用链霉素来防治[8],但随着人类对食品安全问题的日益重视,化学防治方式被在采后农产品上的应用严格限制,因此寻求更加安全的采后农产品病害防治方法对控制魔芋贮藏期软腐病具有十分重要的意义。
巨大芽孢杆菌(Bacillus megaterium)作为食品工业技术中非常重要的微生物,在控制水稻纹枯病、番茄灰霉病、花生贮藏期中的黄曲霉等病害防治中得到广泛应用[9-11],并且其产生的谷氨酸脱羧酶可催化谷氨酸生成γ-氨基丁酸[12],该氨基酸作为哺乳动物神经系统中重要的神经传递素,具有降低血压、镇静、利尿等功能[13-14]。
本研究通过常压硅胶柱层析得到巨大芽孢杆菌发酵产物各流分,经检测,流分LE4-3对贮藏期魔芋软腐病原菌——胡萝卜软腐欧文氏菌EC-1(以下简称EC-1)有良好抑制作用,并经气相色谱-质谱(gas chromatographymass spectrometry,GC-MS)分析其成分,再对其抑菌机理进行研究,着重考察该活性流分对EC-1细胞膜通透性、大分子物质核酸和蛋白含量变化、可溶性总糖质量浓度、菌体总蛋白、菌体磷代谢和活性氧(reactive oxygen species,ROS)水平变化的影响,旨在为贮藏期魔芋软腐病的控制提供一定的应用理论参考和依据。
1 材料与方法
1.1 菌株、材料与试剂
巨大芽孢杆菌(Bacillus megaterium)L2(CCTCC No. M2012381)由贵州大学真菌资源研究所分离,保藏于中国典型培养物保藏中心。EC-1由贵州大学微生物所分离、鉴定并保存。
牛肉膏蛋白胨液体培养基:牛肉膏3 g、蛋白胨10 g、氯化钠5 g、蒸馏水1 000 mL;发酵液体培养基:蛋白胨25 g、牛肉膏4.58 g、氯化钠3.21 g、葡萄糖15 g、蒸馏水1 000 mL。
ROS检测试剂盒 上海碧云天公司。
1.2 仪器与设备
DDB303A电导率仪 上海雷磁仪器厂;CAMX PLUS酶标仪 美国Molecular Devices公司;BIOMATE 3S紫外分光光度计 美国Thermo Fisher公司;JY300HE电泳仪 北京君意东方电泳设备有限公司;7890A/5975C型GC-MS仪 美国Agilent Technologies公司。
1.3 方法
1.3.1 巨大芽孢杆菌发酵产物的提取及分析
1.3.1.1 巨大芽孢杆菌菌粉的制备
巨大芽孢杆菌L2种子液的制备:接种一环巨大芽孢杆菌L2于装有100 mL牛肉膏蛋白胨培养基的250 mL锥形瓶中,30 ℃、150 r/min培养24 h,使其OD600nm为0.6~0.8。
将上述巨大芽孢杆菌L2种子液按体积分数6%的接种量接种于装有80 L发酵液体培养基的发酵罐中,在30 ℃、150 r/min、通气量为1.5 L/min的条件下培养48 h,发酵液经喷雾干燥制成菌粉备用。
1.3.1.2 巨大芽孢杆菌发酵产物的提取及常压硅胶柱层析分离
取500 g菌粉加入1.5 L工业乙醇于60~100 ℃回流提取4 h,重复3 次得巨大芽孢杆菌粗提液,将该粗提液减压浓缩后加水溶解,再通过乙酸乙酯萃取,萃取液经减压浓缩后得到的浸膏(19.23 g)与40~80 目硅胶拌样,挥干溶剂上样,在硅胶层析柱上进行常压硅胶柱层析。分别用石油醚-乙酸乙酯(100∶0、100∶1、50∶1、20∶1、10∶1、5∶1、2∶1、1∶1,V/V)、乙酸乙酯-甲醇(30∶1、20∶1、10∶1、5∶1、2∶1、1∶1、1∶0,V/V)进行梯度洗脱,每个梯度柱层析体系为10 L,分段收集洗脱液。通过薄层层析色谱(thin layer chromatography,TLC)结果及Rf值判断,体积分数5%的浓硫酸-乙醇溶液和0.8 g/100 mL磷钼酸-乙醇溶液显色综合分析,将相同主点流分合并得17 个段:LE1~LE17。TLC展开体系选取石油醚-乙酸乙酯(50∶1,V/V),展开3 次,主点Rf值为0.3的流分LE4(2.721 7 g)继续进行常压硅胶柱层析。分别用石油醚-乙酸乙酯(80∶1、60∶1、40∶1、20∶1,V/V)、甲醇进行洗脱,并通过TLC及显色分析将LE4流分冲柱合并得7 个段:LE4-1~LE4-7,分段收集洗脱液,置于4 ℃冰箱备用。
1.3.1.3 LE4-1~LE4-7对EC-1抑菌作用的测定
LE4-1~LE4-7用二甲基亚砜(dimethyl sulphoxide,DMSO)配制成200 mg/mL的母液备用。分别在牛肉膏蛋白胨液体培养基中以体积分数10%的接种量接入EC-1种子液(OD600nm为0.6~0.8),再分别加入LE4-1~LE4-7母液,使其终质量浓度均为2.0 mg/mL,并以无菌水为空白对照、氯霉素为药物对照、DMSO为溶剂对照,30 ℃、150 r/min恒温摇床培养24 h后于490 nm波长处测定吸光度,并按下式计算抑菌率。

1.3.1.4 LE4-3的GC-MS分析
脂肪酸甲酯化:称取50 mg LE4-3,加入2 mL体积分数1%的硫酸-甲醇溶液,超声振荡10 min后置于70 ℃水浴30 min取出,加入2 mL正己烷,振荡5 min后取上清液加入0.5~1.0 g无水硫酸钠及5 mL饱和NaCl溶液,振荡1 min,静置5 min,取上层溶液用0.22 μm有机滤膜过滤,备用。
GC-MS条件:取LE4-3直接进样1 µL,色谱柱为AB-INOWAX毛细管柱(30 m×0.25 µm,0.25 mm);初始温度50 ℃保持2 min,以5 ℃/min升温至240 ℃后,保持15 min,运行时间55 min;汽化室温度250 ℃;载气为高纯He(纯度99.999%);柱前压7.65 psi,载气流量1.0 mL/min,不分流,溶剂延迟时间5.0 min。离子源为电子轰击离子源,离子源温度230 ℃,四极杆温度150 ℃,电子能量70 eV,发射电流34.6 µA,倍增器电压1 624 V,接口温度280 ℃,质量范围29~500 amu。
1.3.2 LE4-3的抑菌机制分析
1.3.2.1 LE4-3 IC50的测定
按1.3.1.3节方法测定LE4-3与氯霉素的半数抑制质量浓度(half maximal inhibitory concentration,IC50)。LE4-3终质量浓度设置为0.6、0.8、1.0、1.2、1.4 mg/mL,氯霉素为0.06、0.08、0.1、0.2、0.4 mg/mL,并用SPSS Statistics 19.0软件分别计算两者的IC50。
1.3.2.2 菌液电导率的测定
根据宋丽雅等[15]的方法,将菌悬液(OD600nm为0.6~0.8)按体积分数10%的接种量接种于牛肉膏蛋白胨液体培养基中,并加入LE4-3母液使其终质量浓度为IC50,于30 ℃、150 r/min摇床中振荡培养。在培养0、10、20、30、40、50、60 min时,各取5 mL培养液经5 000 r/min离心5 min后取上清液测其电导率。以无菌水为空白对照,氯霉素为药物对照,每组设3 个平行,下同。
1.3.2.3 核酸蛋白质泄漏的测定
根据刘国荣等[16]的方法,并按1.3.2.2节方法处理样品,在培养0、2、4、6、8、10、12 h时,各取3 mL培养液,经4 500 r/min离心5 min后取上清液分别在260 nm和280 nm波长处测定光密度值。
1.3.2.4 可溶性总糖质量浓度的测定
葡萄糖质量浓度标准曲线的绘制参考文献[17]:精确量取1.0 mg/mL葡萄糖标准溶液0.0、0.1、0.2、0.3、0.4、0.6、0.8 mL于不同试管中,分别加入蒸馏水至总体积为1.0 mL,摇匀后取50 μL加入200 μL蒽酮试剂,冰浴5 min,沸水浴10 min,冷却至室温,用酶标仪于630 nm波长处测定吸光度。以葡萄糖质量浓度为横坐标(mg/mL),吸光度为纵坐标,绘制标准曲线,得到葡萄糖质量浓度标准曲线方程y=3.906 0x+0.056 9,决定系数R2=0.999 1,具有良好线性关系,满足样品测试要求。
可溶性总糖质量浓度的测定采用蒽酮比色法。根据钱丽红等[18]的方法,并按1.3.2.2节方法处理样本,分别在培养0、2、4、6、8、10、12 h时,各取1 mL菌液10 000 r/min离心5 min后取50 μL上清液,按上述方法操作,用酶标仪于630 nm波长处测定吸光度。将所测吸光度代入葡萄糖标准曲线方程,计算可溶性总糖质量浓度。
1.3.2.5 SDS-PAGE分析
十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)参照吴海霞[19]的方法并作改动:按1.3.2.2节方法处理样品,分别在培养0、4、8、12 h时取菌悬液1 mL,12 000 r/min离心2 min,弃上清液,无菌水洗涤沉淀2 次,加入40 μL 2×上样缓冲液,沸水浴10 min,离心取上清液。采用质量分数12%分离胶、质量分数5%浓缩胶,电极缓冲液为5×Tris-甘氨酸,上样量10 μL,电压85 V,电流100 mA,时间1.5~2.0 h,质量分数0.5%考马斯亮蓝R-250染液过夜染色,脱色液为乙醇-醋酸-水溶液(10∶5∶85,V/V),脱色完成后使用凝胶成像仪拍照并分析。
1.3.2.6 LE4-3对EC-1菌体磷代谢的影响
磷标准曲线的绘制:精确量取500 μg/mL磷标准溶液0.0、0.1、0.2、0.3、0.4、0.6、0.8 mL于不同试管,分别加入蒸馏水至总体积为1.0 mL,摇匀取0.1 mL加入1 mL三氯乙酸-硫酸亚铁溶液反应10 min,4 000 r/min离心5 min,取0.2 mL上清液加50 µL钼酸铵溶液,混匀,30 ℃水浴15 min,冷却至室温,用酶标仪于630 nm波长处测定吸光度。以标准磷质量浓度为横坐标(μg/mL),以吸光度为纵坐标,得到磷质量浓度标准曲线方程为y=0.003 7x+0.069 3,决定系数R2=0.995 6,具有良好线性关系,满足样品测试要求。
菌体磷质量浓度的测定参考翟培等[20]的方法并作改动。将EC-1菌悬液4 000 r/min离心5 min弃上清液,无菌水洗涤菌体2 次,并稀释菌体至OD600nm为0.5。取0.5 mL稀释菌液于试管中,按体积比1∶1加入1.0 mg/mL葡萄糖溶液,摇匀加入200 µL 500 μg/mL磷标准溶液,并加入LE4-3母液使其终质量浓度为IC50,依次培养至0、2、4、6、8、10、12 h时,取0.1 mL菌悬液按上述方法进行测定,并用酶标仪于630 nm波长处测定吸光度。将所测吸光度代入磷质量浓度标准曲线方程,计算磷质量浓度。
1.3.2.7 ROS水平的测定
严格按照ROS检测试剂盒说明书检测LE4-3处理菌体内ROS水平,以无菌水为空白对照,Rosup为阳性对照,每组设3 个平行。以2’,7’-二氯荧光素的荧光强度表示菌体细胞内ROS水平,荧光强度越强表明ROS水平越高。采用Image J软件进行荧光强度定量分析。
1.4 数据处理与分析
实验数据用Microsoft Excel 2010软件进行数据分析,用Image J 17.0软件对荧光定量数据进行采集,采用SPSS Statistics 19.0软件进行统计分析,采用Duncan’s法对各测定数据进行显著性检验,所有实验设3 个平行,结果以表示。
2 结果与分析
2.1 LE4-1~LE4-7对EC-1的抑制作用
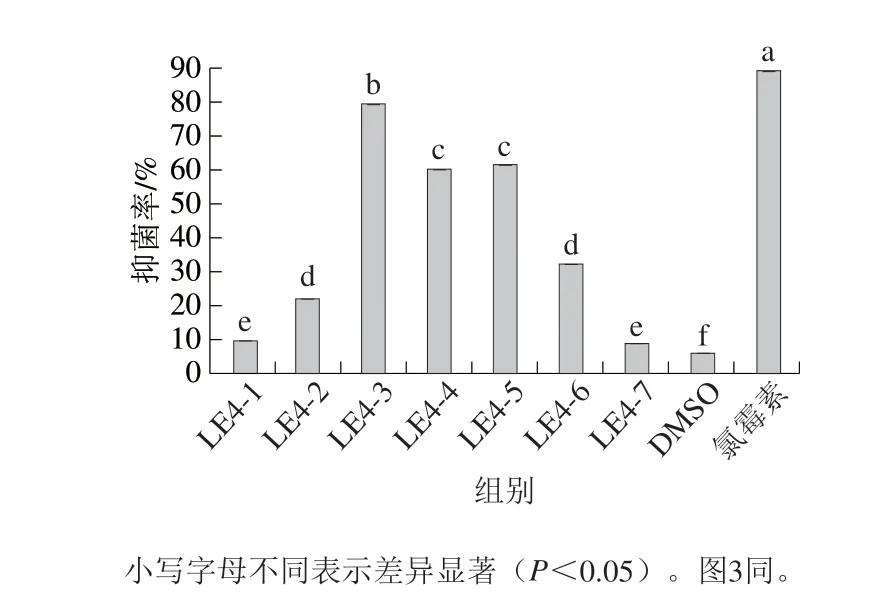
图 1 流分LE4-1~LE4-7对EC-1的抑制作用Fig. 1 Inhibitory effect of the fraction LE4-1-LE4-7 on action on EC-1
由图1可知,流分LE4-3、LE4-4、LE4-5对EC-1的抑菌效果较好,其中LE4-3的抑菌率最高,为(79.40±0.47)%,且与LE4-4、LE4-5差异显著(P<0.05)。药物对照氯霉素的抑菌率为(89.20±0.99)%,溶剂对照DMSO抑菌率为(5.92±0.12)%,即该溶剂对EC-1影响较小,可作为配制LE4-1~LE4-7母液的溶剂。
2.2 LE4-3的GC-MS分析结果
LE4-3的总离子流图及GC-MS检测结果见图2及表1。对总离子流图中的各峰经质谱计算机数据系统检索及核对NIST2005和Wiley275标准质谱图,确定了LE4-3的化学成分,用峰面积归一化法计算各化学成分的相对含量。由表1可知,LE4-3共检测到34 种化合物,鉴定出其中21 种成分,主要物质为苯乙酸乙酯(相对含量32.190%)、亚油酸(相对含量15.819%)、苯乙酸甲酯(相对含量13.793%)、硬脂酸乙酯(相对含量9.105%)。

图 2 流分LE4-3的总离子流图Fig. 2 Total ion current chromatogram of fraction LE4-3
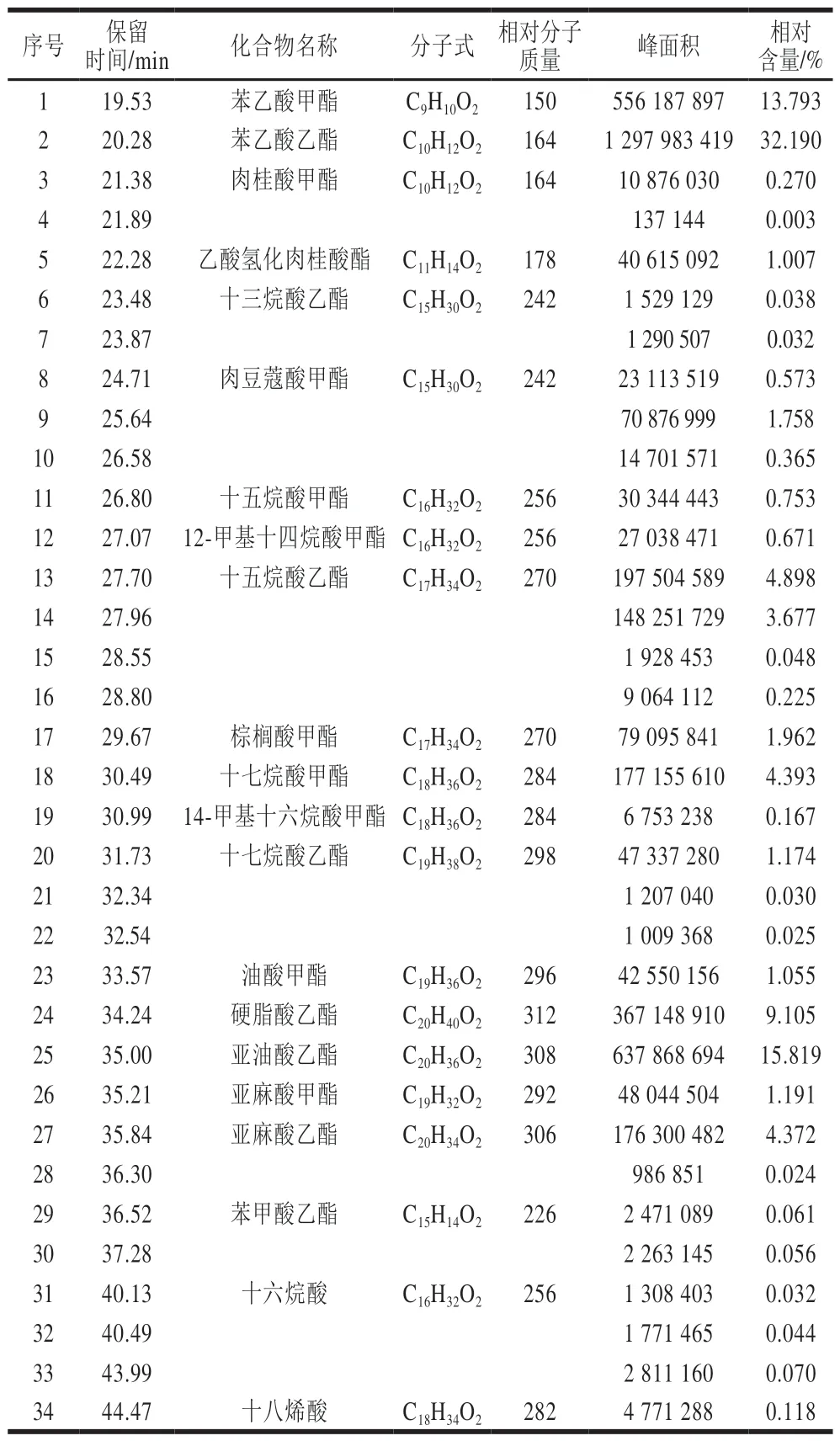
表 1 流分LE4-3的化学成分Table 1 Chemical composition of fraction LE4-3
近年来研究者对脂肪酸及其衍生物如脂肪酸甲酯、脂肪酸甘油酯、脂肪酸蔗糖酯、脂肪醇、磺化脂肪酸酯、聚甘油脂肪酸酯等的抑菌作用十分关注,该类物质已被美国食品及药品管理局认证为一般公认安全的食品添加剂[21-22]。Kelsey[23]与Sun[24]等报道了脂肪酸及其衍生物对金黄色葡萄球菌和幽门螺旋杆菌有良好的抑制作用;王君等[25]从黄粉虫成虫体内提取的脂类抗菌物质对苹果炭疽病害和梨黑星病害有明显的抑制作用。此外,据俞发荣等[26]报道,十八烯酸对人肾癌细胞A498细胞具有毒性作用;Yamazakti等[27]报道棕榈酸的甘油单酯对李斯特菌有一定的抑制作用。因此具有抑菌作用的脂肪酸及其衍生物可以作为安全高效的天然防腐剂应用于食品。
2.3 LE4-3的抑菌机制分析结果
2.3.1 LE4-3的IC50测定结果

图 3 LE4-3对EC-1的IC50Fig. 3 IC50 of chloramphenicol and fraction LE4-3 against EC-1
由图3可知,LE4-3质量浓度为1.2 mg/mL时抑菌率可达(78.60±0.94)%,与1.4 mg/mL时的抑菌率差异不显著(P>0.05);而氯霉素在质量浓度为0.4 mg/mL时抑菌率已达(81.60±0.45)%。LE4-3与氯霉素的IC50分别为(1.06±0.01)、(0.08±0.00)mg/mL,选择IC50进行后续实验。
2.3.2 LE4-3对菌液电导率影响
细胞膜作为细菌的保护屏障,当细菌受到药物毒害或处于不利环境时细胞膜完整性被破坏,使胞内物质外泄至培养液中,进而使培养液的电导率上升[28-29]。由图4可知,LE4-3作用EC-1菌体初期,上清液电导率与作用时间呈正相关,且氯霉素与LE4-3组始终高于空白组,当作用60 min时,LE4-3组的电导率相比空白组与氯霉素组分别增加了8.98%、4.90%(P<0.05),推测LE4-3能改变EC-1菌体细胞膜通透性,使菌体细胞内物质的外泄到培养液中。

图 4 流分LE4-3对EC-1培养液电导率的影响Fig. 4 Effect of fraction LE4-3 on extracellular conductivity of EC-1
2.3.3 LE4-3对菌体核酸、蛋白质泄漏的影响

图 5 LE4-3对EC-1核酸、蛋白质泄漏的影响Fig. 5 Effect of fraction LE4-3 on nucleic acid and protein leakage of EC-1
培养液OD260nm和OD280nm可反映菌体细胞DNA与RNA的泄漏情况,从而推测菌体细胞膜结构的完整性[30]。由图5可知:随着培养时间的延长,氯霉素组的核酸和蛋白含量基本与空白组持平,但LE4-3作用菌体后培养液中核酸、蛋白质的含量均高于空白组与氯霉素组;在培养12 h时,LE4-3组OD260nm和OD280nm分别为0.046 7±0.001 1和0.081 3±0.001 5,明显高于空白组(32.1%、23.9%)和氯霉素组(62.6%、23.9%),因此推测LE4-3破坏了EC-1细胞膜完整性,导致细胞内核酸、蛋白外泄。
2.3.4 LE4-3对菌液可溶性总糖质量浓度的影响
糖类是微生物重要的能源和碳源。在正常条件下微生物能主动从环境中摄取所需营养物质,而当膜结构遭到破坏时,细胞内物质包括糖类发生泄漏,所以可通过测定细菌培养液中可溶性总糖质量浓度变化检测细菌膜结构完整性[31]。由图6可知,LE4-3处理EC-1后胞外溶液可溶性总糖质量浓度与培养时间呈正相关,培养12 h时达到(0.502±0.039)mg/mL,为空白组的340%,说明LE4-3在增加EC-1细胞膜通透性同时也破坏了其细胞膜完整性,导致大分子糖类物质泄漏到胞外,而空白组中可溶性总糖质量浓度与培养时间呈负相关,说明菌体细胞膜保持完整,并能吸收菌体外糖类物质供自身利用。

图 6 LE4-3对EC-1菌液可溶性总糖质量浓度的影响Fig. 6 Effect of fraction LE4-3 on soluble total sugar concentration of EC-1
2.3.5 LE4-3对菌体蛋白表达的影响

图 7 LE4-3处理后EC-1菌体总蛋白的SDS-PAGE图谱 Fig. 7 SDS-PAGE of total bacterial proteins from EC-1 treated with fraction LE4-3
SDS-PAGE可测定未知蛋白分子质量大小[32],也可通过SDS-PAGE图谱反映蛋白质含量的变化[33]。由图7可知,当氯霉素处理4、8、12 h时,菌体总蛋白含量明显低于空白组。氯霉素能与核糖体50S亚基相结合,进而特异性的阻止mRNA与核糖体结合,从而抑制蛋白质的合成[34-35]。而LE4-3处理4、8、12 h时,菌体总蛋白含量同样低于空白组,则说明LE4-3处理也可阻碍EC-1菌体蛋白合成,起到抑制作用。
2.3.6 LE4-3对菌体磷代谢的影响
磷是所有生物必需的微量元素,是核酸、磷脂及糖代谢中间产物的重要组成成分,在细胞能量代谢中起核心作用,细菌可利用葡萄糖经一系列磷酸化反应,为生长繁殖提供所需能量,因此通过检测细菌代谢活动中磷消耗状况可反映出细胞整体代谢功能和生长状态[36]。
由图8可知,空白组磷质量浓度与培养时间呈负相关,说明菌体在生长过程中消耗培养体系中的磷进行正常的代谢活动,而经LE4-3和氯霉素处理后菌体磷代谢受到严重影响,在培养2 h后磷代谢缓慢,且磷质量浓度与培养时间呈负相关但与空白组差异明显,表明LE4-3与氯霉素可影响EC-1细胞磷代谢,因此推测EC-1菌体细胞经LE4-3处理后磷代谢能力减弱,进而导致细胞能量代谢受阻。

图 8 LE4-3对EC-1磷代谢含量的影响Fig. 8 Changes in phosphorous metabolism in EC-1 treated with fraction LE4-3
2.3.7 LE4-3对ROS水平的影响

图 9 LE4-3对EC-1内ROS水平的荧光定量分析Fig. 9 Fluorescent quantitative analysis of ROS level in EC-1 treated with fraction LE4-3
ROS具有很强的氧化活性,是一类分子氧部分还原的分子或离子,过量的ROS能够使DNA、蛋白质、脂类等生物大分子发生过氧化链式反应,造成细胞结构的损伤,影响生理活性,胞内ROS过度积累,会对膜脂、蛋白质、核酸等产生氧化损伤,进而触发或者加速细胞凋亡进程[37-39]。由图9可知,LE4-3可以刺激EC-1菌体产生较多ROS,LE4-3胞质中ROS水平呈先升后降趋势,在培养30 min时出现峰值,为空白组的338%,与其相比差异极显著(P<0.01),推断LE4-3可造成EC-1细胞氧化损伤。
3 结 论
巨大芽孢杆菌L2流分LE4-3对魔芋软腐病原菌EC-1具有良好抑制作用,其IC50为(1.06±0.01)mg/mL,经GC-MS共检测到34 种成分,鉴定出其中21 种已知化合物,其中苯乙酸乙酯、亚油酸乙酯、苯乙酸甲酯为相对含量最高的3 种物质;并且推测LE4-3可通过影响细胞膜功能、损伤细胞结构、抑制细胞蛋白质合成及能量代谢等方面抑制EC-1生长,为开发魔芋贮藏期软腐病天然防腐剂防治提供了理论依据。
