黑龙江鲤肌肉发育中miRNA对间隙连接蛋白基因(Cx43)的调控
2019-12-03艾显辉赵金艳闫学春田丽红
艾显辉,赵金艳,于 钊,闫学春,田丽红,梁 洋
( 1.东北林业大学,黑龙江 哈尔滨 150040; 2.哈尔滨工业大学,黑龙江 哈尔滨 150001; 3.中国水产科学研究院 黑龙江水产研究所,黑龙江 哈尔滨 150040 )
在脊椎动物中,肌肉的生长除了受生肌决定因子家族成员(包括MyoD、Myogenin、Myogenin M 和MRF4等)以及一些负调控因子如肌肉生长抑制素(MSTN)的调控外[1],一些微小RNA(MicroRNA或miRNA)也通过对各自靶基因的作用协同参与肌肉的发生和分化过程[2-3]。富含在心肌和骨骼肌组织中的RNA被称为肌相关微小RNAs(myomiRs),在庞大的myomiRs家族中,微小RNA-1(miR-1)和微小RNA-206(miR-206)具有共同的种子序列,属于同一个基因家族,在骨骼肌中特异表达。研究显示,在小鼠成肌细胞(C2C12)中过表达miR-1和miR-206,有明显促分化作用;在肌肉疾病和功能紊乱模型试验中,miR-1和miR-206也有明显改变,说明二者与肌肉生长发育及肌肉相关疾病关系密切[4]。
miR-1和miR-206靶基因定位及其功能在小鼠等模式生物中研究较为深入而透彻,c-Met、HDAC4、pax7、pax3等均已确定是两者共同的靶基因[5-6],另有研究显示,在小鼠中间隙连接蛋白基因Cx43也是miR-1和miR-206的靶基因[7]。目前在小鼠基因组中发现20种间隙连接蛋白(Cx)基因,在人类基因组中存在21种间隙连接蛋白[8-9],其中Cx43基因是最重要的间隙连接蛋白基因之一。胚胎发育早期,Cx43基因在肌纤维中有广泛表达,显示能够促进成肌细胞的分化、融合。体内试验中,当肌肉受损后,肌卫星细胞通过诱导增殖分化来应对肌肉的损伤,此时在增殖的肌卫星细胞中Cx43基因的表达会迅速上调,并一直持续到肌细胞发生融合[10-11]。体外细胞试验中也呈现这一趋势,加入庚醇、辛醇等Cx43基因的抑制剂后,成肌细胞不能再正常分化,即使再加入生肌调节因子MRF4等也无法使肌细胞恢复分化[12],说明细胞间隙连接通讯对于体外肌细胞的分化融合是必不可少的。
鱼类是重要的脊椎动物,地球上存在的鱼类超过30 000种,约占脊椎动物总物种的50%,但鱼类miRNA的研究相对滞后[13]。目前尚未见关于黑龙江鲤(Cyprinuscarpio)肌肉中miR-1和miR-206对Cx43基因调控的报道。因此,笔者以黑龙江鲤为试验材料,自已经测序完成的鲤鱼功能基因组数据库中调取肌肉生长相关基因Cx43,通过荧光素酶报告系统,在细胞水平分析miR-1和miR-206对靶基因的调控,通过整体原位杂交等方法探明胚胎早期Cx43基因的表达情况,为探明鲤鱼肌肉发育中miRNA的调控机理,优化黑龙江鲤品质,提高其生产性能奠定基础。
1 材料与方法
1.1 试验材料
试验所用鲤鱼精子、卵子及鲤鱼成体均由中国水产科学院黑龙江水产研究所提供。NIH-3T3细胞实验室自存。
组织获取:新鲜黑龙江鲤处死,首先取出脑部组织,然后腹部解剖,取心、肝胰脏、肾、脾、鳃、肠、皮、红肌和白肌等组织,迅速将取出的组织放入预冻的冻存管中(冻存管事先做好标记),冻存管放入液氮中冷冻,所有组织取出后置于-80 ℃冰箱保存备用。
1.2 试验方法
1.2.1 RNA提取
分别取适量鲤鱼胚胎,利用液氮充分研磨,加入Trizol使其充分裂解,10 000 r/min离心5 min,取上清液,分别以氯仿和异丙醇抽提、沉淀RNA,后以75%乙醇充分洗涤沉淀。用适量无RNA酶的去离子水溶解沉淀,变性凝胶电泳检测RNA含量,测量总RNA量和纯度,再将总RNA利用PolyA聚合酶加尾,利用接头引物(Ambion)反转录成cDNA。
1.2.2 基因克隆及探针的制备
参照斑马鱼(Daniorerio)MyoD和Cx43基因的cDNA序列,设计简并引物(表1),同时设计Cx43基因片段的突变引物,以鲤鱼肌肉cDNA为模版,进行PCR扩增。将克隆结果送测序公司进行测序并按照说明书进行标记探针的制备。
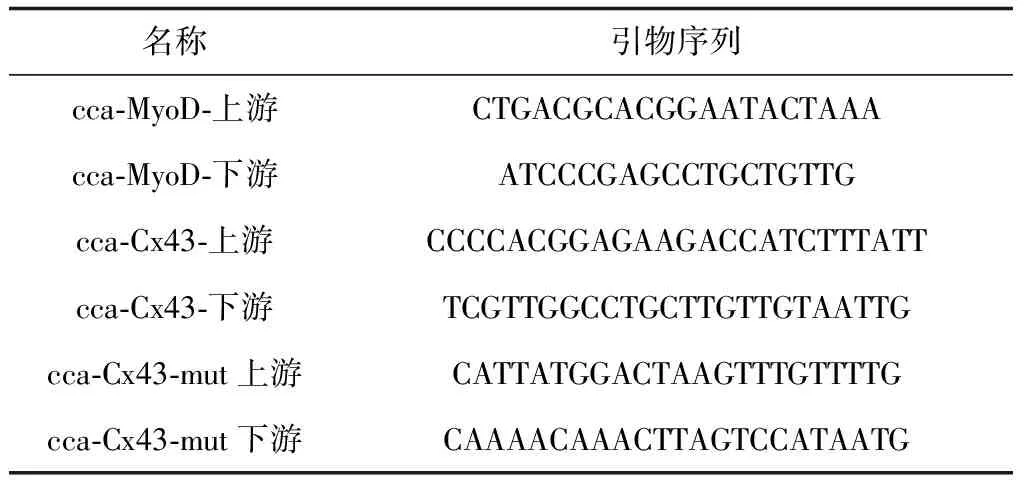
表1 引物序列
1.2.3 双萤光素酶载体的构建与鉴定
根据表1所设计引物,PCR扩增得Cx43基因片段和Cx43-mut基因片段,胶回收后,利用hindⅢ和mluⅠ(纽英伦生物技术北京有限公司)进行双酶切,同时双酶切荧光素酶载体PMIR,将酶切后的目的片段进行检测,正确后用T4 DNA连接酶,16 ℃过夜连接。连接检测正确后进行转化,并提取质粒进行双酶切和测序鉴定。
1.2.4 细胞培养与转染
1.2.4.1 细胞的复苏与传代培养
NIH-3T3细胞实验室自存。自液氮中取出后置于37 ℃水浴中快速融化,转移细胞悬液至15 mL离心管,加入5倍体积预热到37 ℃的合成培养基,1000 r/min离心5 min,弃上清液,加入3 mL合成培养基,温和吹打使其混匀,转移到60 mm培养皿中,置于CO2培养箱中进行培养,培养条件:37 ℃,5%CO2、95%空气。每日观察细胞状态。培养基配方:DMEM高糖培养基,添加10%胎牛血清(ES-FBS,BI公司,货号04-002-1A),添加1%双抗和1% GlutaMAX(100×)。
当复苏培养细胞汇合度达到约80%时,弃去旧培养基,缓慢加入2 mL PBS,对细胞进行2遍清洗;弃去PBS,加入0.25%胰蛋白酶+0.04%EDTA的消化液500 μL,1~2 min后待大部分细胞变圆自底部脱落,再加入1.5 mL合成培养基终止消化;水平离心机离心(1000 r/min,5 min),弃上清液,按1∶3比例传代培养。
1.2.4.2 细胞转染
转染前1 d将细胞接种于不含抗生素的培养基中,细胞转染密度60%~70%汇合。按照Lipofectamine 2000说明书程序转染细胞:
溶液A:每孔240 μL减血清培养基(Opti-MEM)+10 μL lipofectamine 2000,静置5 min。
溶液B:每孔240 μL Opti-MEM培养基+2.5 μg质粒(总体积250 μL,与A液相同)。
溶液C:将A、B两管缓慢混合,室温下静置20 min。
将溶液C逐滴均匀加入孔中,轻轻晃动培养板混匀,置37 ℃细胞培养箱中保温4~6 h。之后更换为含有双抗的培养基,37 ℃,5%的CO2中培养,48 h后检测转染水平。
1.2.4.3 双荧光素酶检测
细胞转染48 h后弃去旧培养基,用预冷的1×PBS轻轻洗涤细胞2~3次;24孔板中加入1×ULB(通用裂解液)200 μL,水平摇床室温摇15 min使细胞充分裂解;离心(10 000 r/min)3 min,取10 μL细胞裂解液于1.5 mL EP管,加50 μL萤火虫荧光素酶底物,荧光光度仪测定萤火虫荧光素酶的活性值F,再加50 μL海肾酶底物,检测海肾荧光素酶发光值R,记录F值、R值和比值。
1.2.5 RT-PCR
依照Takara PrimeScript产品的使用说明,用1 μg总RNA作为模板反转录,反转录引物为oligo-dT。PCR使用的基因特异性引物与Cx43探针合成引物相同。
1.2.6 鲤鱼整体原位杂交
杂交第1 d:将受精后6、12、24 h和48 h的鲤鱼胚胎分别依次放入装有75%、50%和25%的1.5 mL无核糖核酸酶的EP管中复水,H2O2对鲤鱼胚胎进行漂洗,蛋白酶K消化,4% PFA固定胚胎,加入含有探针的杂交液,70 ℃杂交箱中杂交过夜。
杂交第2 d:将杂交过夜的胚胎经溶液Ⅰ(50%甲酰胺,5×SSC pH=4.5,1% SDS)洗涤3次,溶液Ⅱ(0.5 mol NaCl,10 mmol Tris-Cl pH=7.5,1% Tween20)洗涤3次,溶液Ⅲ(50%甲酰胺pH=4.5,2×SSC)洗涤3次,每次洗涤均为30 min。洗涤后的胚胎利用马血清封闭90 min,之后置于装有地高辛抗体的TBST溶液中(1∶2000),放4 ℃冰箱中摇床洗涤16 h以上。
武戏自然就热闹些,武将们负旌旗持锋刀,八字步一步高过一步,铿锵铿锵铿锵锵。伴乐的那几个老头秃头皱脸的,手底下忙着拉胡打鼓,头也跟着不停地晃,恣意得很!
杂交第3 d:用TBST溶液(8 mg/mL NaCl,0.2 mg/mL KCl,25 mmol/L Tris-HCl pH=7.5,1% Tween20)对胚胎进行彻底洗涤,放于4 ℃冰箱中摇床洗涤过夜。
杂交第4 d:室温下用NTMT(100 mmol NaCl,100 mmol Tris-HCl(pH 9.5),50 mmol MgCl2, 1% Tween20和2 mmol左旋咪唑)对胚胎进行摇床洗涤,3次/5 min。将胚胎移至装有显色液的培养皿中避光显色(-4 ℃冰箱),显色完成后用PBS溶液对胚胎进行洗涤以终止显色,50%甘油透化30 min,观察拍照。
2 结 果
2.1 鲤鱼肌肉中miR-1和miR-206靶基因预测及分析
通过Targetscan软件进行预测,结合前期阅读资料,在斑马鱼中寻找到Cx43基因是miR-1和miR-206潜在的靶基因(图1)。将鲤鱼Cx43基因与斑马鱼序列进行比对,结果显示,鲤鱼Cx43基因的3′UTR区能够和斑马鱼Cx43基因绝大部分匹配,且有6位碱基能与miR-1和miR-206种子序列完全匹配(图2)。
2.2 PMIR-Cx43荧光素酶报告载体的构建
根据以上分析结果,在鲤鱼Cx43基因3′-UTR区设计引物(表1),以提取的鲤鱼肌肉cDNA为模板,进行PCR扩增。结果显示,扩增条带大约为500 bp,与理论值445 bp相符(图3);将目的片段与克隆载体连接送去测序,测序结果与Cx43基因理论值匹配(通过DNAMAN比对)(图4)。
2.3 PMIR-Cx43荧光素酶报告载体的鉴定
将上述含有Cx43基因3′-UTR区的克隆载体和荧光素酶载体PMIR通过酶切、连接、转化获取重组质粒DNA,再用hindⅢ和mluⅠ双酶切鉴定。结果表明,酶切后得到的约500 bp的Cx43基因3′-UTR片段与预期大小相符(图5)。

图1 斑马鱼Cx43基因miRNA结合位点预测结果

图2 斑马鱼和鲤鱼Cx43基因序列比对结果

图3 PCR结果1:DL2000 DNA Marker; 2:PCR产物.

图4 Cx43基因3′-UTR测序结果

图5 重组质粒 PCR检测结果1:DL2000 DNA Marker; 2:PCR产物.
2.4 PMIR-Cx43-mut荧光素酶报告载体的构建
另外设计Cx43基因的突变引物(表1),扩增成功后连接克隆载体测序检测,结果显示突变体构建成功(图6)。随后构建荧光素酶报告载体PMI-Cx43-mut,分别用PCR和酶切检测片段大小,与理论值约447 bp相符(图7)。
2.5 miR-1和miR-206对靶基因Cx43调控作用分析
在3T3细胞中,通过检测荧光素表达变化验证miRNAs对靶基因表达的调控作用。利用脂质体将PMIR-Cx43载体、突变载体与合成的miRNAs,阴性对照及海肾荧光素酶载体共转染3T3细胞,海肾荧光素酶的活性为内参,转染后48 h检测荧光素酶的活性。由图8可知,与对照组相比,miR-1和miR-206均能下调pMIR-Cx43-3′UTR的荧光素酶活性,其中miR-206下调明显。突变组miR-1荧光水平与对照组基本持平,miR-206组略低于对照组。
图6 Cx43基因突变测序结果

图7 PMI-Cx43-mut载体鉴定结果a.1,DL2000 DNA Marker; 2~7,PCR产物;8,阴性对照. b.1,DL2000 DNA Marker; 2,酶切产物.
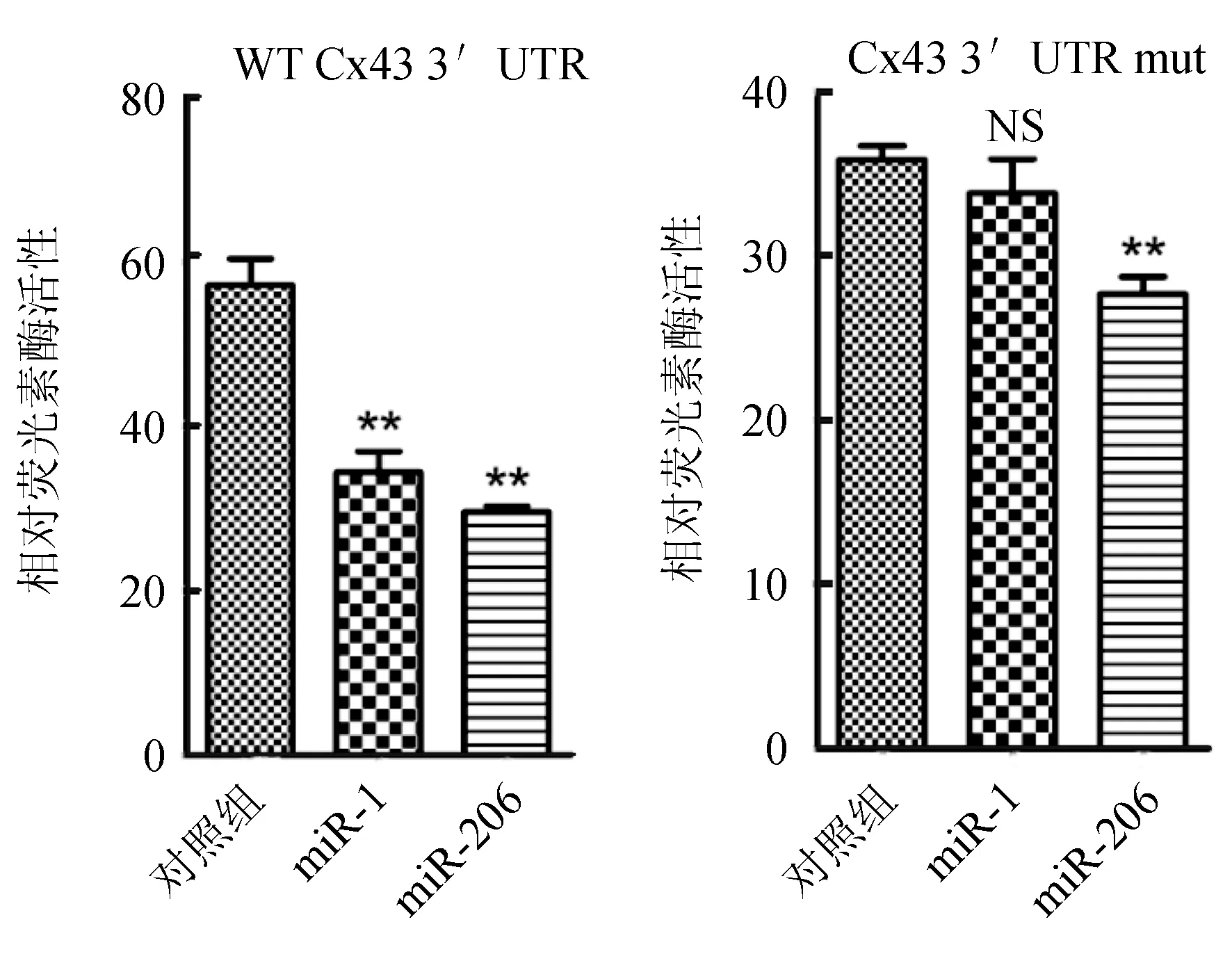
图8 miR-1和miR-206对Cx43基因3′UTR的调控作用NS代表差异不显著; **代表差异显著(P<0.01).
2.6 Cx43基因在鲤鱼胚胎不同时期的表达
对鲤鱼胚胎发育6、12、24 h和48 h时期的Cx43表达情况进行分析,RT-PCR结果显示,不同时期的鲤鱼胚胎中Cx43的表达有明显差异。6 h胚胎中已经开始表达但表达量较低,随后表达量开始上调。当胚胎发育到24 h时,达到最高峰,此后表达呈现下降趋势。MyoD基因作为阳性对照,Cx43基因表达趋势与其有相似性(图9)。

图9 鲤鱼胚胎发育不同时期RT-PCR结果
2.7 原位杂交分析Cx43基因在鲤鱼胚胎中表达情况
3 讨 论
在模式动物小鼠和斑马鱼中,发现多种与肌肉发育相关的miRNA,这些富含在心肌和骨骼肌组织中的miRNAs被称为myomiRs,这些myomiRs通过对靶基因的调控而促进肌肉的发生、肌细胞的分化以及肌肉再生等过程[2-3]。其中miR-206和miR-1在骨骼肌中特异表达,且具有共同的种子序列,Cx43、c-Met、HDAC4、pax7、pax3等均是两者共同的靶基因,但目前在黑龙江鲤肌肉中miR-206和miR-1对Cx43基因的调控尚未见报道。

图10 Cx43基因在12 h鲤鱼胚胎中的表达情况a.侧面观察; b.背面观察; c.腹侧观察; d.MyoD基因. 标尺为100 μm.

图11 Cx43基因在24、48 h鲤鱼胚胎中表达情况a.24 h阴性胚胎; b.24 h Cx43基因表达情况; c.24 h MyoD基因表达情况; d.48 h阴性胚胎; e.48 h Cx43基因表达情况; f.48 h MyoD基因表达情况. 标尺为100 μm.
3.1 miR-1和miR-206对Cx43基因的调控
研究显示,Cx43作为一种重要的间隙连接蛋白,在小鼠等模式动物中受到miR-1和miR-206的调控,在胚胎发育早期的肌纤维中有广泛表达,能够促进成肌细胞的分化、融合[14]。Anderson等[15]利用小鼠C2C12细胞研究miR-206和miR-1对Cx43基因的调控作用时发现,在细胞融合过程中Cx43基因高表达,但分化后表达明显下调,说明了myomiRs通过调控细胞间信息交流通道的关键蛋白Cx43蛋白的表达来促进细胞融合。李积永[16]通过研究大鼠骨骼肌运动性微损伤时发现,miR-206能通过调节Cx43基因的表达而促进大鼠腓肠肌的运动性损伤修复。另有研究显示,在人血管平滑肌细胞中,miR-206与Cx43基因形成调控网络来影响其增殖和发育[17]。
目前已经发现,在小鼠、大鼠、人、狗、牛和鸡中Cx43的种子序列完全保守[18-19],本试验前期利用生物信息学分析在斑马鱼中也发现了miR-206和miR-1结合位点,进一步分析鲤鱼Cx43基因,发现鲤鱼3′UTR区域与斑马鱼Cx43基因绝大部分匹配,且有6位碱基与miR-1和miR-206种子序列完全匹配,因此预测,在鲤鱼中Cx43基因也能被二者调控。为进一步检测该结果,克隆了鲤鱼Cx43基因3′UTR区并构建荧光素酶报告载体与突变载体,利用脂质体转染小鼠成纤维3T3细胞,结果表明,miR-1和miR-206均能下调含有Cx43 3′UTR序列载体的荧光素酶活性,其中miR-206作用明显,miR-1对其抑制作用较弱。该结果与Anderson等[15]在小鼠中发现的作用机制相似,暗示在鲤鱼中Cx43基因也是miR-206和miR-1的靶基因。
3.2 黑龙江鲤胚胎期Cx43基因表达模式
胚胎原位杂交方法可以分析mRNA在不同发育时期组织中的表达情况,是研究胚胎基因表达的常用技术,而地高辛所标记的探针具有较高灵敏度,有助于探讨目的基因的调控机制[20-21]。本试验利用胚胎整体原位杂交方法,MyoD基因作为阳性对照,研究鲤鱼不同发育时期胚胎Cx43基因表达时发现,受精12 h后,Cx43基因在胚胎的眼周、头部以及心脏部位表达,同时在近轴细胞和神经管一直延伸至胚胎的尾牙部分表达显著;当胚胎发育至24 h时,Cx43基因主要集中在神经管、背部近轴细胞以及胚胎的体节中,且表达量最高,随后呈现下降趋势;至胚胎发育48 h在体轴和近轴细胞以及体节等处几乎观察不到基因表达。该结果与前期在鲤鱼胚胎早期发育过程中MyoD基因的表达模式[22]类似,也有研究显示,Cx43基因主要在小鼠早期胚胎中高表达,因此推测,在鲤鱼中Cx43基因对成肌分化早期有重要调控作用。
另外,原位杂交结果显示,Cx43基因始终在胚胎头部、眼部高表达,由于该基因在脑、心脏等部位分布广泛,尤其在神经元中,是神经胶质细胞等完成功能主要依赖的蛋白之一,因此几乎在所有胚胎时期的脑中Cx43基因始终表达明显[23]。
综上,该研究在黑龙江鲤肌肉中探索了miRNA-206和miRNA-1和对Cx43的调控作用,并利用其胚胎进行Cx43基因表达差异性研究,为进一步探讨鲤鱼肌肉发育的调控机制,以及改良鲤鱼肌肉品质提供了理论基础。
