Hsa_circ_0002360在肺腺癌中的表达及临床意义
2019-11-29张日婷陈正威严玉兰
张 垚,张日婷,陈正威,严玉兰
0 引 言
近几十年来,肺腺癌发病呈逐年上升趋势,已成为非小细胞肺癌发病率最高的类型[1-2]。目前肺癌比较有效的治疗方法包括手术切除、免疫治疗、靶向治疗等。但是由于缺乏早期诊断的有效手段,大多数患者在诊断时已经伴局部浸润或远处转移,上述治疗患者很少能够达到5年生存的目的甚至治愈[3]。因此,迫切需要寻找敏感的早期肺腺癌诊断标志物。
环状RNA(circRNA)是一种新型的非编码RNA,比线性RNA 具有更高的稳定性和保守性,广泛存在于生物体中[4],已成为近年来多种癌症研究的热点。例如,Chen等[5]发现hsa_circ_0000190在胃癌组织及血清中表达下调,其表达水平与淋巴结转移和TNM分期显著相关。本研究前期证实了Hsa_circ_0002360 在肺腺癌组织中具有差异性表达[6]。本研究旨在探讨Hsa_circ_0002360 在肺腺癌中的表达水平及其在肺腺癌临床诊断、治疗中的价值。
1 资料与方法
1.1 研究对象收集2018 年5 月至2019 年6 月江苏大学附属人民医院胸外科107例手术切除的肺腺癌患者资料及肿瘤与癌旁组织标本。所有患者无其他基础疾病,均未接受术前化疗或放疗,术中及术后病理均提示肺腺癌,其中中高分化腺癌51 例,低分化腺癌56 例。相应的癌旁组织,距肿瘤边缘2 cm。组织标本取出后立即保存在RNA固定剂中,并保存在-80 ℃中备用。另采集50 例肺腺癌患者(肺腺癌组)术前、术后第2 天及50 例门诊体检健康者(正常对照组)的外周血5 mL,12 h 内离心后储存于-80 ℃冰箱备用。本研究经过医院伦理委员会批准(批准号:K-20180043-Y),患者均签署知情同意书。
1.2 主要试剂北美胎牛血清(Gibco 公司),1640培养基(BI 公司),Trizol 及Trizol LS 试剂(Ambion life technologies),逆转录试剂盒、荧光定量PCR 试剂盒(日本TaKaRa 公司),LipoFiter 脂质体转染试剂(美国Invitrogen),CCK-8 试剂盒(南京厚载生物科技公司)。人肺癌细胞系A549、H1975、H1299细胞,人永生化支气管黏膜上皮细胞BEAS-2B(中国科学院上海生科院细胞中心)。
1.3 方法
1.3.1 细胞培养人肺腺癌细胞株(A549、H1299、H1975)及人支气管黏膜上皮细胞株(BEAS-2B)采用含10%胎牛血清和1%青-链霉素双抗的RPMI-1640 培养基培养,培养条件为37 ℃、5%CO2培养箱。
1.3.2 RNA 提取及逆转录按照Trizol reagentcong说明书从组织及细胞中提取RNA,按照Trizol LS 说明书从人血清中提取总RNA,Nanodrop2000 微量分光光度计测RNA 的浓度及纯度,并进行RNase R 消化,逆转录试剂盒进行逆转录。
1.3.3 实时荧光定量PCR取上述反转录产物在CFX96Real-Time,PCR Detection(Bio-Rad,California,USA)仪上扩增,反应体系为10 µL,RT-qPCR 条件为:95 ℃预变性30 s;95 ℃5 s,55 ℃退火30 s,40 个循环。实验独立重复3 次,每个样本设3 个复孔,引物 设 计 为 内 参 GAPDH 上 游 引 物 为CCCACTTCTCTCTAAGGAGAAT 下游引物为TACACGAAAGCAATGCTATCAC,目的基因hsa_circ_0002360 上 游 引 物CTCAGAGTCAGATGCAGGG 下游引物为TGATGGCTCTGTGGTAGG。
1.3.4 细胞转染实验取6 孔板分别接种H1975、A549 肺腺癌细胞,每个板设置3 个孔为小干扰RNA(Si-circRNA),另3 个孔为阴性对照(Si-NC),分别以LipoFiter 脂质体转染试剂及小干扰RNA 和Si-NC 转染稀释、混合后加入人肺腺癌细胞系中,qRT-PCR检测转染效率。
1.3.5 CCK8 实验将干预后的肺腺癌细胞株(A549、H1975)加入96 孔板(每孔约2000 个),在培养箱孵育0、24、48、72 h 后每孔加入10µL CCK-8试剂,37 ℃培养箱中孵育1 h 后,用酶标仪检测450 nm波长处的吸光度值。实验每组设置3个复孔。
1.3.6 克隆形成实验将肺腺癌细胞株(A549、H1975)分别接种小干扰RNA 组、阴性对照组,37 ℃细胞培养箱中培养2 周,每2 至3 天换液1 次并再次予干预,PBS 清洗3 次,加入多聚甲醛于4 ℃冰箱内固定细胞30 min,PBS 清洗3 次,每孔加入1mL 结晶紫染色10 min,双蒸水清洗至洗净背景,计数细胞的克隆数,克隆形成率计算公式如下:
克隆形成率(%)=(克隆数/接种细胞总数)×100%
每组实验设置3个副孔。
1.3.7 细胞划痕实验将肺腺癌细胞株(A549、H1975)分别接种在6 孔板中(3 个孔小干扰RNA、另3 孔为阴性对照),当细胞平铺于6 孔板达到70%~80%时,用10µL 枪头在孔中划平行线,PBS 清洗干净,然后加入无血清培养基,进行干预,细胞培养箱中培养,于0 h 及48 h 显微镜下拍照并记录宽度,计算迁移率公式如下:
迁移率(%)=(0 h宽度-48 h宽度)/0 h宽度×100%
1.4 统计学分析采用SPSS 22.0 及GraphPad Prism5软件进行统计分析。定量资料采用均数±标准差(xˉ±s)表示,肺腺癌组织与癌旁组织hsa_circ_0002360的比较采用配对样本t检验,肺腺癌患者与健康志愿者血清中hsa_circ_0002360 的比较采用独立样本t检验,circRNA表达量与临床特征的关系采用单因素方差分析。以P≤0.05为差异有统计学意义。
2 结 果
2.1 hsa_circ_0002360在人肺腺癌患者组织中的表达肺腺癌组织中hsa_circ_0002360的表达水平显著高于癌旁组织[(2.84±0.12)vs(1.46±0.08),P<0.01]。中高分化腺癌hsa_circ_0002360的表达水平低于低分化腺癌[(1.58±0.17)vs(3.12±0.18),P<0.01]。
2.2 hsa_circ_0002360肺腺癌患者手术前后及健康志愿者血清中的表达肺腺癌组患者血清中hsa_circ_0002360 的表达水平显著高于正常对照组[(2.59±0.17)vs(1.21±0.11),P<0.01];肺腺癌组患者术后血清中hsa_circ_0002360 表达水平较术前明显下降[(1.58±0.09)vs(2.59±0.17),P<0.01]。
2.3 hsa_circ_0002360的表达与肺腺癌患者临床特征的关系hsa_circ_0002360 的表达水平与淋巴结转移、肿瘤分化程度相关(P<0.05)。见表1。
2.4 hsa_circ_0002360在肺腺癌细胞株中的表达及Si-RNA 的干预与BEAS-2B hsa_circ_0002360 的表达相比,A549、H1299、H1975 肺腺癌细胞株中明显增加(P<0.05)。因此选用表达较高的细胞株A549、H1975 进行Si-RNA 干预试验,发现加入Si-RNA 干预后,has _circ _0002360 的表达降低(P<0.05),见图1。

表1 hsa_circ_0002360 在肺腺癌组织及癌旁组织中的表达(n)Table 1 Expression of hsa_circ_0002360 in lung adenocarcinoma and the adjacent tissue(n)
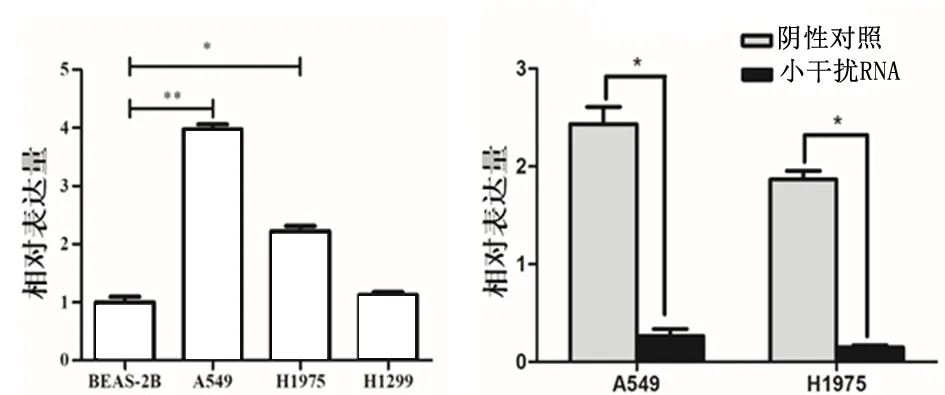
图1 Hsa_circ_000236在肺腺癌细胞系中的表达Figure 1 Expression of Hsa_circ_000236 in LAC cell lines
2.5 hsa_circ_0002360促进肺腺癌细胞株增殖及迁移采用Si-circRNA 对肺腺癌细胞株(A549、H1975)分别进行干预后,小干扰RNA 细胞克隆形成率[(38.33±1.69)%、(29.66±1.52)%]明显低于阴性对照[(65.66±4.93)%、(60.00±3.26)%],差异有统计学意义(P<0.01)。小干扰RNA 细胞迁移率为[(13.5±3.34)%、(27.33±2.05)%]明显低于阴性对照[(55.00±4.08)%、(54.66±4.1)%],差异有统计学意义(P<0.01),见图2。

图2 Hsa_circ_0002360促进肺腺癌细胞的迁移Figure 2 Promoting effect of Hsa_circ_0002360 on the migration of lung adenocarcinoma cells
3 讨 论
肺癌是导致癌症患者生存率降低的主要原因之一,与其他肿瘤类型相比,肺癌的发生率及死亡率均较高[1]。与此同时肺癌的转移性及预后不良性使其治疗仍面临着巨大的挑战[7-8]。目前还没有有效的诊断工具来区分早、晚期肺腺癌高危患者。有研究显示转录调控基因的异常表达与多种癌症的发生和恶性行为密切相关[9-10]。circRNA 是一类新的内源性RNA,可调控哺乳动物的基因表达,与其他非编码RNA 如microRNAs 和长非编码RNAs(lncRNAs)相比,环状RNA 在哺乳动物细胞中具有高度保守的序列和高度的稳定性[11-13],这些特性为环状RNA提供了成为理想的生物标志物的潜力。
本研究发现hsa_circ_0002360 在肺腺癌组织中的表达水平显著高于其邻近非肿瘤组织,且其表达水平与淋巴结转移及肿瘤分化程度有一定相关性。hsa_circ_0002360 可能参与了肺腺癌的发生和进展。本研究采用qRT-PCR技术检测3种肺腺癌细胞(A549、H1299、H1975)中hsa_circ_0002360 的表达水平,并选择了表达水平较高的2 种细胞株(A549、H1975)进行细胞实验。设计小干扰RNA 对hsa_circ_0002360 进行敲减,qRT-PCR 检测敲减效率。随后,通过CCK8、克隆形成实验及划痕实验证明了hsa_circ_0002360 可以促进肺腺癌细胞株的增殖及迁移。此外,有研究者通过生物信息数据库分析发现PODXL 为hsa_circ_0002360 的靶基因之一[6],细胞内PODXL 通过促进肿瘤细胞的迁移、侵袭及EMT,参与肿瘤发生、发展[12-14]。但是究竟hsa_circ_0002360 通过何种方式调控靶基因参与肺腺癌的进展我们还不得而知。
本研究发现,在肺腺癌患者血清中hsa_circ_0002360 的表达水平高于健康对照,并发现经过手术治疗,肺癌患者在术后第2 天血液中hsa_circ_0002360 的含量显著降低。因此,我们推测hsa_circ_0002360 可作为肺腺癌诊断及治疗的一种新的生物标志物。目前临床上肺癌的诊断大多通过影像学检查初次发现,随后进行有创的手术病理活检得以确诊。血清中肿瘤标志物的检测作为一种非侵入性的临床检验手段,检验方法简单,创伤性小,逐渐成为人们在健康体检时选择的筛查项目[15-16],例如胰腺、胆道肿瘤标志物为CA199[17],但目前肺腺癌的诊断还缺少相关的血清肿瘤标志物。本实验仅仅检测了肺癌患者术后第2 天血清中hsa_circ_0002360 的表达量,在以后的探究中可对术后及化疗后患者的血清以进行随访检测,进一步探究其在判断预后方面的价值。
综上所述,本研究表明,Hsa_circ_0002360 在人肺腺癌组织、血液中表达上调,其可以促进肺腺癌细胞增殖及迁移。Hsa_circ_0002360 在肺腺癌早期诊断及判断疗效方面具有较高的价值。Hsa_circ_0002360 可能成为新的肺腺癌早期诊断的标志物和治疗靶点。但Hsa_circ_0002360通过何种作用机制影响肺腺癌的发生发展还有待于进一步深入研究。