农杆菌介导的浸花法转化甘蓝型油菜过程中柱头顶端开裂时期的确定
2019-11-28王宁宁王伟杰王玉康曹维李明SundusZafar胡茂龙浦惠明谭小力
王宁宁 王伟杰 王玉康 曹维 李明 Sundus Zafar 胡茂龙 浦惠明 谭小力

摘要:农杆菌介导的浸花法(floral-dip)是一种简便、快速、高效、重复性好、稳定性高的非组织培养的遗传转化法,在拟南芥中已得到了广泛的应用,但由于诸多因素的影响,其在油菜中的转化效率受到了很大的制约。以甘蓝型油菜为研究对象,通过对雌蕊柱头开裂时间的研究,发现即将开放的10~15个花苞的柱头是裂开的,此时最有利于农杆菌进入子房室完成转化。对这部分花蕾进行浸花法转化,得到的T1代种子发芽后通过除草剂筛选获得抗性转基因植株,进一步对这些植株进行PCR验证,其阳性率高达72.7%。该研究能进一步提高农杆菌转化效率,实现甘蓝型油菜更有效的遗传转化。
关键词:甘蓝型油菜;浸花法;柱头开口;转化效率;农杆菌
中图分类号: S634.301文献标志码: A
文章编号:1002-1302(2019)18-0114-03
收稿日期:2018-06-30
基金项目:国家重点研发计划(编号:2016YFD0100305)。
作者简介:王宁宁(1991—),男,山东济南人,硕士研究生,研究方向为甘蓝型油菜功能基因组学。E-mail:wnn517tdx@163.com。
通信作者:谭小力,博士,研究员,研究方向为植物细胞中油脂合成代谢调控的关键因子和网络调控、多倍体植物功能基因组研究策略的建立、外源基因在植物中高水平表达及合成生物学平台的构建。E-mail:xltan@ujs.edu.cn。
油菜是四大油料作物之一,位居全球五大经济作物之列,是食用植物油和蛋白的重要来源。在油菜的遗传转化研究中,科研人员越来越青睐应用基因工程改良油菜品种,随着转基因技术的发展,用于外源基因的遗传转化方法越来越多,大体可分成2类:一类是农杆菌介导的遗传转化法;另一类是外源基因直接导入法,如基因枪法、聚乙二醇(PEG)介导法、电击法、激光微束穿刺法、显微注射法和花粉管通道法等[1-5]。其中农杆菌介导法在油菜的遗传转化中运用得最多。1985年,Horsch首次利用根癌农杆菌介导法获得转基因甘蓝型油菜[6]。农杆菌介导的浸花法转化是由真空渗透(vacuum infiltration in planta)转化法[7-8]简化而来的[9-10],只需将植株的花序浸泡在农杆菌转化液中几分钟,然后等种子成熟后即可通过筛选得到转基因的种子[11]。付绍红等在对甘蓝型油菜进行浸花法转化后,通过GUS(-葡萄糖苷酸酶)和GFP(绿色荧光蛋白)报告基因的瞬时表达检测发现,在转化植株未受伤的叶片表面、子房表皮、蜜腺、柱头均检测到GUS活性或GFP蛋白表达[12]。这说明农杆菌有可能通过以上部位进入受体植株细胞完成转化过程。之前的研究表明,农杆菌介导的浸花法转化主要侵染的是雌蕊而不是雄蕊,雌蕊中的胚珠是转化的靶细胞[13]。之前的研究发现,拟南芥的子房室不总是关闭,卵细胞发育突出,会延伸成瓶状结构并在顶部开口,花发育后期子房室顶部闭合。转化一般在花开放前5~10 d进行,此时雌蕊开放,农杆菌得以进入子房并将T-DNA转移到卵细胞[14]。油菜的发育与拟南芥类似,胚珠在最初发育阶段,先形成1个细胞环,进而形成1个顶端开口的瓶狀结构,结构的顶端约在开花前3 d形成柱头,随后顶端开口闭合,在此之前转化都有可能发生[15]。花开放后短时间内即完成授粉受精过程且柱头顶端已经闭合,此时的雌蕊已不适合进行转化。因此,利用农杆菌介导的浸花法进行转化时往往选择未开放的花蕾。本研究中,笔者通过对未开放花的雌蕊柱头开裂时间的研究,探究了农杆菌进入雌蕊子房室的最佳时间,从而能进一步提高农杆菌转化效率,实现甘蓝型油菜更有效的遗传转化。
1 材料与方法
1.1 材料
以甘蓝型油菜中双11为研究材料,材料由笔者所在实验室提供。含有携带Bar基因的质粒的农杆菌,菌种由笔者所在实验室提供。试验时间:2018年4月;试验地点:江苏大学生命科学研究院油菜试验田。
1.2 方法
1.2.1 雌蕊的固定及观察
取正常生长的油菜开花期待开放的花蕾,从靠近已开放花朵的第1个花蕾开始,由下至顶端依次取样并编号,将未开放的第1个花蕾命名为01号,第2个花蕾命名为02号,依次往上取样(对应的雄蕊编号分别为C01、C02……)。将花萼、花瓣及雄蕊去除,测量雌蕊长度并记录,然后将雌蕊置于福尔马林-醋酸-乙醇(FAA)固定液中[16],于4 ℃固定24 h。固定好后用扫描电镜观察柱头开口时间的差异情况。
1.2.2 农杆菌介导的浸花法转化油菜
将含有携带Bar基因的质粒的农杆菌通过浸花法转化甘蓝型油菜中双11。浸花前将已开放的花剪掉,保留10~15个待开放的花蕾用于浸花,将其余幼嫩的花蕾剪掉。将携带转化载体的农杆菌接种于250 mL LB培养基中摇菌培养至D600 nm为0.8~1.0左右,离心后用250 mL MS液体培养基重悬,并加入乙酰丁香酮、6- 苄氨基腺嘌呤(6-BA)及SilwetL-77。将花蕾浸入农杆菌悬浮液中浸泡5 min,浸花完成后套上羊皮纸带,花期结束后摘掉纸袋。待种子成熟后收获、储存[17]。
1.2.3 阳性转化株的筛选
用于转化的载体上携带有1个抗除草剂的筛选标记基因Bar,如图1所示,因而可以利用除草剂进行转基因植株的筛选。将浸花后收获的T1代油菜种子播种于托盘中,待幼苗长出1张真叶时通过喷洒除草剂筛选出阳性的转化株[18]。提取除草剂筛选后存活下来的油菜幼苗叶片基因组进行PCR验证,PCR扩增片段位置如图1所示,PCR扩增的引物序列如下:
Bar-F:5′-CTGAAGTCCAGCTGCCAGAAA-3′;
Bar-R:5′-CTGCACCATCGTCAACCACTA-3′。
2 结果与分析
2.1 柱头开裂情况观察
利用扫描电镜对FAA固定的甘蓝型油菜雌蕊柱头进行观察,发现并不是所有未开放花蕾的雌蕊柱头都是开口的,如图2所示,在所有扫描的雌蕊柱头中,只有编号靠前的10个左右的柱头是开口的,即最接近开放的10朵左右的花蕾柱头是开口的,这一部分花蕾在进行农杆菌浸花时,农杆菌最有可能通过柱头上的开口进入子房内部,进而完成转化。
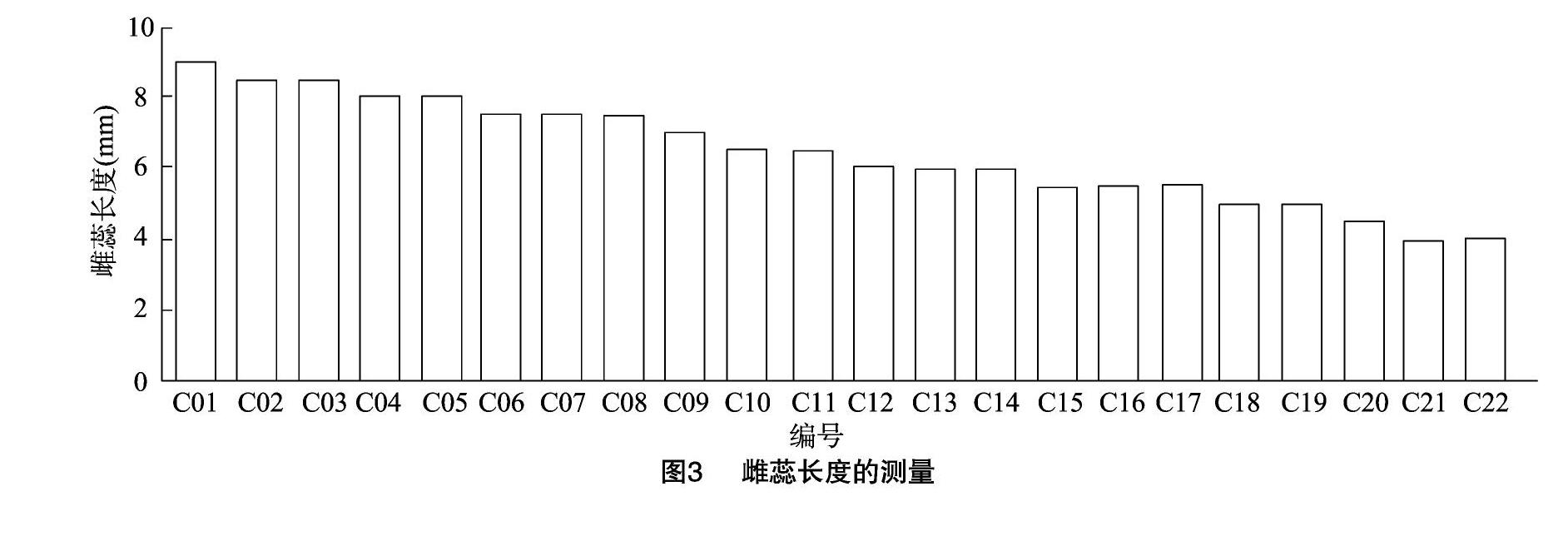
如图3所示,通过对雌蕊长度的测量,可以发现柱头开口的这一部分(C01~C12)雌蕊较其他雌蕊长度略长,发育较早,距离开花的时间也相对较短,便于进行转化。
2.2 阳性转化株的筛选
对浸花法转化得到的油菜种子萌发后的幼苗喷洒除草剂处理,部分油菜幼苗存活了下来,如图4所示。由于进行转化的载体上含有除草剂抗性基因Bar,其转基因植株对除草剂具有一定程度的抗性。因此这部分存活下来的油菜幼苗很有可能是转化成功的转基因植株。
2.3 阳性转化株的分子鉴定
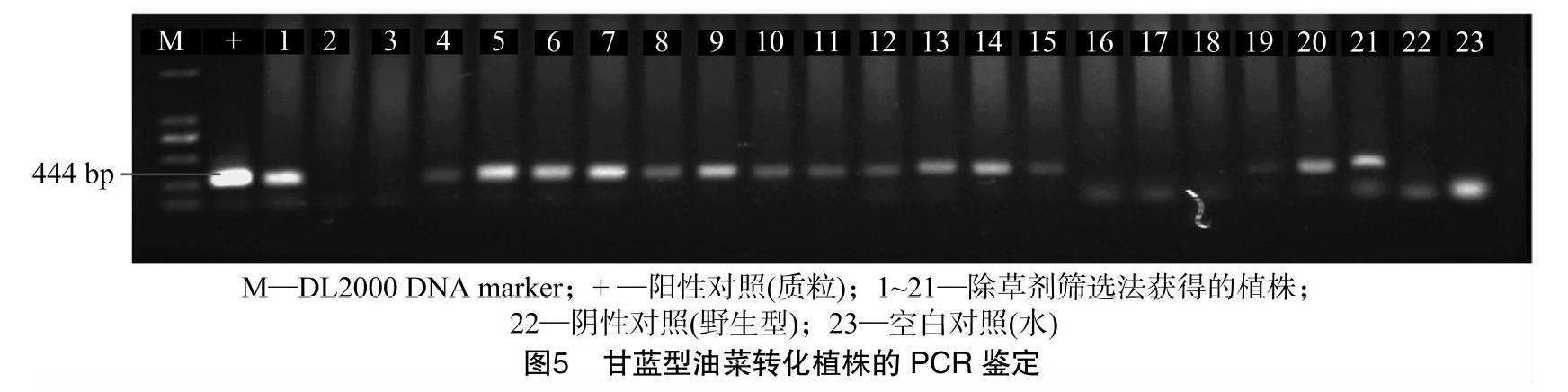
提取存活油菜幼苗的叶片基因组,PCR扩增Bar基因(图1)中444 bp的片段,由此来进一步验证存活的幼苗是否为转基因植株。如图5所示,存活植株中有很大一部分都扩增出了与质粒对照相同大小的条带,说明这部分植株确实为转基因植株,存活植株的阳性率约为72.7%。以上结果表明,对柱头开口时间的正确把握,对于提高油菜遗传转化效率具有重要作用。
3 讨论
随着甘蓝型油菜研究的不断深入,建立一种高效、便捷的油菜遗传转化体系是非常有必要的。农杆菌介导的浸花法是一种简便、快速、高效、重复性好、稳定性高的非组织培养的遗传转化法,对于甘蓝型油菜的研究具有重要意义,已经应用到了油菜的遗传转化中[19-22],但在实际应用中存在的各种因素导致油菜转化效率非常低。本试验通过扫描电镜,对油菜雌蕊柱头的开口时间进行了观察,发现并不是所有未开放花蕾的雌蕊柱头都是开口的,只有最接近开放的10~15个的花蕾柱头是开口的。这一部分花蕾在进行农杆菌浸染时,由于雌蕊顶端有开口,便于农杆菌进入子房内部,进而完成转化。对浸花法获得的油菜种子萌发后的幼苗进行除草剂筛选及PCR鉴定,发现存活下来的油菜幼苗为转基因植株的比例达到72.7%,这一结果也证实了该方法的可靠性,即通过正确把握油菜雌蕊的开口时间,选择最恰当的油菜花蕾进行浸花转化,将会大大提高油菜的遗传转化效率,对甘蓝型油菜的研究具有重要意义。
参考文献:
[1]王 军,付爱根,徐 敏,等. 基因枪法在遗传转化中的研究进展[J]. 基因组学与应用生物学,2018,37(1):459-468.
[2]张雷刚,罗淑芬,周宏胜,等. PEG介导的黑附球菌遗传转化体系的建立[J]. 菌物学报,2018,37(2):205-214.
[3]朱文静,马 飞,孙春玉,等. 电击法介导的人参大片段DNA转化灵芝原生质体的研究[J]. 特产研究,2015(1):21-28.
[4]刘桂珍,蓝海燕,田颖川,等. 利用激光微束穿刺法获得抗黄萎病转基因棉花的研究[J]. 中国激光,2000,27(3):279-283.
[5]冼康华,付传明,何金祥,等. 花粉管通道法介导的铁皮石斛转基因技术[J]. 广西植物,2017,37(9):1101-1110.
[6]Horsch R B. A simple and general method for transferring genes into plants[J]. Science,1985,227(4691):1229-1231.
[7]金万梅,巩振辉,吕元红. 芥菜植株原位真空渗入遗传转化方法的研究[J]. 华北农学报,2004,19(3):8-12.
[8]王道杰,杨翠玲,陆 鸣. 真空渗透法转化油菜及转化种子的筛选[J]. 植物学报,2009,44(2):216-222.
[9]Clough S J, Bent A F. Floral dip:a simplified method for agrobacterium-mediated transformation of Arabidopsis thaliana[J]. The Plant Journal,1998,16(6):735-743.
[10]Chung M H,Chen M K,Pan S M. Floral spray transformation can efficiently generate Arabidopsis transgenic plants[J]. Transgenic Research,2000,9(6):471-476.
[11]高建强,梁 华,赵 军. 植物遗传转化农杆菌浸花法研究进展[J]. 中国农学通报,2010,26(16):22-25.
[12]付绍红,牛应泽,杨洪全,等. 表面活性剂silwet-77对floral-dip转化甘蓝型油菜效果的影响[J]. 分子植物育种,2004,2(5):661-666.
[13]Desfeux C,Clough S J,Bent A F. Female reproductive tissues are the primary target of Agrobacterium-mediated transformation by the Arabidopsis floral-dip method[J]. Plant Physiology,2000,123(3):895-904.
[14]Wiktoreksmagur A,Hnatuszkokonka K,Kononowicz A K,et al. Flower bud dipping or vacuum infiltration-two methods of Arabidopsis thaliana transformation[J]. Russian Journal of Plant Physiology,2009,56(4):560-568.
[15]Bechtold N,Jaudeau B,Jolivet S,et al. The maternal chromosome set is the target of the T-DNA in the in planta transformation of Arabidopsis thaliana[J]. Genetics,2000,155(4):1875-1887.
[16]许晨光,刘泽涛,苑少华,等. 不同固定液对小麦花粉母细胞微丝骨架荧光标记的效果[J]. 作物杂志,2012(4):13-16,161.
[17]陈 盛,王宁宁,王玉康,等. 一种快速高效筛选甘蓝型油菜转化植株的方法[J]. 江苏农业学报,2017,33(5):982-985.
[18]陈 盛. 激活标签法构建油菜突变体库及油菜BnLACS9基因的功能研究[M]. 镇江:江苏大学,2017.
[19]贺热情. 油菜突变体库构建与激素反应基因克隆分析[M]. 長沙:湖南大学,2009.
[20]张经军. 甘蓝型油菜(Brassica napus)WRI1同源基因克隆及功能初步分析[M]. 石家庄:河北师范大学,2007.
[21]赵小英,唐冬英,黄星群,等. 油菜突变体库构建与激素反应基因克隆分析[J]. 湖南大学学报(自然科学版),2009,36(9):67-72.
[22]朱福各. 油菜长链脂酰CoA合成酶基因的克隆与功能鉴定[M]. 镇江:江苏大学,2010.
