GA3和ABA对马铃薯薯形的影响
2019-11-28胡月清

摘要:采用高效液相色谱串联质谱法测定马铃薯2个不同薯形品种会-2和PB06成熟块茎中植物激素赤霉素(GA3)及脱落酸(ABA)的含量,发现椭圆薯形品种会-2成熟块茎中GA3含量高、ABA含量低,相反圆薯形品种PB06块茎中GA3含量低、ABA含量高。由此推测,植物激素ABA和GA3可能参与调控马铃薯块茎形状的发育。外源添加植物生长调节剂GA3及ABA同样影响试管薯的形状。添加0.01 μmol/L GA3,试管薯纵茎与横径的比值增加到150;添加5 μmol/L ABA,块茎纵径与横茎的比值轻微下降,与对照相比没有显著差异。但是同时添加0.01 μmol/L GA3和5 μmol/L ABA,试管薯纵茎与横径的比值相对单独添加0.01 μmol/L GA3显著降低到1.37。因此,ABA和GA3在调控试管薯的薯形中起到拮抗效应,该作用可能是通过影响薯形相关基因的表达或关闭而实现的。
关键词:马铃薯;薯形;脱落酸(ABA);赤霉素(GA3);块茎形态;拮抗效应
中图分类号:S532.01文献标志码: A
文章编号:1002-1302(2019)18-0125-04
收稿日期:2018-06-14
基金项目:江西省教育厅科学技术研究项目(编号:GJJ161010)。
作者简介:胡月清(1980—),女,江西抚州人,博士,讲师,主要从事植物激素与生长发育研究。Tel:(0795)3202591;E-mail:huyueqing427@163.com。
薯形是马铃薯的一个重要农艺性状,野生种薯形非常丰富[1],但是由于只有形状优良、整齐一致的薯形才被育种者选择和保留,所以栽培种的薯形变异较少,大多为圆形、椭圆形、长形3种类型[2]。薯形不但是品种鉴别的重要依据,也是不同食品加工需求的重要筛选指标。长薯形的马铃薯通常被用作加工成薯条,而圆薯形的马铃薯通常被加工成薯片。相对马铃薯产量及抗性的研究,目前关于薯形方面的研究较少[3]。1个世纪前,Salaman发现薯形的遗传符合孟德尔遗传定律[4],并且圆薯形对长薯形是显性[5]。1985年,Masson将控制圆薯形的基因命名为Ro,并确定该基因距着丝粒12.2 cm[6]。随后,van Eck等将Ro基因定位在第10号染色体上并指明它是控制薯形遗传的主效位点,其贡献率达到75%[7]。随着研究手段的丰富,控制薯形的作用位点相继被鉴定出来。Sliwka等利用RAPD标记构建遗传图谱,将薯形相关的基因定位到第2、第11号染色体上[8]。Prashar等通过构建SNP连锁图谱,将与薯形相关较大的QTL位点定位于第10、第2号染色体上,其中位于第10号染色体上的位点是主效位点[9],位置与van Eck等报道的Ro基因[7]几乎一致。2014年全基因组关联分析(genome-wide association study,GWAS)首次被运用在薯形研究中,并发现4个与薯形遗传相关的位点分别在第2、第10、第11、第12号染色体上,该结果进一步对已知的薯形相关位点进行了验证[10]。目前多个薯形相关基因得到了开发和验证[11-13]。块茎的诱导受赤霉素(GA3)和脱落酸(ABA)等多种植物激素的控制[14],而形态的建成伴随着块茎的发育而发生。既然GA3和ABA可以拮抗地调控块茎的形成,那么它们也有可能调控块茎的形态建成即薯形,本研究正是基于此推测而展开的。
1 材料与方法
1.1 试验材料
研究材料为椭圆形薯形材料会-2及圆薯形材料PB06。
1.2 材料培养
将脱毒苗带腋芽的单茎段接种于MS培养基(30 g/L蔗糖、0.75%琼脂粉,pH值为5.8)中,于22 ℃、光照16 h/d下培养。生长3~4周后,将长势一致的完全展开6~7张叶片的会-2及PB06脱毒苗经过4 d的炼苗、移栽至塑料盆中。2016年9月于湖南农业大学植物激素与生长发育湖南省重点实验室网室进行盆栽试验。等到2个品种马铃薯块茎完全成熟时,对马铃薯块茎取样,用液氮研磨成粉末,测定植物激素的含量。
为了研究ABA和GA3在试管薯形态发育中的作用,将基础MS培养基中添加8%蔗糖培养20 d的会-2试管薯的形态作为对照。分别添加5 μmol/L ABA、0.01 μmol/L GA3、0.1 μmol/L GA3及混合添加0.01 μmol/L GA3和5 μmol/L ABA,观测试管薯的形态。
1.3 植物激素的测定
采用高效液相色谱串联质谱法测定GA3及ABA的含量,植物激素的提取和纯化参照参考文献[15-16]的方法进行。首先,称取200 mg左右鲜样液氮冷冻后迅速用组织匀浆机(QIAGEN,Germany)匀浆,加入1.5 mL 80% 甲醇和5 μL内标(20 μg/mL 2H6-ABA、2H2-GA3)于4 ℃冰箱中浸提8 h 以上。12 800 r/min离心10 min,上清液冷冻浓缩至干后用200 μL磷酸钠缓冲液(pH值7.8)溶解,12 800 r/min离心10 min,取20 μL上清经高效液相色谱分离纯化,80%甲醇洗脱液再次冷冻浓縮至干。用40 μL 10%甲醇溶解,12 800 r/min 离心10 min,取5 μL通过液相色谱-质谱联用仪(LC-MS/MS)检测和分析。
ABA质谱方法:采用负离子模式,质谱多反应监测(MRM)检测,ESI电离源,雾化气流速为3 L/min,干燥气流速为15 L/min,脱溶剂管温度为280 ℃,加热模块温度为480 ℃,ABA(m/z)为262.9/153,碰撞能15 V,2H6-ABA(m/z)为269.35/159.25,碰撞能15 V。GA3质谱方法:雾化气流速为3 L/min,干燥气流速为15 L/min,脱溶剂管温度为250 ℃,加热模块温度为450 ℃,GA3(m/z)为345.1/143.1,碰撞能30 V。
1.4 块茎及试管薯形态测定
用游标卡尺分别测定成熟的马铃薯块茎及培养20 d试管薯的最大纵茎表示块茎长度、最大横径表示块茎宽度;再用纵茎与横径的比值表示薯形。
1.5 数据处理
所有数据均为3次生物学重复的“平均值±标准差”,采用DPS 14.50进行数据的統计分析。
2 结果与分析
2.1 会-2和PB062个品种成熟块茎形态及其ABA和GA3含量的比较
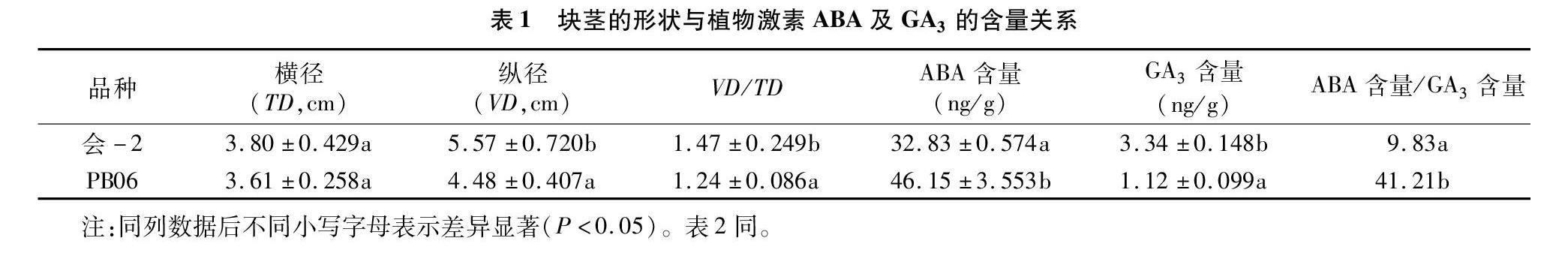
收获成熟期的2个马铃薯栽培品种,外形观察发现会-2成长椭圆形,而PB06成圆形(图1-A)。进一步用游标卡尺测量块茎的横径和纵径,并计算纵径与横径的比值(去除纵径或横径小于3 cm的数值)。结果表明,成熟期的2个品种的横径没有显著差别,会-2的纵径比PB06的纵径显著增长,会-2纵径与横径的比值为1.47,而PB06纵径与横径的比值显著偏低,为1.24(表1)。
会-2成熟块茎ABA的含量为32.83 ng/g,而PB06的含量为46.15 ng/g;会-2成熟块茎GA3的积累为3.43 ng/g,PB06为1.12 ng/g。PB06中ABA含量与GA3含量的比值为41.21,会-2为9.83(表1)。上述结果表明,ABA与GA3的含量或者它们的比值与马铃薯块茎的形状相关,ABA含量高、GA3含量低,换言之即ABA与GA3比值较大的品种块茎的形状接近圆形,相反块茎的形状接近长椭圆形。
2.2 外源植物生长调节剂ABA及GA3对试管薯形态的调控
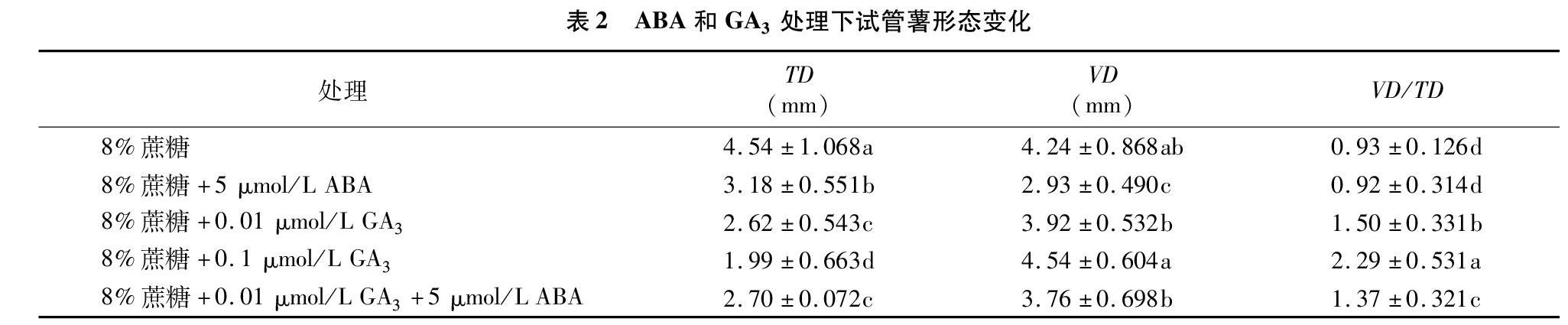
为了进一步验证ABA及GA3含量与块茎形态的关系,以及它们对块茎形态建成的作用是否与块茎形成一样存在拮抗效应。因此,以会-2为研究材料开展试管薯验证体系。8%蔗糖培养基中添加5 μmol/L ABA后,试管薯的体积变小,横径和纵径都变短,但是纵径与横径的比值没有显著变化。添加0.01 μmol/L GA3后,横径显著变小,纵径变化不显著,纵径与横径的比值显著增加,比值达到1.50,也就是说试管薯变得更呈长椭圆形了。随着GA3含量的增加,横径进一步变小,纵径则进一步更加,此时横径与纵径的比值最大,达到2.29,试管薯的外形显得更细长。在8%蔗糖培养基中同时添加0.01 μmol/L GA3和5 μmol/L ABA,发现ABA减缓了GA3导致的试管薯变长的效应,此时试管薯纵径与横径的比值为1.37,相对只添加0.01 μmol/L GA3减小,但是仍然比单独添加8%蔗糖及8%蔗糖与5 μmol/L ABA组合显著增加。不同处理下试管薯薯形外观变化见图1,薯形测量数据见表2。上述结果表明,生长调节剂GA3可使得试管薯变长;生长调节剂ABA可使试管薯变圆,但与对照相比差异并不显著;且ABA可以拮抗GA3对试管薯变得更加椭圆的效应。该试验结果与“内源植物激素ABA含量低、GA3含量高,块茎则更显得椭圆(纵径与横径的比值增加)”相一致。所以,植物激素ABA与GA3可以影响试管薯的形态。
3 讨论与结论
薯形是马铃薯的一个重要外观品质,无论是直接鲜食,还是加工成各种产品后食用,对块茎的形状都有严格的要求。为了方便去皮,鲜食消费者往往选择块茎大小均匀、形状规则的品种。圆薯形品种大西洋(Atlantic)是炸薯片的最佳选择,长形品种夏波蒂(Shepody)和布尔班克(Burbank)则是炸薯条的最适品种。所以,薯形的遗传研究对于选育满足食品工业不同加工需求和鲜薯消费需求的新品种具有十分重要的意义。
本研究的2个品种PB06和会-2分别是圆薯形品种和椭圆形薯形品种。在研究植物激素对块茎发育的调控时发现,长薯形品种会-2的块茎中相对圆薯形品种PB06具有更高的GA3含量、GA3含量/ABA含量的值和更低的ABA含量。由此推测,植物激素GA3和ABA可能与块茎的形态建成相关。试管薯体系的验证结果表明,添加0.01 μmol/L GA3后试管薯的薯形显著变长,当添加0.1 μmol/L GA3后纵径与横径的比值达到2.29,而同时添加ABA后纵径与横径的比值缩小,该结果与上述“高ABA含量、低GA含量的马铃薯品种为圆形,反之为椭圆形(长形)”的结果相一致。
ABA与GA3是一对经典的植物激素组合,二者在种子的休眠与萌发、根的发育及开花等方面都表现出拮抗的生物学效应,因此它们的平衡对植物生长发育是必要的[17-18]。块茎形成过程中ABA与GA3也存在拮抗效应,GA3为抑制块茎形成的植物激素,而ABA是促进因子[19-21,14],马铃薯块茎的形态建成与块茎发育是同步的,既然ABA与GA3拮抗调控块茎的形成,那么它们对薯形的形成可能也有类似的作用。但是,这种拮抗效应是如何产生的、有哪些因子在精细调控这种拮抗、这2种植物激素合成及信号途径的重要基因与已知的薯形控制基因间存在怎样的互作关系,是今后研究须要解决的重要科学问题。
参考文献:
[1]Glendinnin D R.Potato introductions and breeding up to the early 20th century[J]. New Phytologist,1983,94(3):479-505.
[2]Uitdewilligen J.Discovery and genotyping of existing and induced DNA sequence variation inpotato[D]. Wageningen:Wageningen University,2012.
[3]van Eck H J.Genetics of morphological and tuber traits[J]. Potato Biology and Biotechnology,2007,91-115.
[4]Salaman R N.The inheritance of colour and other characters in the potato[J]. Journal of Genetics,1911,5(1):192-193.
[5]Jong H D,Bums V J.Inheritance of tuber shape in cultivated diploid potatoes[J]. American Potato Journal,1993,70(3):267-284.
[6]Masson M F.Mapping,combining abilities,heritabilities and heterosis with 4X × 2X crosses in potato[D]. Madison:Wisconsin University,1985.
[7]van Eck H J,Jacobs J M,Stam P,et al.Multiple alleles for tuber shape in diploid potato detected by qualitative and quantitative genetic analysis using RFLPs[J]. Genetics,1994,137(1):303-309.
[8]Sliwka J,Wasilewicz-Flis I,Jakuczun H,et al. Tagging quantitative trait loci for dormancy,tuber shape,regularity of tuber shape,eye depth and flesh color in diploid potato originated from six Solanum species[J]. Plant Breed,2008,127(1):49-55.
[9]Prashar A,Hornyik C,Young V,et al.Construction of a dense SNP map of a highly heterozygous diploid potato population and QTL analysis of tuber shape and eye depth[J]. Theoretical and Applied Genetics,2014,127(10):2159-2171.
[10]DHoop B B,Keizer P L C,Paulo M J,et al. Identification of agronomically important QTL in tetraploid potato cultivars using a marker-trait associationanalysis[J]. Theoretical and Applied Genetics,2014,127(3):731-748.
[11]朱文文,徐建飛,李广存,等. 马铃薯块茎形状基因CAPS标记的开发与验证[J]. 作物学报,2015,41(10):1529-1536.
[12]沈云龙. 马铃薯薯形相关基因序列分析及光敏色素影响块茎形成初步研究[D]. 武汉:华中农业大学,2013.
[13]陈 娜. 马铃薯薯形基因位点标记开发与物理图谱构建[D]. 北京:中国农业科学院,2017.
[14]Dutt S,Manjul A S,Raigond,et al.Key players associated with tuberization in potato:potential candidates for geneticengineering[J]. Critical Reviews in Biotechnology,2017,37(7):942-957.
[15]Liu X,Yang Y L,Lin W H,et al.Determination of both jasmonic acid and methyl jasmonate in plant samples by liquid chromatography tandem mass spectrometry[J]. Chinese Science Bulletin,2010,55(21):2231-2235.
[16]Zhou L J,Xiao L T,Xue H W.Dynamic cytology and transcriptional regulation of rice lamina joint development[J]. Plant Physiology,2017,174(3):1728-1746.
[17]Shu K,Zhang H W,Wang S F,et al.ABI4 regulates primary seed dormancy by regulating the biogenesis of abscisic acid and gibberellins inArabidopsis[J]. PLoS Genetics,2013,9(6):e1003577.
[18]Shu K,Zhou W G,Yang W Y.APETALA 2-domain-containing transcription factors:focusing on abscisic acid and gibberellins antagonism[J]. New Phytologist,217(3):977-983.
[19]Xu X,Lammeren A A M V,Vermeer E,et al.The role of gibberellin,abscisic acid,and sucrose in the regulation of potato tuber formation in vitro[J]. Plant Physiology,1998,117(2):575-584.
[20]Noelia M G M,Stritzler M,Capiati D A.Heterologous expression of Arabidopsis ABF4 gene in potato enhances tuberization throughABA-GA crosstalk regulation[J]. Planta,2014,239(3):615-631.
[21]胡月清,詹 爽,库文珍,等. ABA和GA3对马铃薯试管薯形成及淀粉积累的协同调控[J]. 分子植物育种,2017,15(10):4210-4214.
