利用LPS诱导胚胎期斑马鱼炎症模型研究羊栖菜多酚抗炎机制
2019-11-27,*
,*
(1.中国海洋大学食品科学与工程学院,山东青岛 266003;2.中国科学院海洋研究所,山东青岛 266071)
羊栖菜(Sargassumfusiforme)是一种药食两用的褐藻,是我国五种大型养殖经济海藻之一[1]。羊栖菜的野生资源在我国分布广泛,主要生长在辽东半岛、山东、浙江、福建、广东以及雷州半岛等沿海海域,其中浙江省洞头县是我国最主要的养殖基地,被称为“中国羊栖菜之乡”。羊栖菜富含多种活性成分,如褐藻糖胶,岩藻黄素,褐藻多酚等。课题组前期研究中,制备了羊栖菜的多酚(SFPC)粗提物,其多酚含量高达88.48±0.30 mg/100 mg,高于其他众多褐藻[2]。褐藻多酚(phenolic compounds,PC)通过乙酸-丙二酸途径,以间苯三酚(1,3,5-三羟基苯)为基本结构单元,通过不同聚合度和连接方式,构成一类含有酚羟基的次级代谢产物[3]。近年来褐藻多酚的生物活性逐渐被关注,例如抗氧化[4]、抗炎[5]、抗癌[6]、美白、抑菌[7]等。Cha等[8]从Ecklonia cava中分离出四种褐藻多酚通过评估UVB辐射诱导细胞损伤的斑马鱼体内模型,发现褐藻多酚能显著减少斑马鱼胚胎中的活性氧和NO产生水平,并能保护胚胎、减少色素沉着。Yoon等[9]从E. cava分离出的phloroglucinol,dioxinodehydroeckol和7-phloroeckol对B16F10小鼠黑色素瘤细胞中酪氨酸酶有明显的抑制作用。以上研究说明,褐藻多酚在抵抗外界不利因素,如紫外线、肿瘤和老年痴呆等方面具有较强的活性。课题组前期体外巨噬细胞实验结果表明SFPC具有良好抗炎活性,在200 μg/mL浓度下,NO抑制率可达47.2%,抑制活性高于现有抗炎药地塞米松[10]。但目前缺乏羊栖菜多酚体内抗炎活性的研究报道,使其高值化应用受限。
活性氧(ROS)和NO在免疫系统信号传递中至关重要,但过量的ROS和NO也会导致多种生理生化损害,破坏机体正常代谢功能,甚至导致细胞死亡和组织炎症[11-14]。荧光探针染料2,7-二氯二氢荧光素二乙酸酯(DCFH-DA)和4-氨基-5-甲氨基-2,7-二氟荧光素二乙酸酯(DAF-FM DA)可被胞内酯酶水解成不能透过细胞膜的DCFH和DAF-FM。细胞内ROS在过氧化物酶存在下氧化DCFH生成有荧光的二氯荧光素(DCF)[15],DAF-FM与NO反应产生强荧光[16],荧光强度可显示机体细胞内ROS和NO的相对水平。
斑马鱼(Daniorerio)是一种硬骨鱼,属于幅鳍亚纲鲤科短担尼鱼属[17]。由于其个体小,繁殖能力强,养殖成本低,胚胎透明,易于实验观察等优势被遗传学、人类疾病研究、药物研发等领域列为模式生物[18-21]。近年来,已有利用斑马鱼模型评价海洋褐藻多糖、多酚等物质生物活性的相关研究报道[22-23],但未见利用斑马鱼模型研究SFPC抗炎活性的报道。
本实验在课题组前期利用巨噬细胞模型研究体外抗炎活性的基础上,首次利用斑马鱼炎症模型,研究SFPC的体内抗炎活性,为其在功能性食品和化妆品中的应用奠定理论基础。
1 材料与方法
1.1 材料与仪器
羊栖菜(于2014年5月收获自浙江省洞头县);成年野生AB系斑马鱼 中国海洋大学医药学院分子医学生物学实验室提供;脂多糖(LPS),吖啶橙,4-氨基-5-甲氨基-2,7-二氟荧光素二乙酸酯(DAF-FM DA),三卡因,2,7-二氯荧光黄双乙酸盐(DCFH-DA) 美国sigma公司;氯化钠,氯化钾,氯化钙,硫酸镁,盐酸,亚甲基蓝 分析级,上海国药集团化学试剂有限公司;胚胎培养液(10% NaCl,0.3% KCl,0.3% CaCl2,0.79% MgSO4,0.1%亚甲基蓝)。
斑马鱼全自动循环养殖系统 北京爱生科技发展有限公司;SZ61体式显微镜 日本奥林巴斯;DMI 6000B倒置荧光显微镜 德国Leica 公司;Milli Q纯水机 默克密理博实验室设备(上海)有限公司;FA2004B电子天平 上海天美天平仪器有限公司;冷冻干燥机FD5-2.5 北京金西盟仪器有限公司。
1.2 实验方法
1.2.1 SFPC的制备 SFPC的制备方法参考Li等[2]的报道。羊栖菜用蒸馏水冲洗干净,冷风干燥后,粉碎后过60目筛得羊栖菜海藻干粉,于-20 ℃保存。将海藻干粉按料液比1∶30加入30%乙醇中,在25 ℃的恒温震荡摇床中震荡提取30 min后过滤,取上清加入等体积的乙酸乙酯萃取3次,合并萃取液,将乙酸乙酯旋蒸除去,加入少量蒸馏水复溶,冻干后存于-20 ℃冰箱中待用。
1.2.2 斑马鱼喂养及胚胎收集 成年野生AB系斑马鱼饲养于全自动循环系统中,水温设置为(26±1) ℃,照明按14 h/10 h(光照/黑暗)交替进行,每日以丰年虾(卤虫)于早晚各饲喂一次[24]。实验用胚胎由健康雌雄鱼自然交配获得。收集数百枚胚胎于干净培养皿中并及时移除排泄物、杂质及未受精胚胎,加入胚胎培养液,转移于(28.5±1) ℃恒温培养箱中培养7~9 h,备用。
1.2.3 胚胎给药 筛选受精且发育至7~9 hpf(hours post fertilization)时期斑马鱼胚胎,移入24 孔细胞培养板中,每孔15枚胚胎,除去残留培养液后,根据实验设计,LPS诱导组每孔分别加入终浓度为5、8、10、16、20 μg/mL的LPS,实验组为LPS+终浓度为50、100、200 μg/mL的SFPC活性物,SFPC用二甲亚砜(DMSO)配制成高浓度贮液,用时用胚胎培养液稀释至相应浓度工作液且各组中DMSO浓度低于0.5%;空白对照组为含0.5%DMSO的胚胎培养液,给药方式均是将诱导物或活性物溶于胚胎培养液进行浸泡处理,每个浓度3个孔(平行)[24]。活性物或诱导物给药后,将24孔板转移于(28.5±1) ℃恒温培养箱中继续培养且每日更换培养液,待后续观察及检测。
1.2.4 LPS诱导斑马鱼炎症模型优化 根据文献报道[23,25],选择不同浓度(5、8、10、16、20 μg/mL)LPS,进行单因素的炎症诱导模型优化。对受精且发育至8~9 hpf胚胎给药,72 hpf时期进行存活率、心跳速率、ROS生成率的检测。
1.2.5 SFPC抗炎活性评价 选择无毒性的羊栖菜安全浓度[10]于7~8 hpf进行胚胎给药,在(28.5±1) ℃恒温培养箱中预孵育1 h,然后直接加入终浓度8 μg/mL的LPS诱导浓度进行炎症诱导,48 hpf进行卵黄囊大小的检测,72 hpf时期进行胚胎存活率、心跳速率、细胞死亡率、ROS生成率和NO生成率[12]的检测。
1.2.6 指标测定
1.2.6.1 斑马鱼存活率统计 参考Kim等[26]的报道,各实验组加药后注意每日8:30~22:00,每隔2 h观察胚胎发育状况,及时移除死亡胚胎并记录,统计各组胚胎发育至72 hpf时期存活率情况。
存活率(%)=存活胚胎数/总胚胎数×100
1.2.6.2 幼鱼卵黄囊大小测定 参考Lee等[23]的报道对各组出膜幼鱼进行卵黄囊大小测定。实验幼鱼胚胎达48 hpf时期(彻底脱膜后),用带摄像头的体式显微镜(25×)对摆位后的幼鱼拍照并计算各组与空白组卵黄囊大小之比。
卵黄囊大小(%)=给药组卵黄囊面积/空白组卵黄囊面积×100
1.2.6.3 幼鱼心跳速率检测 参考Wijesinghe等[27]的报道对各组出膜幼鱼进行心跳速率统计。实验幼鱼胚胎达48 hpf时期(彻底脱膜后),对各组幼鱼心跳进行30 s人工计数(注意环境温度在28.5±1 ℃的恒温条件下),并计算各组与空白组心跳速率之比。
1.2.6.4 斑马鱼幼鱼体内荧光染色及各荧光强度的分析 参考邹娅雪等[28]的报道,对各组胚胎发育至72 hpf幼鱼时期,随机选择各组胚胎数条对其进行荧光染色。荧光染料包括观察幼鱼体内ROS水平变化的DCFH-DA、观察幼鱼体内NO水平变化的DAF-FM DA以及观察幼鱼体内细胞死亡率的吖叮橙。28.5±1 ℃的恒温条件下,利用DCFH-DA(20 μg/mL)、DAF-FM DA(20 μg/mL)和吖啶橙(7 μg/mL)对各组幼鱼分别避光染色孵育1 h、2 h和30 min。染色孵育后,先用胚胎培养液洗涤幼鱼3~5次,后用0.03%三卡因麻醉幼鱼,最后将幼鱼置于荧光显微镜下捕获相应荧光图片,并用image J软件分析、统计相对荧光强度。
ROS生成率/NO生成率/细胞死亡率(%)=给药组荧光强度/空白组荧光强度×100
1.3 数据分析
所有实验至少重复三次,结果以means±S.D表示,通过one-way ANOVA对实验结果进行统计学分析,运用多重比较Turkey检验分析实验数据间的差异性。所示结果中,P<0.05判断为具有显著性差异。
2 结果与分析
2.1 LPS诱导斑马鱼炎症模型优化结果
2.1.1 LPS诱导浓度对斑马鱼胚胎存活率的影响 如图1所示,空白组胚胎存活率为100%,且各组行间均无死亡。经过不同实验浓度LPS处理后,均导致了一定数量的胚胎死亡现象,且胚胎存活率与LPS诱导浓度呈剂量依赖性下降。LPS诱导浓度在5 μg/mL时,诱导组胚胎的存活率与空白组无显著性差异(P>0.05);而当浓度高于8 μg/mL时,诱导组胚胎的存活率与空白组表现出显著性差异(P<0.05);且在高浓度(16、20 μg/mL)时,胚胎存活率降至20%和2%,死亡率较高,因此选择LPS终浓度为5、8、10 μg/mL进行后续实验。
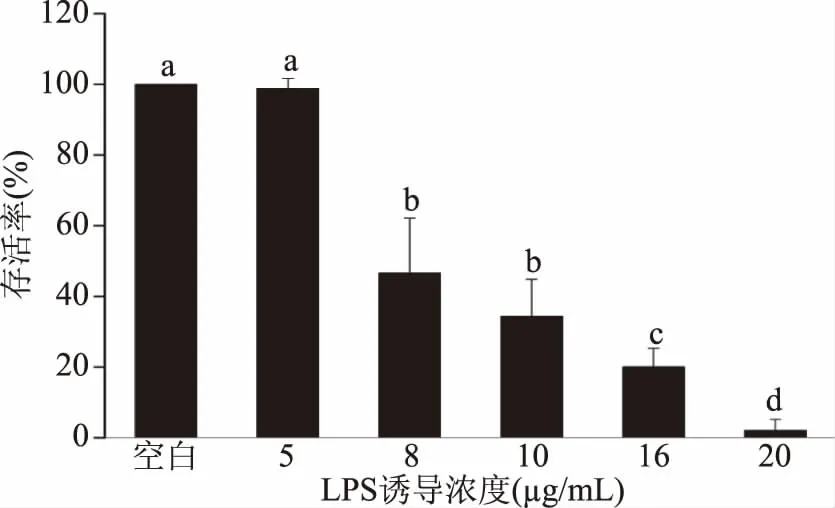
图1 LPS诱导浓度对斑马鱼胚胎存活率的影响Fig.1 Effect of LPS-induced concentrationon the survival rate of zebrafish embryo
2.1.2 LPS诱导浓度对斑马鱼心跳速率及ROS生成率的影响 对可以满足后续炎症造模指标的各诱导浓度组进行心跳速率和ROS生成率的测定,心跳速率结果如图2所示,LPS诱导组加快了幼鱼心跳速率,表明LPS在该浓度梯度下,斑马鱼出现炎症表型。在LPS浓度为8 μg/mL时,与空白组相比,斑马鱼心跳速率提高至117.82%(P<0.05),心跳速率最快,炎症反应最显著。

图2 LPS诱导浓度对斑马鱼心跳速率的影响Fig.2 Effect of LPS-induced concentrationon the heart-beating rate in vivo
LPS诱导浓度为5、8、10 μg/mL对斑马鱼幼鱼体内ROS水平的影响结果如图3所示。由图可知,未经LPS诱导的空白组斑马鱼体内的荧光强度较弱,ROS水平较低,当给予斑马鱼一定浓度的LPS 诱导后,其体内的荧光强度增强,ROS水平增高,即一定浓度的LPS诱导提高了斑马鱼幼鱼体内的ROS水平。在此研究中,8 μg/mL LPS诱导浓度可极显著提高斑马鱼体内的ROS水平近4倍,与Fernando等[29]报道利用10 μg/mL LPS诱导的ROS水平相当,是本研究中LPS诱导炎症造模的最优浓度。因此,后续实验选择最优LPS浓度8 μg/mL进行炎症造模诱导。
2.2 SFPC抗炎活性评价结果
2.2.1 不同浓度SFPC对斑马鱼卵黄囊大小的影响 斑马鱼从胚胎到幼鱼时期无需其他营养供给,可仅利用卵黄囊中营养存活至7 d[30],因此,卵黄囊大小对胚胎发育至关重要。由图4可知,LPS诱导组的胚胎48 h后发育迟缓,卵黄消耗少,卵黄囊大小比空白组大1.279倍,差异显著(P<0.05)。而SFPC处理组的卵黄囊大小随着其浓度的增加逐渐降低,直至高剂量组下与空白组无显著性差异(P>0.05),说明SFPC能抑制LPS诱导造成的胚胎发育缓慢的炎症反应,提高胚胎发育速度,使卵黄消耗逐渐恢复正常,表明SFPC对LPS诱导的斑马鱼炎症反应造成的发育迟缓有抑制作用,进一步证明SFPC能在斑马鱼胚胎受到LPS等外界刺激时起到积极的保护作用。
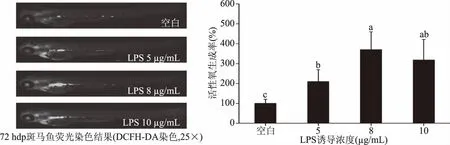
图3 LPS诱导浓度对斑马鱼体内ROS生成率的影响Fig.3 Effect of LPS-induced concentration on the ROS production rate in vivo
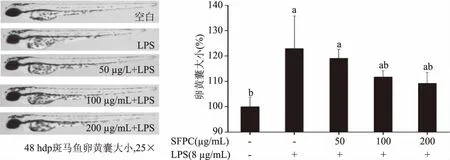
图4 不同浓度多酚对斑马鱼胚胎卵黄囊大小的影响Fig.4 Effect of different concentrations of phenolic compounds on the yolk sac size of LPS-induced zebrafish embryos注:+即前期给药;-即前期未给药。
2.2.2 不同浓度SFPC对斑马鱼胚胎存活率和心跳速率的影响 图5是不同浓度SFPC对LPS诱导的斑马鱼胚胎存活率的结果。从图5中可以看出,与空白对照组相比,LPS诱导后的72 hpf胚胎存活率显著下降至30%左右(与图1无差异),而不同浓度SFPC预处理后,胚胎存活率呈剂量依赖性升高。当SFPC浓度达到200 μg/mL时,其存活率达到66.67%。以上结果表明,SFPC对LPS引起的斑马鱼炎症胚胎损伤有保护作用,且随浓度增加,保护作用增强。

图5 不同浓度多酚对LPS诱导的斑马鱼胚胎存活率的影响Fig.5 Effect of different concentration of phenolic compoundson the survival rate of LPS-induced zebrafish embryos注:+即前期给药;-即前期未给药。
不同浓度SFPC对LPS诱导的斑马鱼心跳速率的结果如图6所示。由图可知,LPS诱导组幼鱼的心跳速率明显高于空白对照组,而SFPC处理组则降低了幼鱼心跳速率,且当SFPC浓度为200 μg/mL时,其心跳速率已与正常组无显著性差异(P>0.05)。Wijesinghe等[27]从Laurencia snackeyi提取出来的5β-Hydroxypalisadin B也具有降低LPS诱导的斑马鱼心跳速率增加的效果,被认为是一种潜在有效的抗炎药。因此,SFPC也具有较强的抗炎活性,可能作为一种潜在的天然抗炎成分。

图6 不同浓度多酚对LPS诱导的斑马鱼的心跳速率的影响Fig.6 Effects of different concentrations of phenolic compoundson the heart-beating rate of LPS-induced zebrafish注:+即前期给药;-即前期未给药。

图7 不同浓度多酚对LPS诱导的斑马鱼的细胞死亡的影响Fig.7 Effects of different concentrations of phenolic compounds on the cell death of LPS-induced zebrafish注:+即前期给药;-即前期未给药。

图8 不同浓度多酚对LPS诱导的斑马鱼的ROS产生量的影响Fig.8 Effects of different concentrations of phenolic compounds on the ROS production of LPS-induced zebrafish注:+即前期给药;-即前期未给药。
2.2.3 不同浓度SFPC对LPS诱导的斑马鱼细胞死亡的影响 研究表明,细胞死亡对机体稳态的维持有影响,过度的细胞死亡会破坏机体稳态,已有证据表明细胞死亡释放的大量细胞内溶物可激活免疫系统并引发炎症[31]。图7是不同浓度SFPC对LPS诱导后斑马鱼幼鱼体内细胞死亡率的影响,其中左图为用吖啶橙对存活幼鱼的体内细胞死亡的特异性染色。由图可知,LPS诱导后的幼鱼体内细胞死亡率显著性(P<0.05)高于空白组,而用50、100、200 μg/mL SFPC预孵育后,幼鱼体内细胞死亡率降低并呈剂量依赖性。从荧光图像中可明显看出,空白组幼鱼只有少量细胞被荧光染料染色,荧光强度较弱,而LPS诱导组幼鱼体内大量细胞结合了荧光染料,荧光强度明显增强,当预孵育SFPC后则浓度依赖性的改善了幼鱼体内细胞死亡状况,抑制了组织中炎症反应的进一步增强,表现出良好的抗炎活性。从E. cava中[26]提取的多酚也浓度依赖性降低LPS诱导的斑马鱼幼鱼体内细胞死亡率。
2.2.4 不同浓度SFPC对LPS诱导的斑马鱼ROS生成率的影响 图8是不同浓度SFPC对斑马鱼ROS的影响,其中,左图为不同条件下斑马鱼的荧光图片,由图可见,正常组斑马鱼体内仅有少量ROS,而LPS诱导后斑马鱼体内ROS水平明显升高,而预孵育50 μg/mL SFPC时即表现出对ROS的显著性抑制(P<0.05),当SFPC浓度在200 μg/mL时幼鱼体内ROS水平已与正常组无显著性差异(P>0.05),各实验浓度呈现剂量依赖性抑制作用。Kim等人[26]检测从E. cava中富集的多酚组分,也发现其对LPS诱导的炎症斑马鱼的ROS产生量有显著的剂量依赖性抑制作用。这说明从不同海藻中提取的多酚可能具有相似的抗炎活性,都是良好的天然抗炎成分。
2.2.5 不同浓度SFPC对LPS诱导的斑马鱼NO生成率的影响 图9是不同浓度SFPC对LPS诱导的斑马鱼的NO产生量的影响。由图可知,LPS诱导后斑马鱼幼鱼体内产生了大量的NO,NO与相应荧光染料反应,表现出强烈的荧光现象,其荧光强度可达空白组2倍左右,而SFPC预处理后剂量依赖性的降低了幼鱼体内的NO水平,且100和200 μg/mL的SFPC作用下,斑马鱼NO产生量与空白组无显著性差异(P>0.05),基本恢复到正常水平。橄榄苦苷是存在于橄榄叶的主要酚类化合物之一,Ryu等[32]从橄榄叶中提取了陆地多酚橄榄苦苷,通过体内斑马鱼炎症模型发现,其能有效地降低LPS诱导在NO产生,在高浓度300 μmol/L时抑制率达到62%,抗炎效果良好。而从羊栖菜中提取的褐藻多酚在高浓度200 μg/mL时也达到62.65%的抑制率,这表明SFPC和陆地多酚具有相似的抗炎活性。
上述实验结果表明SFPC具有良好的抗炎活性,其最优浓度为200 μg/mL。该结果与Kim[26]等利用同一模型研究的昆布多酚的抗炎活性相似。
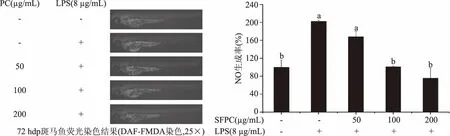
图9 不同浓度多酚对LPS诱导的斑马鱼的NO产生量的影响Fig.9 Effects of different concentrations of phenolic compounds on the NO production of LPS-induced zebrafish注:+即前期给药;-即前期未给药。
目前,利用斑马鱼模型进行抗炎活性研究已被大量报道,Hwang等[33]利用RAW264.7小鼠巨噬细胞和斑马鱼体内模型证明咖啡因具有明显的抗炎活性。Sun等[34]利用LPS诱导炎症研究反式-1,3-二苯基-2,3-环氧丙烷-1-酮的抗炎机制的结果表明,该物质可明显降低斑马鱼体内ROS和NO产生量,同时以剂量依赖性降低iNOS和COX-2蛋白的表达。有研究表明机体内的一系列病理过程都与ROS的产生有关,ROS的过量产生会导致细胞损伤或炎症发生[35-36],在本研究中,经LPS诱导后,斑马鱼体内ROS和NO含量明显升高,但预孵育SFPC后,体内ROS水平明显降低,同时体内NO水平也显著降低,因此SFPC的抗炎活性可能与其抗氧化活性有关。
3 结论
本研究通过不同诱导浓度优化得到8 μg/mL LPS诱导的最优斑马鱼炎症模型,利用该模型探讨了SFPC的抗炎活性。一定浓度的SFPC(50、100、200 μg/mL)以剂量依赖性降低LPS诱导后斑马鱼体内NO和ROS的产生,提高胚胎存活率、降低卵黄囊大小及心跳速率。当浓度为200 μg/mL时,斑马鱼胚胎存活率由30%提高至66.67%,显著降低由LPS诱导所导致的心跳速率和卵黄囊大小的增加,而且NO和ROS生成率降低至75.62%和128.91%,与正常组无显著性差异,表现出良好的抗炎活性。该实验结果为SFPC作为一种天然的抗炎剂提供了理论依据。
