污水中具有絮凝作用丝状菌的分离鉴定及性能研究
2019-11-27雒晓芳1强2陈丽华巍2于加瑞
雒晓芳1,苏 强2,陈丽华,*,张 巍2,于加瑞
(1.西北民族大学实验教学部,甘肃兰州 730030;2.西北民族大学生命科学与工程学院,甘肃兰州 730030;3.西北民族大学化工学院,甘肃兰州 730030)
我国是一个水资源短缺的国家,人均水资源仅为世界平均水平的1/4。不仅如此,我国水资源除匮乏外还面临着严峻的污染问题。据统计约有90%的污水因得不到应有的治理而直接排放到江河湖海中,导致大面积水资源受到不同程度的污染,直接影响人们的生活和工农业生产,成为关系到国计民生的重要问题。因此除节约用水、合理规划用水外,推广治污防污对我国环境建设、经济发展、提高人们生活质量有着重要的现实意义[1-3]。生活污水、各类工业废水及养殖废水等,均含有种类繁多且数目不定的悬浮体和胶体微粒,可通过生物处理、离子交换、吸附、化学氧化、电渗析、超滤和絮凝沉淀等方法去除。其中絮凝沉淀法与其它方法相比经济较为低廉、操作更为简便。絮凝沉淀的实施通常为向待处理水体中加入一定量的絮凝剂,迫使胶体体系在所添加絮凝剂的影响下彼此接触、碰撞、脱稳而凝聚在一起获得一定粒径的聚合颗粒物,最终在重力作用下沉淀于液体底部而被分离[4-5]。
微生物絮凝剂(Microbial Flocculants,简称MBF)即利用微生物技术,由细菌、真菌等微生物发酵后对次级代谢产物提取精制而成的絮凝剂,主要包括蛋白质、多糖、脂类、维生素,DNA等生物大分子物质。因为这类絮凝剂高效、沉淀物较少,克服了无机和有机絮凝剂在使用安全和环境污染方面的问题,可被生物降解,所以自1976年具有絮凝能力的微生物被从霉菌、细菌、放线菌、酵母菌中筛选出后,国内外专家学者们对这类絮凝剂产生菌的筛选、产絮微生物产絮培养基成分及培养条件的优化、微生物絮凝剂絮凝活性影响因素的优化、分子结构、活性中心、作用机理及这类絮凝剂在各类废水处理方面的应用进行了大量的研究[5-11]。
水质评价指按照评价目标,选择相应的水质参数、水质标准和评价方法,对水体的质量、利用价值及水的处理要求作出评定。水质评价是合理开发利用和保护水资源的一项基本工作。在无规定水质标准的情况下,可采用水质基准或本水系的水质背景值作为评价标准。经过持续治理,近年来临淄地区的污染情况有所改善,但部分地区受污依然严重。
因此本实验以山东省临淄区污水作为样本,筛选具有絮凝活性的丝状菌,通过培养后观察菌落形态和个体显微特征鉴定菌株,对絮凝作用最好的菌株进行一系列鉴定。并对所筛选的菌株的培养温度、培养基初始pH、种子液接入量等条件进行优化以获得更高的絮凝效果,此研究为微生物絮凝剂研究及水体治理方面提供一定的理论和实际意义。
1 材料与方法
1.1 材料与仪器
污水样本 采集自山东省临淄区金岭回族镇污水水渠;葡萄糖、蔗糖、硫酸铵、硫酸亚铁、硫酸镁、磷酸氢二钾、氯化钠、硝酸钠、氢氧化钠、盐酸、氯化钙、氯化钾 杭州微生物有限责任公司;马铃薯 甘肃榆中;高岭土 陕西韩城;琼脂、10 mg/mL核糖核酸酶(RNase)、异丙醇、70%乙醇、无水乙醇、10%十二玩基磺酸钠(SDS)、麦芽汁琼脂培养基、查氏培养基 以上试剂均购买于杭州微生物有限责任公司;纯化水 经Millipore过滤灭菌。
YXQ-LS-立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;DHG-9140A新型电热恒温鼓风干燥箱 宁波江南仪器厂;ZWY-200D恒温培养振荡器 上海智城分析仪器制造有限公司;S.SW-CJ-2F净化工作台 上海跃进医疗器械厂。
1.2 实验方法
1.2.1 菌种富集培养与初筛 将取自临淄区4 ℃保藏的污水样本用蒸馏水分别梯度稀释至10-1~10-7,将稀释后的样本在麦芽汁琼脂培养基中涂布(28 ℃培养72 h),筛选出生长良好且菌落单一的菌株接种于相应的50 mL麦芽汁培养基中,在温度28 ℃,转速150 r/min条件下,恒温摇床扩大培养72 h对该菌株进行富集。并测定各麦芽汁培养液对高岭土悬液的絮凝活性。若能获得较好絮凝活性则对该富集培养液连续富集培养三次。如果该培养液仍保持其絮凝活性,用平板稀释法进行菌株的分离纯化,通过肉眼对培养特征的观察淘汰非丝状菌菌落特征的菌株。将所得到的单菌株接到斜面上28 ℃培养72 h后置冰箱4 ℃保存、备用。
1.2.2 菌种纯化与复筛 对初筛获得的菌株平板划线进行纯化分离,28 ℃条件下恒温培养并观察菌落生长情况。待菌落充分生长选单个菌落接种于装有50 mL灭菌培养基的250 mL锥形瓶中扩大培养72 h,培养条件与初筛相同,重复3次。
1.2.3 种子液制备 将分离纯化后的菌株直接接种于装有50 mL灭菌培养基的250 mL锥形瓶中150 r/min条件下培养72 h。
1.2.4 絮凝活性测定 以高岭土悬浊液模拟实际废水作为絮凝对象。絮凝剂的絮凝活性用絮凝率表征。按照5 g/L的比例称取高岭土溶解于蒸馏水中,配制成高岭土悬浊液。量取80 mL高岭土悬浊液加入到100 mL的具塞量筒中,然后向量筒中加入5 mL 10 g/L的CaCl2溶液,摇匀,接着吸取2 mL 28 ℃培养72 h后的培养液(絮凝剂)加入量筒中,加蒸馏水至100 mL刻度线处,盖塞反复颠倒摇动20次,摇匀后静置5 min,在70 mL刻度线处吸取上清液5 mL,在550 nm处测定吸光度。同时以不加絮凝剂的上清液作为对照,样品的絮凝活性FA按公式[12]:
FA%=(ODC-OD)/ODC×100
式(1)
式中:ODC为对照上清液的光密度值,OD为样品上清液的光密度值。
1.3 菌株鉴定
根据菌株培养特征及显微镜下形态特征观察鉴定菌株,并对其中絮凝能力最强的一株菌提取DNA,750 bp条带浓度为60 ng/3uL,显示为加亮带,其余条带浓度均为30 ng/3uL。电泳方向从下向上。纯化后由武汉金开瑞生物工程有限公司通过PCR扩增和鉴定。具体为:
使用特异性引物对该菌18S rDNA进行PCR扩增,18S引物序列:ITS4:TCCTCCGCTTATTGATATGC;ITS5:GGAAGTAAAAGTCGTAACAAGG。该反应条件:95 ℃ 5 min;95 ℃ 30 s;60 ℃ 30 s;72 ℃ 1 min;35cycle;72 ℃ 10 min;12 ℃ forever。并对其18S rDNA基因进行测序。将测序结果进行正反序列拼接得到全序列,再将测序结果经NCBI进行Blast比对,并与GenBank中相近的模式菌的内转录间隔区(internal transcribed spacers,ITS)基因序列一并调入MEGA5.0中进行分析。利用MEGA5.0软件进行分析,并构建系统发育树[13-14]。
1.4 培养条件优化
影响微生物产生絮凝效应的因素众多,各因素对不同微生物产生絮凝作用的影响程度又不尽相同。该步实验在确保培养基种类、通气量等众多影响因素不变的情况下,仅通过改变单一因素包括培养温度、发酵液初始值,种子等探讨各因素对菌株絮凝能力的影响,并通过正交实验的方法确定各因素间对絮凝作用影响程度的大小[15]。
1.4.1 培养温度的影响 本实验在初始pH6.0,种子液加入量5%的条件下,设计22、24、26、28、30、32 ℃,6个不同的温度梯度,将种子液在150 r/min条件下,恒温摇床培养72 h测定发酵液的絮凝活性,分析培养温度对菌株絮凝效果的影响。
1.4.2 发酵液初始pH的影响 实验以一定浓度NaOH和HCl溶液来调节絮凝培养基的初始pH,在培养温度为28 ℃,种子液加入量为5%的条件下,改变从5.0、6.0、7.0、8.0、9.0,5个不同初始pH,测定发酵液的絮凝率,分析发酵液初始pH对絮凝效果产生的影响。
1.4.3 种子液加入量的影响实验 在培养温度为28 ℃,初始值为自然状态的条件下,设计2.0%、3.0%、4.0%、5.0%、6.0%、7.0%,6个不同种子液加入量,测定发酵液的絮凝率,分析种子液加入量对絮凝效果产生的影响。
1.4.4 正交实验 在对菌株单因素实验基础上采用正交实验来探讨种子液加入量,初始pH和培养温度这三个影响因素对各菌株所对应培养液絮凝率的影响情况。每个因素考察三个水平,实验因素水平如表1所示。

表1 试验因素与水平Table 1 Factors and levels in response surface test
2 结果与分析
2.1 菌种的分类鉴定
2.1.1 菌株的形态学特征 对筛选所得的三株具有絮凝活性的菌株分别编号SP、SQ、SR。从图1a可知,菌落在营养琼脂培养基上28 ℃培养3 d,即形成较典型的菌落,菌落整体较为平坦中心有脐状突起而其他部分有少量放射状短纹,边缘明确、整齐,质地绒状分生孢子面暗绿色;菌丝体为白色,具隔膜;油镜下观察分生孢子梗发生于基质,壁平滑,帚状枝为双轮生彼此夹角较小彼此较紧贴,梗基每轮2~3个,瓶梗每轮5~8个,分生孢子为椭圆形,壁平滑,分生孢子链圆柱状。根据该菌株的培养特征及乳酸石炭酸棉蓝染液染色后显微镜下形态观察进行鉴定[15-17],确定该菌株属于半知菌类、丛梗孢目、丛梗孢科,青霉属,由于该属菌种众多形态又极为相似,因此对该菌的鉴定工作还应依赖于对其18S rDNA测序比对确定。
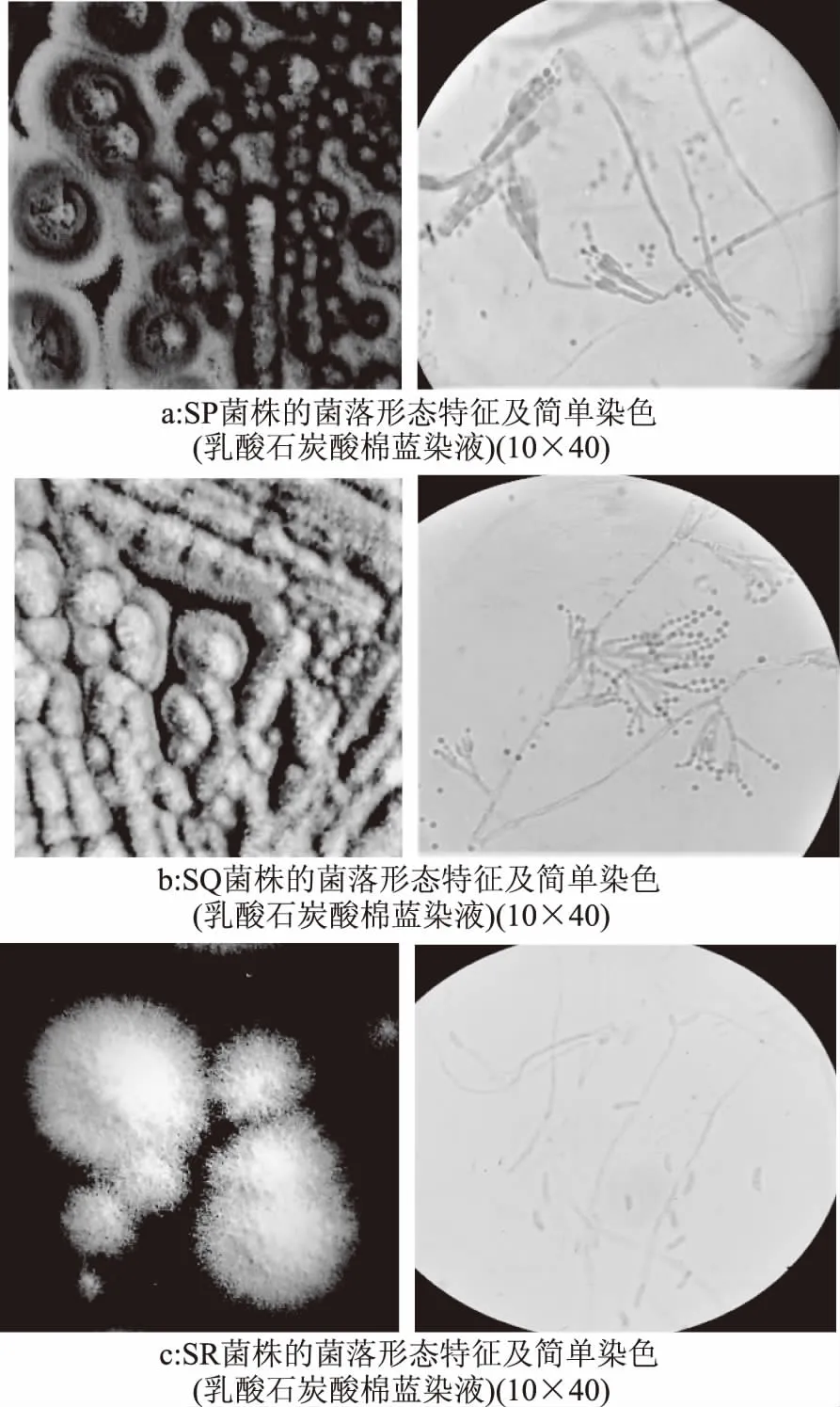
图1 各菌株的培养特征和形态特征Fig.1 The culture characteristics and morphologicalcharacteristics of the strain

图3 SP菌株系统发育树Fig.3 The phylogenetic tree of the SP strain
从图1b可知,菌落在营养琼脂培养基上28 ℃培养3 d,即形成较典型的菌落,中心有突起,质地絮状兼绒状,边缘整齐,边缘的菌丝体淡蓝色,中部呈淡黄白色,反面微红褐色;分生孢子梗茎壁平滑;帚状枝双轮生,梗基每轮2~4个,瓶梗每轮3~5,披针形,梗颈明显;分生孢子呈现卵圆形,壁平滑;分生孢子链疏松而不规则。根据该菌的培养特征及乳酸石炭酸棉蓝染液染色后显微镜下形态观察进行鉴定,初步鉴定该菌为半知菌类、丛梗孢目、丛梗孢科,青霉属某菌,目前尚不足以鉴定出具体种属。
从图1c可知,菌落在查氏培养基上28 ℃培养4 d,即形成较典型的菌落,菌落呈白色、毛绒状,中心突起;无隔,形成的单孢子呈长筒形。根据该菌的培养特征及乳酸石炭酸棉蓝染液染色后显微镜下形态观察,初步鉴定该菌为丛梗孢科某丝状菌。
2.1.2 鉴定结果 考虑到SQ、SR絮凝活性都低于SP的絮凝活性,且实验经费有限,固只对SP进行了进一步的鉴定。将所得序列与NCBI中Gen Bank的核酸序列进行BLAST比对分析,结果显示实验菌株SP与草酸青霉菌(Penicilliumoxalicum)相似度最高。不过由于该序列与该属多个种的相似度均很高,为了更准确菌株种类,还需要进一步确定[18-19]。如图2琼脂糖凝胶电泳检测PCR产物所示,750 bp条带浓度为60 ng/3 uL,显示为加亮带,其余条带浓度均为30 ng/3 uL,电泳方向从下向上。左侧条带为marker,右侧为SP的PCR产物条带,SP菌株PCR产物的条带1700 bp左右。
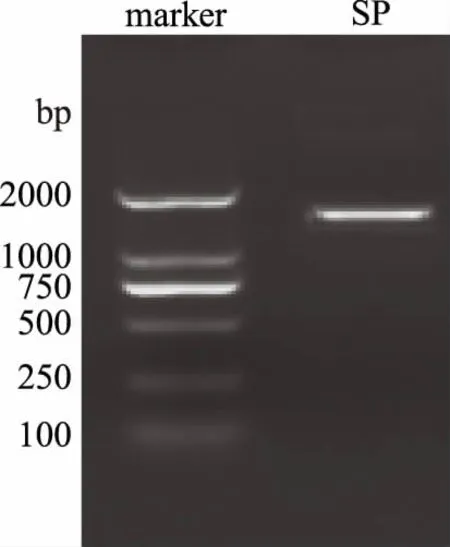
图2 琼脂糖凝胶电泳检测PCR产物Fig.2 The PCR products were detectedby agarose gelelectrophoresis
2.1.3 SP菌株系统发育树的建立 SP菌株与从GENBANK获取的相似序列经MEGA5.0软件进行比对分析并构建N-J系统发育树。根据系统发育树并结合各比对指标确定距离与同源性均具有较大鉴定意义(Identfication)的比对序。选取草酸青霉菌属的14个种的模式菌株,使用Mega 5.0软件进行系统进化树的构建,自展值(Bootstrap value)设置为10000。如图3所示,由构建的进化树可以初步判定SP菌株与草酸青霉菌(Penicilliumoxalicum)属于同一种[20]。
2.2 絮凝条件优化
2.2.1 不同温度对絮凝效果的影响 如图4所示,培养温度的变化,会影响菌液的絮凝效果的变化,SP(草酸青霉菌)在28 ℃条件下表现出最佳絮凝效果,絮凝率可达到67.7%,SQ(青霉属丝状菌)在26 ℃条件下表现出最佳絮凝效果,絮凝率可达到58.4%,而SR(丛梗孢科真菌)30~32 ℃才出现最佳絮凝效果,且絮凝率也较低,只能达到30.4%。
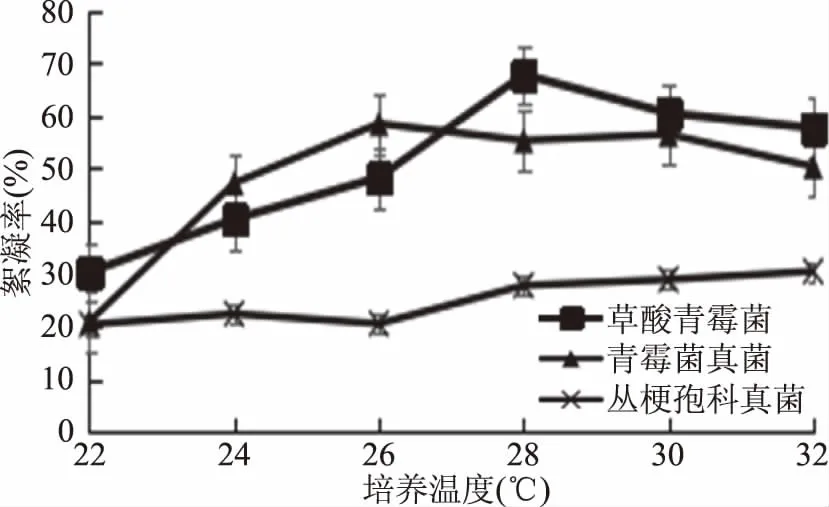
图4 不同温度下菌株絮凝率的变化Fig.4 The change of flocculationrate at different temperatures
2.2.2 不同初始pH对絮凝效果的影响 如图5所示,当pH处于6时草酸青霉菌絮凝率可达到65.8%,而其余两株菌均在pH为7时表现最佳絮凝效果,絮凝率分别为57.4%和25.3%,且当pH大于7时絮凝效果明显下降,因此三株菌的最佳培养pH均在6~7之间。

图5 不同初始pH下絮凝率的变化Fig.5 The changes of flocculationunder different initial pH values
2.2.3 种子液加入量对絮凝效果的影响 如图6所示,三种菌的絮凝效果受种子液加入量的影响并不是非常明显,絮凝率变化均保持在15%以内,且在加入量为3 mL,即种子加入浓度为6%时表现出最佳絮凝效果。
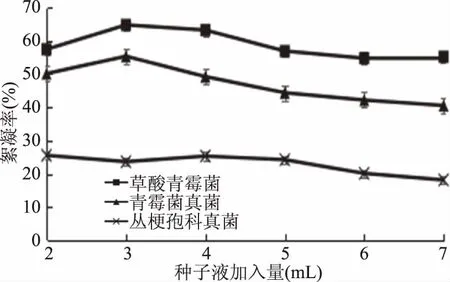
图6 不同种子液加入量下絮凝率的变化Fig.6 The change of flocculation rateat different amount of seed fluid added
2.3 正交实验
在单因素实验的基础上,选择种子液加入量、pH、培养温度进行3因素3水平正交试验,试验结果如表2~表4所示。
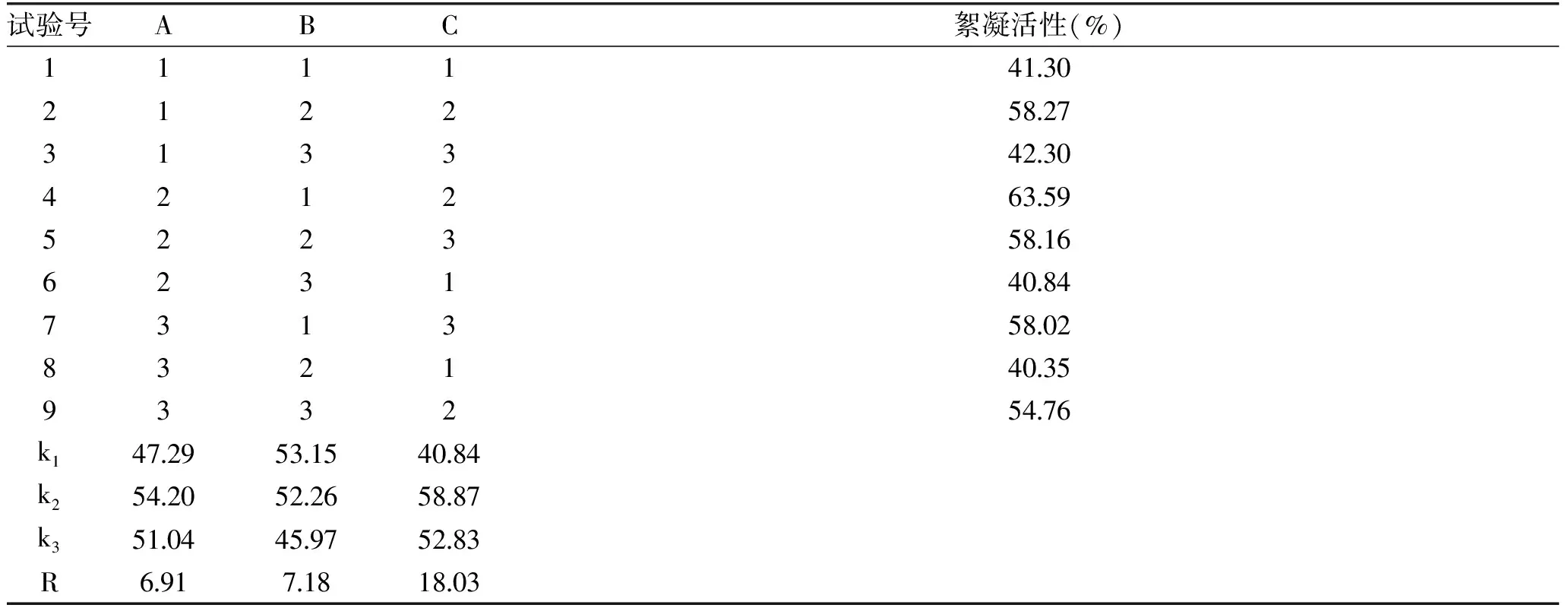
表2 SP菌株实验设计及结果Table 2 Design and results of the SP strain
由极差分析可得各因素对SP菌株絮凝活性的影响的大小为:C>B>A;通过比较K值大小确定最优水平组合为A2B1C2,即种子加入量4 mL,pH为6,培养温度为28 ℃。在该条件下进行验证试验,SP菌株絮凝活性为67.7%。对SQ菌株絮凝活性的影响的大小为:B>A>C;通过比较K值大小确定最优水平组合为A2B2C2,即种子加入量为4 mL,pH为7,培养温度为28 ℃。在该条件下进行验证试验,SQ菌株絮凝活性为58.2%。对SR菌株絮凝活性的影响的大小为:B>A>C;通过比较K值大小确定最优水平组合为A2B2C2,即种子加入量为4 mL,pH为7,培养温度为28 ℃。在该条件下进行验证试验,SR菌株絮凝活性为31.4%[21-24]。
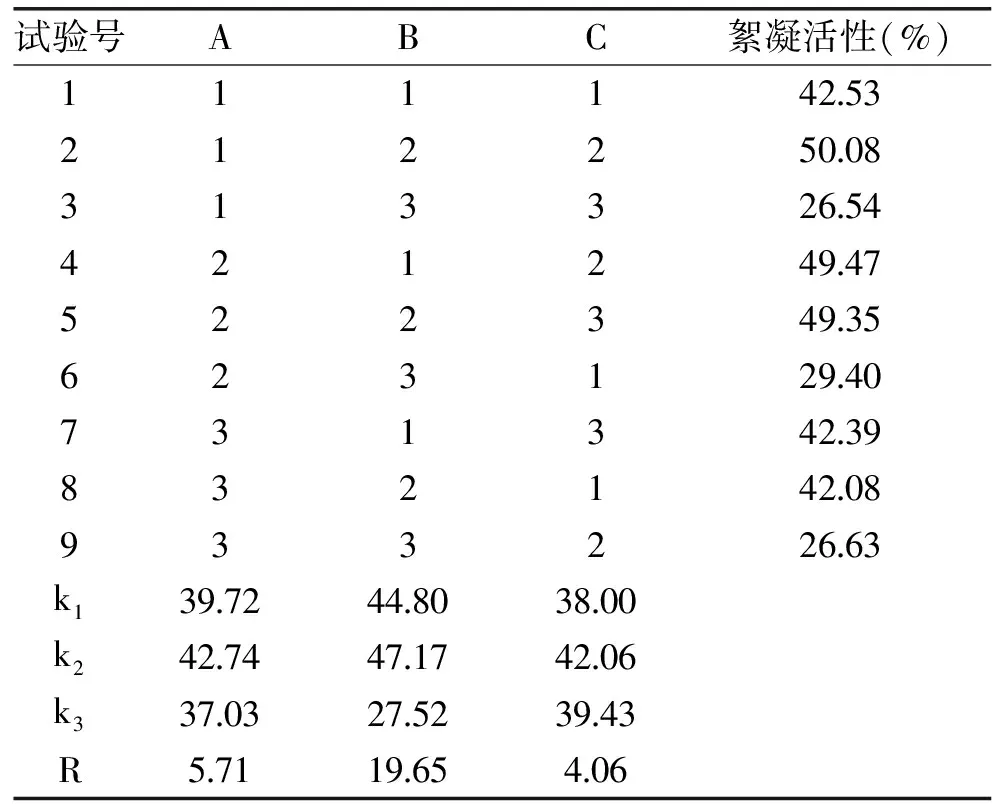
表3 SQ菌株实验设计及结果Table 3 Design and results of the SQ strain

表4 SR菌株实验设计及结果Table 4 Design and results of the SR strain
3 讨论与结论
近年来,生物技术不断发展,新的技术也不断用于微生物絮凝剂的研究,微生物絮凝剂技术的发展已经进入到了一个新的历史阶段[21]。于荣丽等[22]对LMB8菌株进行了产絮凝剂的优化培养后,加入助凝剂CaCl25 mL,LMB8菌株所产絮凝剂对河道泥浆的絮凝率可达83.1%。LMB8菌体本身则不具有絮凝性,其有效絮凝性物质是该菌体在发酵过程中产生的胞外分泌物。该实验借助正交实验设计,对培养温度、发酵液初始pH,种子液加入量三因素对菌株絮凝作用进行了优化处理,结果表明,影响絮凝率的程度依次为:初始pH>培养温度>种子液加入量。除种子液加入量外,其他两个因素都可直接影响细胞内酶的合成,改变酶促反应速率甚至影响次级代谢,所以培养温度及发酵液初始pH对菌株絮凝作用影响较大。另外,实验发现,SP(草酸青霉菌)、SQ(青霉属丝状菌)、SR(丛梗孢科丝状菌)3种丝状菌均有一定的产絮凝活性,其中最佳培养条件是:麦芽汁培养基、初始pH6.0、150 r/min摇床培养72 h、培养温度28 ℃,而且以草酸青霉菌最为显著,对5g/L的高岭土悬浮液的处理中可达到65.45%的絮凝率,可见,该研究为不仅丰富了污水中絮凝微生物的品种,而且该菌株的絮凝率相对较高,故其后期在治理污水等方面研究价值也很大,有一定的应用潜力。
