粪便FCP与血清CEA联合检测对大肠癌的诊断价值
2019-11-26郭宗全李艳梅陈新华
郭宗全,李艳梅,陈新华
(1 内蒙古医科大学附属人民医院,呼和浩特010051;2 内蒙古医科大学;3 内蒙古医科大学附属医院)
大肠癌是临床常见的消化系统恶性肿瘤之一,近年随着我国居民生活水平提高和人口老龄化加剧,其发病率呈明显上升趋势,已跃居消化系统恶性肿瘤的第三位,仅次于胃癌和食管癌[1,2]。大肠癌起病隐匿,早期多无症状,多数患者出现明显症状就诊时已属中晚期,5年生存率不足10%。有研究发现,尽早发现并切除大肠癌癌前病变,5年生存率可超过85%[3,4]。因此,早发现、早治疗是改善大肠癌患者预后的关键因素。当前,大多数检测技术,如大便潜血试验、气钡灌肠、电子结肠镜等,在诊断大肠癌时存在精确性低、费用高、侵袭性大,甚至还有可能出现肠出血、穿孔等严重并发症,患者依从性较差,故这些方法并不适合临床筛查。因而,探索一种早期能有效筛查大肠癌的方法成为亟待解决的问题之一。钙卫蛋白(FCP)是一种相对分子量为36 kD的钙、锌结合蛋白,主要来自中性粒细胞,存在于除溶菌酶以外的细胞质中[5],可作为急性炎性细胞活化的标志[6]。FCP在粪便中不易被降解,可作为肠道炎症反应的一种生物标志物[7,8]。大肠癌或大肠腺瘤性息肉患者肠黏膜经常会出现局部急性炎症反应,其粪便FCP含量明显升高。因此,粪便FCP含量可作为一种非侵入性检查方法筛查大肠癌或大肠腺瘤性息肉。癌胚抗原(CEA)是一种相对分子质量为180 000~200 000的多糖蛋白复合物,属于免疫球蛋白超家族分子,是最早被发现的肿瘤相关抗原之一。CEA是目前应用最广泛的一种肿瘤标志物,主要用于消化系统恶性肿瘤的诊断,如结肠癌、直肠癌、胰腺癌等[9],然而单一检测血清CEA对早期大肠癌的诊断价值有限。粪便FCP与血清CEA联合检测有可能提高大肠癌的早期诊断准确率,但相关报道较少。本研究观察了粪便FCP与血清CEA联合检测对大肠癌的诊断价值。现报告如下。
1 资料与方法
1.1 临床资料 选择2015年12月~2016年12月内蒙古医科大学附属医院收治的大肠肿瘤患者60例,其中大肠癌30例(肠癌组)、大肠腺瘤性息肉30例(息肉组)。纳入标准:①因腹部不适就诊,经肠镜检查+活检病理检查明确大肠癌或大肠腺瘤性息肉诊断;②初诊;③入院前未行任何抗肿瘤治疗。排除标准:①直肠或肛周有严重化脓性炎症者;②肠穿孔、腹膜炎、腹腔内广泛粘连及各种原因导致的肠腔狭窄者;③肝硬化腹水、肠系膜炎症及恶性肿瘤晚期伴腹腔内广泛转移者;④严重心脑血管疾病、系统性红斑狼疮或类风湿性关节炎者;⑤溃疡性结肠炎、克罗恩病者;⑥精神病或不能耐受肠镜检查者。大肠癌组男19例、女11例,年龄18~80岁、平均54.6岁;息肉组男16例、女14例,年龄18~78岁、平均53.7岁。同期选择肠镜检查正常的腹部不适患者30例(对照组),男17例、女13例,年龄20~75岁、平均51.3岁。三组性别、年龄具有可比性。本研究经内蒙古医科大学附属医院医学伦理委员会批准,患者或其家属知情同意。
1.2 血清CEA检测 所有研究对象入组后于肠道准备前1日,采集清晨空腹肘静脉血2 mL,离心留取血清,采用ELISA法检测血清CEA。所有操作严格按ELISA试剂盒说明进行。
1.3 粪便FCP检测 所有研究对象入组后于结肠镜检查前1日,口服清肠药前留取粪便10~20 g,-20 ℃冰箱保存。待标本成批后,离心留取上清液,采用ELISA法检测粪便FCP。所有操作严格按ELISA试剂盒说明进行。
1.4 统计学方法 采用SPSS20.0统计软件。非正态分布的计量资料以M(P25,P75)表示,结果比较采用Kruskal-WalIisH检验。采用受试者工作特征(ROC)曲线评估粪便FCP、血清CEA单独或联合检测诊断大肠癌的价值。P<0.05为差异有统计学意义。
2 结果
2.1 各组粪便FCP含量与血清CEA水平比较 见表1。
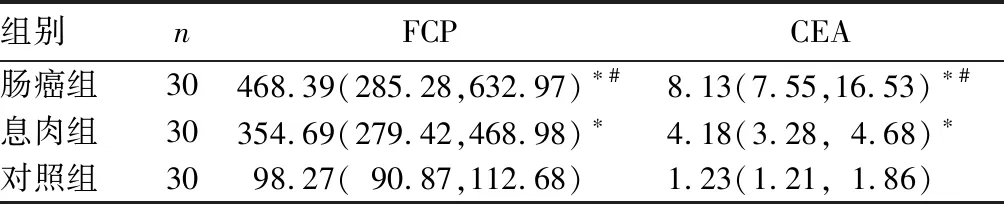
表1 各组粪便FCP含量与血清CEA水平比较[μg/g,M(P25,P75)]
注:与对照组比较,*P<0.05;与息肉组比较,#P<0.05。
2.2 粪便FCP、血清CEA单独或联合检测诊断大肠癌的价值分析 粪便FCP单独检测诊断大肠癌的ROC曲线下面积为0.880,其cut off值为247.48 μg/g,此时其诊断大肠癌的敏感性为83.3%、特异性为77.5%;血清CEA单独检测诊断大肠癌的ROC曲线下面积为0.886,其cut off值为5.375 μg/g,此时其诊断大肠癌的敏感性为70.0%、特异性为62.5%;粪便FCP与血清CEA联合检测诊断大肠癌的ROC曲线下面积为0.937,其诊断大肠癌的敏感性为95.8%、特异性为89.4%。粪便FCP与血清CEA联合检测诊断大肠癌的ROC曲线下面积高于二者单独检测(P均<0.05)。见图1。

图1 粪便FCP、血清CEA单独和联合检测诊断大肠癌的ROC曲线
3 讨论
大肠癌是临床常见的消化系统恶性肿瘤之一,其发病率居胃肠道恶性肿瘤的第二位,仅次于胃癌[10]。大肠癌起病隐匿,早期多无症状,多数患者出现明显症状就诊时已属中晚期,5年生存率不足10%[11]。而早期大肠癌经外科手术或内镜下治疗,5年生存率可超过85%。因此,早发现、早治疗是改善大肠癌患者预后的关键因素。目前,欧美国家主要通过粪便潜血试验结合肠镜检查筛查大肠癌。但粪便潜血试验的敏感性低,不能发现无出血病变。肠镜检查的敏感性和特异性虽然较高,但肠镜检查的费用高、侵袭性大、对操作者技术要求高,甚至有可能出现肠出血、穿孔等严重并发症,患者依从性差。因此,这些方法不适合大规模临床筛查,故探索一种早期能有效筛查大肠癌的方法成为亟待解决的问题之一。
目前已知的肿瘤标志物有多种,但均存在一定的优势和局限[12]。CEA是目前应用最广泛的一种肿瘤标志物,主要用于消化系统恶性肿瘤的诊断[13~15]。然而单一检测血清CEA对大肠癌早期诊断的价值有限。近年来,国外许多学者将目光转向粪便FCP。FCP是一种急性炎症反应标志物,在粪便中不易被降解,因此定量检测粪便FCP能为肠道疾病的预防、诊断和治疗提供依据。粪便FCP与血清CEA联合检测有可能提高大肠癌的早期诊断准确率,有望成为诊断无出血性早期大肠癌的一种新手段,但相关研究较少。
本研究结果发现,肠癌组粪便FCP含量明显高于息肉组和对照组,其原因是大肠癌细胞向周边组织浸润,诱导周边组织产生炎症细胞,局部炎症细胞坏死、脱落引起FCP含量升高,这种癌细胞浸润导致炎症细胞产生是一个持续过程,随着肿瘤发展,肿瘤体积不断增大且其表面出现糜烂、出血,导致更多的炎症细胞持续坏死、脱落,故大肠癌患者粪便FCP含量明显升高。岳林等[16]研究发现,粪便FCP含量诊断大肠癌的敏感性为88.51%、特异性为88.33%,且不受肿瘤分期的影响。Roseth等[17]研究表明,在预测结肠癌方面粪便FCP含量的敏感性可达90.0%。本研究结果发现,粪便FCP单独检测诊断大肠癌的ROC曲线下面积为0.880,其cut off值为247.48 μg/g,此时其诊断大肠癌的敏感性为83.3%、特异性为77.5%。因此,粪便FCP含量检测可用于大肠癌早期筛查,尤其适用于无出血症状人群的早期筛查。但粪便FCP含量除与疾病有关外,还受药物、饮酒等因素影响。如Poullis等[18]研究发现,质子泵抑制剂能够使粪便FCP含量增加。因此,粪便FCP含量偏高时还需要询问相关病史和服药史,综合考虑病情。本研究结果发现,肠癌组血清CEA水平明显高于息肉组和对照组,进一步证实血清CEA可用于大肠癌的辅助诊断。本研究还发现,血清CEA单独检测诊断大肠癌的ROC曲线下面积为0.886,其cut off值为5.375 μg/g,此时其诊断大肠癌的敏感性为70.0%、特异性为62.5%,与以往文献[19]报道基本一致。本研究还发现,粪便FCP与血清CEA联合检测诊断大肠癌的ROC曲线下面积为0.937,其诊断大肠癌的敏感性为95.8%、特异性为89.4%。由此可见,粪便FCP与血清CEA联合检测诊断大肠癌的效能要优于二者单独检测,故粪便FCP与血清CEA联合检测可用于大肠癌大规模临床筛查。
综上所述,粪便FCP、血清CEA单独检测对大肠癌的诊断均具有一定价值,但二者联合检测的诊断效能更高,尤其适用于大规模临床筛查。
