携带人端粒酶反转录酶启动子的溶瘤腺病毒RCA-TERT-Ad35对乳腺癌干细胞的靶向作用
2019-11-26王炜川陈璐璐权香兰李颖金永民金文彪于可心张松男
王炜川,陈璐璐*,权香兰,2,李颖,金永民,金文彪,于可心,张松男
0 引言
乳腺癌组织中存在少量乳腺癌干细胞,其具有干细胞特性,在乳腺癌发生发展、耐药及复发中起重要作用,并且由于乳腺癌干细胞大多数处于静止状态,仅有少部分进入细胞周期,从而导致对常规化疗或放疗疗效不明显。因此,如何有效地杀死这些乳腺癌干细胞是乳腺癌治疗的挑战[1]。
溶瘤腺病毒,能够有效地转染高增殖细胞(非干细胞)和静止细胞(干细胞),与常规治疗方法不同,溶瘤腺病毒的细胞毒性机制是物理裂解靶细胞,而不是通过ATP结合盒(ATP-binding cassette transporter,ABC)转运蛋白使化疗药物泵出转染细胞[2-4]。因此,它不受肿瘤干细胞化疗或放射抗性机制的影响。尽管有许多研究报道了用溶瘤腺病毒治疗乳腺癌,但关于乳腺癌干细胞的有效靶向策略却很少[5]。
端粒酶反转录酶(TERT)是端粒酶的催化亚基,在正常细胞中几乎不表达,但在恶性肿瘤细胞中高表达。已有研究表明人端粒酶反转录酶(human telomerase reverse transcriptase,hTERT)启动子是癌症基因治疗的一个具有潜力的治疗靶点[6-7]。端粒酶在癌细胞中起重要作用,含有端粒酶相关蛋白[8]、RNA亚基和催化亚基(hTERT),后者是端粒酶活性的主要决定因素[9]。生物信息学数据表明,hTERT是许多癌症发展的易感基因[10-12]。因此,利用hTERT启动子调节病毒关键基因的转录是通过溶瘤病毒选择性靶向肿瘤细胞的潜在方式。
本实验构建人TERT启动子驱动的重组溶瘤腺病毒(RCA-TERT-Ad35)治疗TERT阳性乳腺癌细胞,旨在寻找治疗乳腺癌的新型治疗策略。
1 材料与方法
1.1 细胞培养
MCF-7乳腺癌细胞系获自中国科学院(中国上海)细胞库,于10%胎牛血清及100 IU/ml青霉素和100 μg/ml链霉素的DMEM培养液中培养,37℃、5%CO2(Thermo,美国)培养箱中孵育。
将MCF-7细胞以40 000个/毫升的密度悬浮于含有5 mg/ml胰岛素、0.5 mg/ml氢化可的松、2% B27和20 ng/ml EGF的DMEM/F-12中,并接种于超低黏附6孔板(Corning,美国)。2周后传代一次,通过离心收集乳腺球体,用胰酶(Sigma,美国)消化至单个MCF-7球体细胞(mammosphere cell,MS)用于后续实验。
1.2 RT-PCR法检测hTERT mRNA
根据Platinum Taq试剂盒(Invitrogen Corp,美国)的SuperScript一步法RT-PCR技术进行第一链cDNA合成和PCR反应。将反应混合物在50℃加热30 min,然后进行30次循环PCR,包括94℃变性30 s、60℃退火30 s、72℃延伸60 s和72℃保持2 min。针对PCR反应,设计正义和反义寡核苷酸引物(5'-CGGAAGAGTGTCTGGAGCAA-3';5'-GGATGAAGCGGAGTC TGGA-3')。收集PCR产物(长度为150 bp),10%琼脂糖凝胶电泳。
1.3 MTT测定法检测细胞活力
将MCF-7和MS细胞以1×104个/孔的密度接种于96孔板中。24 h后,向培养基中加入不同浓度的紫杉醇(0、1、5、10、15、20 μmol/L)。培养72 h后,使用非放射性细胞增殖试剂盒通过MTT测定法测量细胞活力,并使用微量滴定板(ELISA)读数器在490 nm处测量样品的吸光度值(A)。细胞存活率计算公式:细胞存活率(%)=(转染细胞的A值/未转染对照细胞的A值)×100%。
1.4 腺病毒的构建
将LacZ插入到腺病毒基因组E3基因座中建立非复制型的腺病毒RIA-LacZ。用35型腺病毒纤维基因替换原始的5型腺病毒纤维基因建立RIALacZ-Ad35和RCA-Ad35。用修饰的hTERT启动子替换E1A启动子构建复制型腺病毒结构图,见图1。所有病毒在原代人胚肾细胞293细胞中复制并通过CsCI密度纯化而净化,通过测量260 nm处的吸光度计算病毒颗粒数。
图1标明的腺病毒载体均来源于全长5型腺病毒基因组。RIA-LacZ和RIA-LacZ-Ad35是复制缺陷型腺病毒,缺失整个E1区并表达插入E1区的报告基因LacZ。RCA-Ad35和RCA-TERT-Ad35是含有正常E1基因的复制型腺病毒,RCA-TERT-Ad35中的E1启动子被修饰的hTERT启动子取代。通过用35型腺病毒纤维基因替换原始的5型腺病毒纤维基因,建立RIA-LacZ-Ad35、RCA-Ad35和RCA-TERT-Ad35。

图1 腺病毒载体的结构示意图Figure1 Structure schematic of adenovirus vectors
1.5 溶瘤腺病毒载体的转导效力
将MCF-7和MS细胞以1×105个/孔的密度接种在24孔板中。RIA-LacZ、RIA-LacZ-Ad35分别以不同的感染复数(multiplicity of infection,MOI)梯度(0、0.2、1、5、20、100)转染球形细胞。48 h后,用β-半乳糖苷酶(β-gal)染色,以蓝色滴度单位(btU)/ml表示。
1.6 溶瘤分析
将MCF-7细胞以3×104个/孔的密度接种于48孔板。培养24 h后,RCA-Ad35和RCA-TERT-Ad35分别以0.5、1、2、5和10的MOI梯度转染MCF-7细胞,37℃下孵育4天。各孔加入溶于PBS中的MTT溶液(5 mg/ml,20 μl)。彻底混合后微量板读数器测量490 nm处的吸光度值评估细胞活力。
将MCF-7和MS细胞以5×104个/孔的密度接种于48孔板。24 h后,RCA-Ad35、RCA-TERT-Ad35或野生型腺病毒(WT-Ad)分别以不同的MOI梯度(0、0.5、1、2、5、10、20)转染MCF-7或MS细胞。4天后,将细胞暴露于含有2%结晶紫染色液和20%的甲醇溶液中15 min,蒸馏水洗涤,摄影记录溶瘤数。
1.7 动物实验
在6~8周龄的雄性裸鼠(Charles River Japan Inc.,日本)中建立人异种移植肿瘤。小鼠腹部皮下植入1×107个MCF-7细胞。当异种移植肿瘤达到100 mm3(通过体积=0.523LW2计算)时,将小鼠随机分成三组,每组6只。每隔一天向肿瘤内注射5×1010VP的RCA-Ad35或RCA-TERT-Ad35或PBS 3次。每两天测量肿瘤体积。
1.8 乳腺癌干细胞成瘤实验
10%的胎牛血清和RPMI1640培养液培养人乳腺癌MCF-7细胞,通过传代、扩增收集呈对数生长期的细胞制成单细胞悬液,将裸鼠随机分组6组,每组各5只。SPF环境下,每组裸鼠背部皮下分别接种5×104个/毫升、5×105个/毫升、5×106个/毫升MS和MCF-7细胞悬液。4周后比较肿瘤形成率。
1.9 统计学方法
所有数据采用双尾学生t检验(SPSS13.0软件)进行统计分析,结果为平均值±标准误差。数据统计分析使用双尾学生t检验,P<0.05为差异有统计学意义。
2 结果
2.1 hTERT基因在MS细胞中过表达
非黏附条件下培养MCF-7细胞两周后,细胞产生漂浮的球形菌落。与亲代细胞相比,球形细胞中的hTERT基因表达增加,见图2A,并且在整个球体传代中稳定维持。
2.2 球体细胞显示出对常规抗肿瘤剂的显著抗性
MTT试验结果表明,乳腺癌MCF-7细胞通过悬浮培养获得了干细胞样特性。与其亲代细胞相比,MS细胞对细胞毒性剂紫杉醇具有显著耐药性(P=0.023),见图2B。
2.3 腺病毒的转染效率
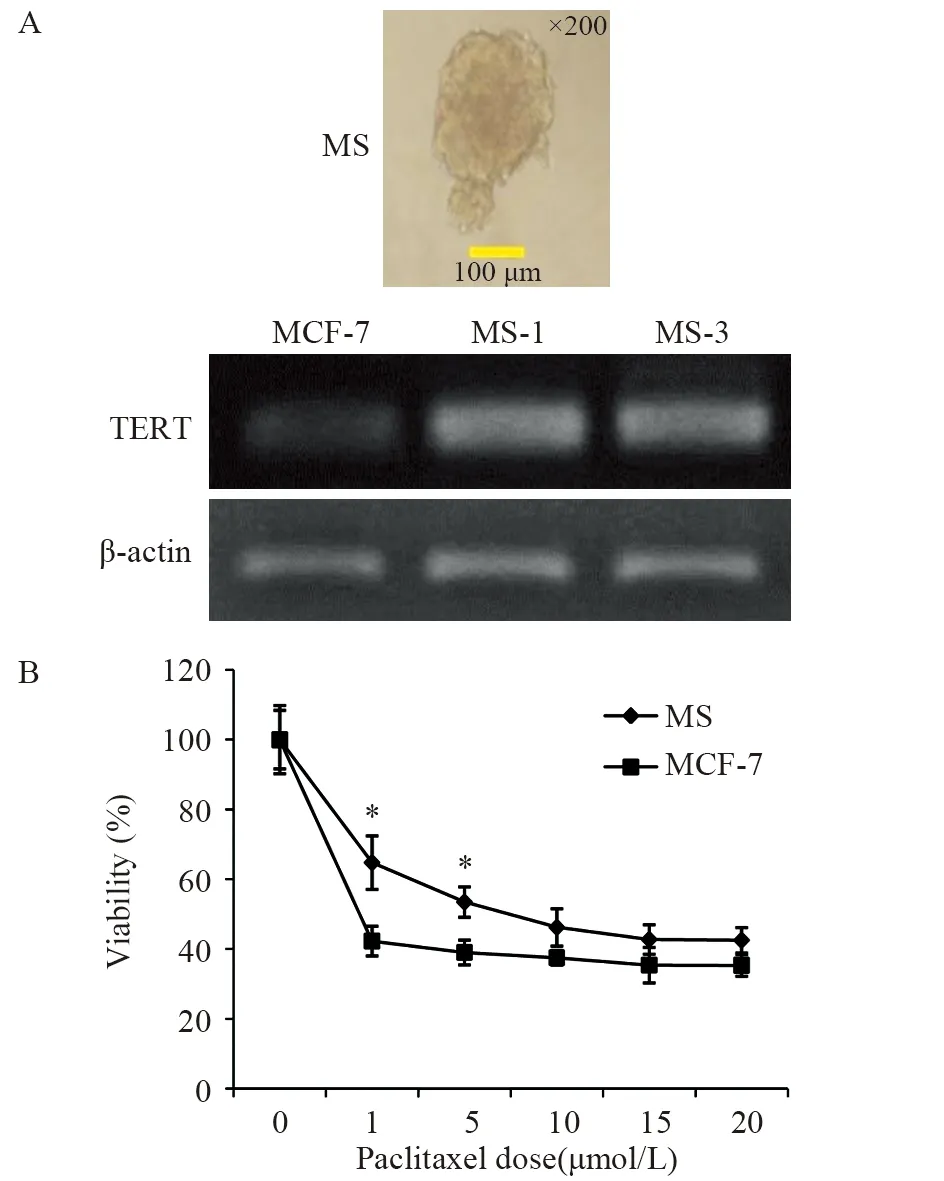
图2 亲本MCF-7细胞培养的微球体细胞(MS)具有高表达的TERT基因并且对化疗耐药Figure2 Mammosphere(MS) cells cultured from parental MCF-7 cells were with high expression of TERT gene and resistant to chemotherapy
β-半乳糖苷酶染色评估结果显示,各组腺病毒的转染效率与病毒浓度呈正相关,且与RIA-LacZ转染的细胞相比,β-半乳糖苷酶在RIA-LacZ-Ad35转染的细胞中显著高表达,见图3A。结果显示:RIA-LacZ-Ad35转染的MS细胞比RIA-LacZ-Ad35转染的MCF-7细胞具有更高转染效率。
2.4 RCA-TERT-Ad35在MCF-7和MS细胞体外的溶瘤作用
在0.5、1、2 MOI梯度下,RCA-TERT-Ad35转染的MCF-7或MS细胞相较于RCA-Ad35转染显示出更高的细胞毒性作用(P=0.038);与亲代MCF-7细胞相比,MS细胞对RCA-Ad35或RCATERT-Ad35更敏感(P=0.033)。在5和10 MOI剂量的病毒组中未见显著差异,可能与细胞过量死亡有关,见图3B。细胞病变效应(cytopathic effect,CPE)测定显示RCA-TERT-Ad35比RCA-Ad35具有更高的细胞杀伤作用,并且MS细胞对病毒治疗比MCF-7细胞更敏感,见图3C。
2.5 RCA-TERT-Ad35在体内的抗肿瘤功效
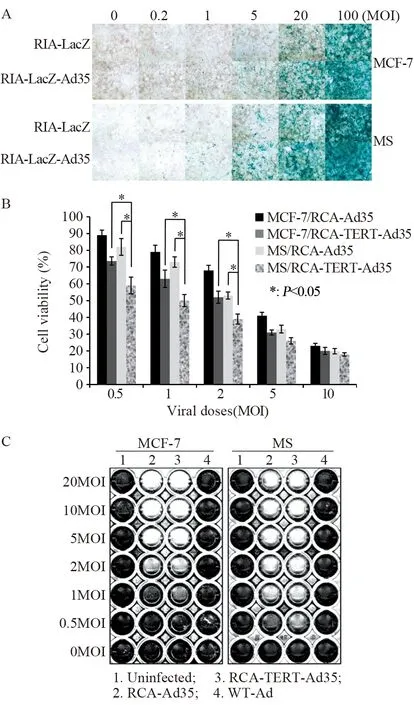
图3 构建的腺病毒载体在体外MCF-7/MS细胞中的转染性和细胞毒性Figure3 Infectivity and cytotoxicity of constructed adenoviral vectors in MCF-7/MS cells in vitro
单独使用PBS处理的小鼠显示出侵袭性肿瘤生长,且第45天迅速达到2 200 mm3。然而,溶瘤腺病毒(RCA-Ad35或RCA-TERT-Ad35)处理的小鼠肿瘤生长受到显著抑制。而且,RCA-TERTAd35治疗组的疗效优于RCA-Ad35治疗组。第45天,RCA-Ad35和RCA-TERT-Ad35处理的小鼠的平均肿瘤体积为810±220和341±124 mm3,与PBS处理组相比,肿瘤生长抑制率分别为63.2%和84.5%(P=0.025),见图4。
2.6 MS和MCF-7细胞的肿瘤形成率
接种5×105/ml及5×104/ml细胞时,MS细胞的肿瘤形成率明显高于MCF-7细胞,见表1。
3 讨论
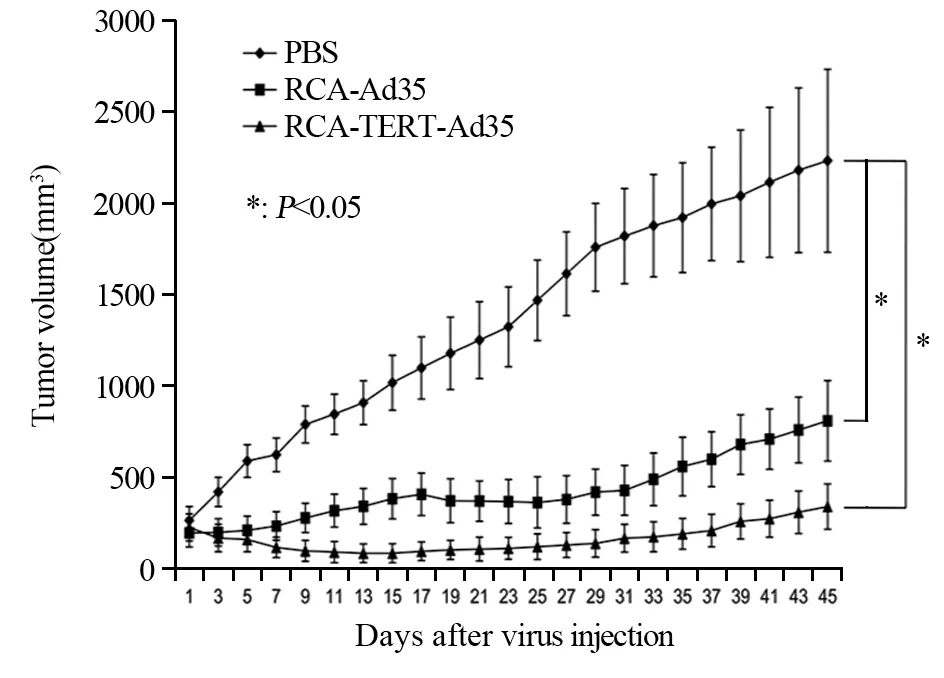
图4 RCA-TERT-Ad35在MCF-7异种移植模型中的抗肿瘤作用Figure4 Anti-tumor effect of RCA-TERT-Ad35 in MCF-7 xenograft model

表1 MS和MCF-7细胞的肿瘤形成率比较Table1 Comparison of tumorigenesis rate between MS cells and MCF-7 cells
作为基因治疗的载体,可塑性是腺病毒载体的重要特征。腺病毒本身不具有癌细胞特异性,有研究证实可通过修饰腺病毒载体来实现靶向特异性。例如,Zhang等[13]构建了一种GP73调节的溶瘤腺病毒GD55,可以靶向肝癌干细胞样细胞,并在裸鼠的异种移植中显示出较强的肿瘤抑制能力。Ying等[14]构建GOLPH2调控的溶瘤腺病毒以靶向前列腺癌干细胞,在体外和体内对人前列腺癌实现显著的抗癌作用。在另一项研究中,Mantwill等[15]使用溶瘤腺病毒以YB-1依赖性方式靶向脑胶质瘤干细胞样细胞。同时,Yang等[4]用TRAIL基因修饰溶瘤腺病毒可靶向肺癌干细胞样细胞。Sato-Dahlman等[16]用CD133靶向基序取代了腺病毒载体纤维节中的主要CAR结合结构域,实现了对CD133阳性结肠癌干细胞的特异性杀伤作用。
TERT发挥与干细胞维持和扩增相关但与端粒维持无关的功能[17-19]。本研究结果显示通过悬浮培养获得的MS细胞TERT高表达,表现出与先前报道一致的干细胞特征,我们评估了hTERT启动子驱动溶瘤腺病毒RCA-TERT-Ad35复制以靶向具有阳性端粒酶活性的肿瘤细胞的可行性,结果表明可以通过靶向TERT选择性地杀死癌症干细胞。目前,已有许多研究使用TERT作为癌症治疗中腺病毒治疗的靶标。如Ye等[20]构建了由TERT启动子驱动的溶瘤腺病毒载体,该载体特异性杀死了TERT阳性的癌细胞。在另一项研究中,TERT启动子被用于驱动腺病毒载体中肿瘤抑制基因的表达,在卵巢癌细胞与正常成纤维细胞共培养模型中诱导肿瘤细胞特异性表达靶基因和凋亡[21]。Li等[22]将CCL20和CD40L基因插入腺病毒载体中,并构建溶瘤腺病毒Ad-CCL20-CD40L,发现该新型溶瘤腺病毒抑制TERT阳性肿瘤细胞的生长并诱导细胞凋亡。Bauerschmitz等[23]已证实hTERT启动子控制的溶瘤腺病毒在体内外对胸腔积液中的CD44+/CD24-/low乳腺癌干细胞具有细胞毒性作用。基于hTERT-Ad构建具有凋亡基因TRAIL的溶瘤腺病毒Ad/TRAIL-E1对放疗耐药的干细胞样食管癌细胞的细胞毒性作用强于非端粒酶特异性溶瘤腺病毒[24]。
溶瘤腺病毒血清型5(Ad5)转染宿主细胞是通过与柯萨奇-腺病毒受体(CAR)的纤维旋钮相互作用启动的。然而,CAR在许多癌细胞中低表达,这将影响5型腺病毒基因治疗的转导效率。与CAR不同,CD46在大多数肿瘤细胞中广泛表达,其功能可能与补体系统的调节有关[25-27]。35型腺病毒纤维对CD46具有高亲和力,Yu等[28]报道的Ad5PTDf35是一种新的OncoAd,具有Tat-PTD修饰的六聚体和35种血清型纤维的Ad5载体,与未修饰的Ad5相比,显著增强包括胰岛和肿瘤起始细胞在内的原代人细胞培养物的转导。同样,本研究更换了具有35型纤维的5型腺病毒载体,显著提高了腺病毒载体的转染效率。本研究结果显示35型纤维似乎对干细胞样癌细胞(MS细胞)比亲代癌细胞(MCF细胞)具有更高的亲和力,这表明MS细胞在获得干细胞特性时也可能改变细胞表型,但未见类似报道,需要进一步的研究来证实。
综上所述,本研究以TERT为靶标构建纤维修饰腺病毒,治疗乳腺癌干细胞样细胞,RCATERT-Ad35比RCA-Ad35具有更高的细胞杀伤作用,并且MS细胞对病毒治疗比MCF-7细胞更敏感,溶瘤腺病毒(RCA-Ad35或RCA-TERTAd35)处理的小鼠肿瘤生长受到显著抑制。而且,RCA-TERT-Ad35治疗组的疗效优于RCAAd35治疗组,提示腺病毒载体有望成为肿瘤干细胞的一种有效治疗手段。
