益生菌预防贮袋炎有效性及安全性的Meta分析
2019-11-25张明玥陈道荣
张明玥, 王 倩, 陈道荣
重庆医科大学附属第一医院消化内科,重庆 400016
贮袋炎是溃疡性结肠炎和家族性腺瘤性息肉病行回肠贮袋-肛管吻合术(ileal pouch-anal anastomosis,IPAA)最常见的远期并发症,是回肠贮袋一种非特异性的炎症。主要临床表现为:腹泻、大便次数增加、排便急迫感、腹痛、便血及盆腔压迫感等[1]。目前诊断贮袋炎主要根据SANDBORN等[2]提出的贮袋炎活动指数(pouchitis disease activity index,PDAI),当PDAI≥7分时,即提示贮袋炎。现其病因及发病机制尚未完全明确,有研究认为,与肠道菌群改变及其产生的异常免疫反应有关[3-4]。益生菌是一种活的微生物,给予足够剂量益生菌对宿主健康有利,益生菌具有调节肠道菌群、增强肠道免疫功能及抑制过敏反应等作用[5]。近年来有较多研究表明,应用益生菌能较好地预防及治疗贮袋炎,但对其临床疗效及不良反应尚无系统性评价。因此本文通过对国内外随机对照试验(RCT)做Meta分析,系统评价益生菌预防贮袋炎的有效性及安全性,旨在为临床预防贮袋炎提供更多的循证学证据。
1 资料与方法
1.1 检索方法使用计算机检索PubMed、Embase、Cochrane Library、维普中文期刊数据库(VIP)、万方数字化期刊全文数据库、中国知网数据库(CNKI);检索时间:建库至2018年10月;中文检索词:贮袋炎、益生菌、回肠贮袋-肛管吻合术、溃疡性结肠炎、随机对照;英文检索词:Pouchitis、Probiotics、VSL#3、IPAA、ulcerative colitis、randomized controlled trial。
1.2 纳入标准(1)研究类型:国内外中、英文临床RCT;(2)研究对象:IPAA术后及贮袋炎缓解期(PDAI<7分)患者,年龄、性别不限;(3)干预措施:试验组给予益生菌预防贮袋炎,益生菌种类、剂量不限;对照组给予同剂量安慰剂或空白对照,其余干预措施一致;(4)结局指标:① 贮袋炎发生率:通过临床、内镜及组织学表现综合评价PDAI≥7分;② 不良反应发生率。
1.3 排除标准(1)非随机对照试验;(2)数据不全或无法获得数据研究;(3)动物实验、系统评价、综述性及重复发表的研究。
1.4 文献信息提取和质量评价由2名研究者独立进行计算机检索,根据纳入标准及排除标准严格筛选、评价及交叉核对,若意见不一致则通过第3名研究者讨论解决,最后确定纳入文献,提取的资料内容包括:第一作者、发表时间、病情分级、干预措施、病例数、随访周期及结局指标等。对纳入的文献根据改良Jadad评分量表(0~7分)进行质量评价,评价项目包括:随机序列的产生(0~2分)、随机化隐藏(0~2分)、盲法(0~2分)、撤出与退出(0~1分),1~3分视为低质量,4~7分视为高质量。
1.5 统计分析采用RevMan 5.3软件对纳入研究的数据进行Meta分析。二分类变量采用OR值和95%CI作为疗效指标分析统计量。应用Q检验及I2检验评估各研究之间的异质性,若P<0.1或I2>50%,认为存在异质性,采用随机效应模型合并数据;反之(P≥0.1 或I2<50%)认为不存在异质性,采用固定效应模型合并数据。P<0.05为差异有统计学意义。绘制漏斗图以分析是否存在潜在的发表偏移。
2 结果
2.1 文献检索结果在上述数据库初步检索出中英文文献562篇,去除非RCT文献489篇,通过阅读标题及摘要排除重复文献54篇,进一步阅读全文,根据纳入标准及排除标准,最终纳入9篇英文文献[6-14]。共353例患者,其中益生菌组163例,对照组190例。
纳入的9篇文献中均研究了益生菌预防贮袋炎的疗效,其中5项RCT研究IPAA术后使用益生菌一级预防贮袋炎,4项RCT研究IPAA术后使用益生菌二级预防贮袋炎;6项RCT报道了益生菌组及对照组不良反应发生率(见表1)。
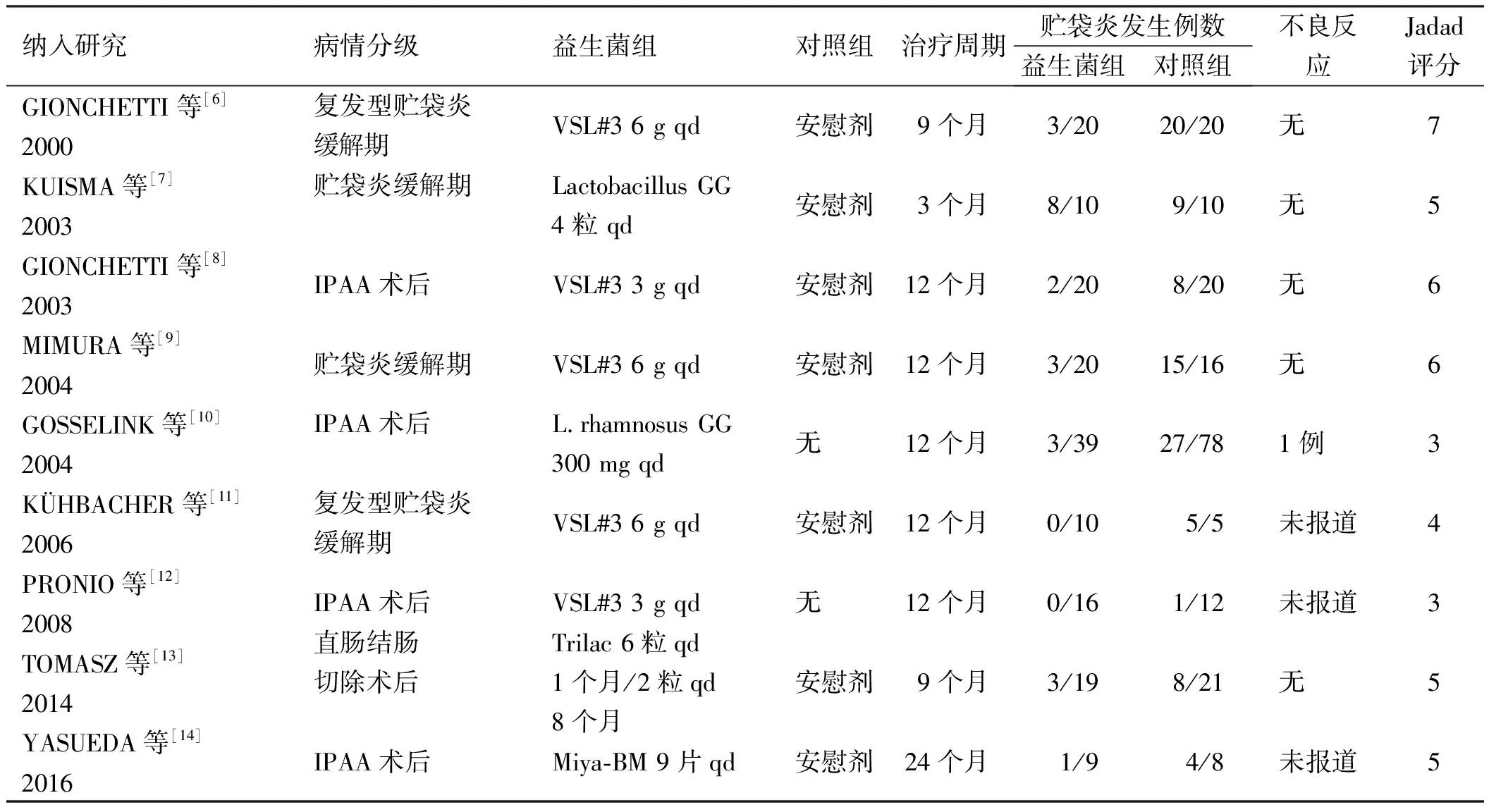
表1 纳入研究基本情况表Tab 1 Characteristics of included studies
注:一级预防: IPAA术后即使用益生菌预防贮袋炎。二级预防:IPAA术后已发生贮袋炎,缓解期使用益生菌预防再次发作。
2.2 Meta分析
2.2.1 有效性: 9项研究均报道了两组(益生菌组及对照组)贮袋炎的发生率,各研究间无统计学异质性(P=0.09,I2=42%),故采用固定效应模型进行Meta分析,结果显示:益生菌组贮袋炎发病率为14.1%,对照组发病率为51.1%,两组间发病率比较,差异有统计学意义(OR=0.10,95%CI:0.05~0.19,P<0.00001)。其中亚组分析显示,VSL#3组(OR=0.04,95%CI:0.01~0.11,P<0.00001)疗效优于非VSL#3组(OR=0.20,95%CI:0.09~0.48,P=0.0002),能更加有效预防贮袋炎发生(见图1)。
2.2.2 安全性:6项研究[6-10,13]明确报道了不良反应,总例数为293例,其中5项研究[6-9,13]报道益生菌组及对照组均未见不良反应,1项研究[10]报道益生菌组发生1例不良反应,主要表现为腹痛、呕吐、腹泻。
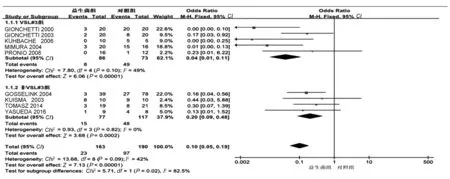
图1 预防贮袋炎有效率Meta分析 Fig 1 The effective rate of probiotics in preventing pouchitis
2.2.3 发表偏倚:对纳入的研究进行漏斗图检验,结果显示,散点多集中分布在漏斗中上部,提示研究精确度较高;但呈偏态分布,两侧分布不对称,提示研究存在一定程度的发表偏倚(见图2)。
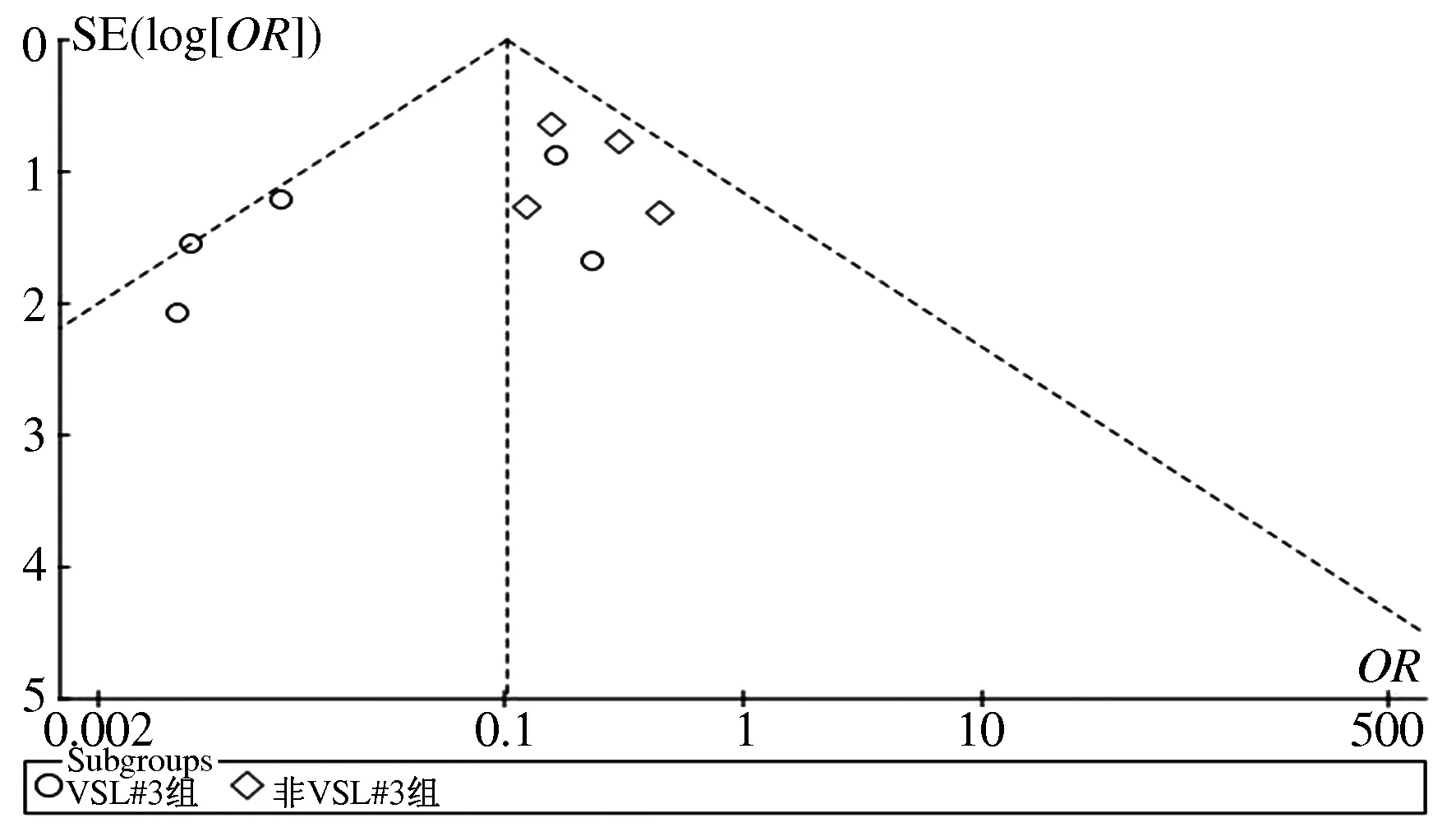
图2 发表偏倚漏斗图 Fig 2 Funnel plot of publication bias
3 讨论
IPAA是难治性的溃疡性结肠炎、不确定的结肠炎及家族性腺瘤性息肉病等疾病首选的手术方式,与传统术式相比,除了全直肠结肠切除,更通过贮袋贮存肠道内容物,保证肠道连续性,从而获得更好的肠道功能及排便控制能力,提高生活质量[15-16],但高达60%的溃疡性结肠炎患者IPAA术后并发贮袋炎[17-18],目前主要通过临床、内镜及组织学表现(大便频率、直肠出血、排便急迫感、发热、内镜下及组织学上炎症表现、溃疡范围)三方面综合诊断,口服抗生素(环丙沙星或甲硝唑 2~4周)作为其一线治疗方案[19]。其发病机制可能与肠道黏膜优势菌群种类及数量改变、代谢物破坏袋内黏膜稳态有关。SEGAL等的研究结果也证实,造口关闭后,回肠样菌群逐渐转变为结肠样菌群,梭状芽孢杆菌及金黄色葡萄球菌等明显增多[20],相关研究报道贮袋炎患者肠道及粪便中厌氧菌减少及需氧菌增加,例如:大肠埃希菌、双歧杆菌、乳酸杆菌及肠球菌等菌群改变[21-22]。另外贮袋粪便淤积致肠道黏膜微生物超载及宿主免疫功能失调也是其发病原因。因此调节肠道微生物菌群成为贮袋炎的一种潜在治疗方向,其中益生菌得到了最大关注,特别是VSL#3——一种复合益生菌(含短双歧杆菌、长双歧杆菌、婴儿双歧杆菌、嗜酸乳杆菌、植物乳杆菌、副干酪乳杆菌、保加利亚乳杆菌和嗜热链球菌)的研究较多。其机制主要考虑以下几方面:(1)加强黏膜屏障的保护作用;(2)调节肠道菌群;(3)免疫保护及抗炎作用[25]。现阶段普遍认为益生菌使用较安全,但对于肠道屏障及免疫功能缺陷宿主使用益生菌可能会增加其感染风险,故现阶段暂不建议其作为急性及重度贮袋炎患者的一线用药。
本研究共纳入9篇关于益生菌预防贮袋炎的临床疗效文献,均为RCT,根据改良Jadad评分量表进行质量评价,≥4分有7篇,故认为文献质量较高。分析结果显示,对于IPAA术后及抗生素诱导缓解的贮袋炎患者,使用益生菌较安慰剂及不治疗可明显降低贮袋炎发生率,益生菌组临床疗效是对照组的3.6倍。亚组分析结果显示:VSL#3组较非VSL#3组有更好的预防效果,且两组间不良反应发生率差异无统计学意义。
本研究的局限性:(1)只纳入了9篇研究,数量较少,总体样本量较小,且小部分研究质量偏低。(2)纳入研究的患者病情情况、益生菌用药种类、剂量及疗程时间不同,存在临床异质性。(3)部分研究对其不良反应未提及。(4)漏斗图呈偏态分布,提示本研究有一定程度的发表偏倚。
综上所述,本文通过系统性分析显示,对于IPAA术后及反复发作的贮袋炎患者,使用益生菌预防贮袋炎的临床疗效高于对照组,且不良反应少,安全性高,为预防及治疗贮袋炎提供了一定的证据。未来仍需要大量多中心、大样本、高质量的随机对照试验进一步的探索及验证,为临床做更好的指导。
