微环DNA 表达抗EpCAM/抗CD3双特异BiTE分子的抗卵巢癌细胞体外实验研究
2019-11-22陈远群陈国创韦枝红
陈远群 谌 平 陈国创 韦枝红
1.深圳大学第一附属医院深圳市第二人医院妇科,广东深圳 518035;2.中国科学院深圳先进技术研究院,广东深圳 518055;3.广东省深圳市宝安区人民医院(原深圳大学第一附属医院深圳市第二人医院)妇科,广东深圳 518101
卵巢癌是妇科恶性肿瘤死亡率最高的一种[1-2],其高死亡率除了因早期发现困难,更重要是其晚期化疗效果不佳[3-4]。大多数卵巢癌细胞在经历铂类等细胞毒性药物治疗后,均出现优势克隆适应性进化[5-7],耐药性的出现。因此,我们急需建立一种有效、安全的卵巢癌晚期治疗方案,单克隆抗体疗法中的双特异性T 细胞衔接器(BiTE)的独特功能为妇科肿瘤免疫治疗中明星分子[8-10]。本实验主要选择靶向上皮细胞黏附分子(EpCAM),作为卵巢癌细胞特异的上皮黏附因子及T 细胞特异黏附因子CD3,作为BiTE 的两个特异抗体。采用非病毒载体微环DNA 表达系统获取蛋白。观察抗EpCAM 加抗CD3 双特异BiTE 分子蛋白(抗EpCAM/抗CD3 BsAb)对诱导T 细胞特意杀伤卵巢癌细胞的影响。
1 材料与方法
1.1 主要仪器及试剂
化学发光成像系统(Bio-red,美国);倒置生物显微镜(OLYMPUS,日本);Bright-GloTM萤光素酶检测系统(Promega,E2610);分选型流失细胞仪(BD Cano Ⅱ);动态光散射粒径测试仪(Malvern,英国);荧光倒置显微镜(Nikon,日本);Anti-6*His tag antibody(Abcam,美国);蛋 白显影液(Cell Signaling,美国);PVDF 膜(Millipore,美国),anti-rabbit IgG(Cell Signaling,美国)。
1.2 实验方法
1.2.1 抗EpCAM/抗CD3 BsAb 的制备 采用X-treme-GENE HP DNA transfection reagent 和表达载体SZ-90 EpCAMxCD3 瞬时转染HEK293 细胞,使用Expi293表达培养基获得大量含有表达产物的细胞培养上清。收集上清液进行蛋白的检测。
1.2.2 抗EpCAM/抗CD3 BsAb 的纯化 用cOmplete His-Tag Resin 和ÄKTA 蛋白纯化系统分离纯化BsAb抗体。采用Werstern blot 技术。将抗EpCAM/抗CD3 BsAb 表达上清液和HEK293 细胞裂解液,加入5×蛋白loading buffer 混合。转膜,切取蛋白Marker 在14~97 kD 的位置,将其覆盖在PVDF 膜的负极方向,将混合液滴加到膜上并进行曝光成像。
1.2.3 流式细胞术检测BiTE 对T 细胞和EpCAM+肿瘤细胞的选择性结合,抗EpCAM/抗CD3 BsAb 靶向性检测 抗体分别和(A)T 细胞、(B)CaOV3-luc 细胞孵育,后加入APC-conjugated anti-His 抗体作为二抗,流式细胞术检测荧光强度。
1.2.4 抗EpCAM/抗CD3 BsAb 介导T 细胞对人卵巢癌CaOV3 的细胞毒性作用 本实验分4 组进行观察:T 细胞组、卵巢癌细胞组、T 细胞加卵巢癌细胞组以及抗体加T 细胞加卵巢癌细胞组。T 细胞、SKOV3细胞和抗体孵育。分别用碘化丙啶(PI)和Calcein-AM复染,将PI+Calcein-AM 培养,分别在光镜以及倒置荧光显光显微镜观察,并采用电脑合成图像把PI 和Calcein-AM 染色图像融合于一图中观察。
1.2.5 抗EpCAM/抗CD3 BsAb 介导T 细胞杀伤卵巢癌CaOV3 细胞 效靶比为10∶1,T 细胞、CaOV3-luc细胞和抗体共孵育6 h 和12 h,培养基:98McCoy 5a +1FBS+1 青/链霉素双抗,ONE-GloTM萤光素酶检测系统试剂盒检测抗EpCAM/抗CD3 BsAb 介导的T 细胞毒性作用。Promega GloMax 96 微孔板发光检测仪设置:读取数据。
1.3 统计学方法
采用SPSS 25.0 统计学软件进行数据分析,计量资料数据用均数±标准差()表示,多组间比较采用单因素方差分析,两两比较采用独立样本t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 抗EpCAM/抗CD3 BsAb 体外表达
采用蛋白电泳分离细胞上清液中抗体,见抗体外表达成功,分子量约为59 kD,无其他杂带出现。见图1。

图1 BiTE-anti-EpCAM×anti-CD3 抗体表达
2.2 抗EpCAM/抗CD3 BsAb 体外表达提纯
使用蛋白质免疫印迹技术顺利提纯抗体。见图2。
2.3 流式细胞仪检测抗EpCAM/抗CD3 BsAb 可分别靶向结合T 细胞及卵巢癌细胞
2.3.1 抗EpCAM/抗CD3 BsAb 靶向结合T 细胞检测结果 单一T 细胞的平均荧光强度(MFI):1587。抗体加T 细胞后的MFI:24 625。由图可见未结合抗体的T细胞与结合抗体T 细胞在流式细胞仪下明显区分,提示抗体能够靶向结合T 细胞。见图3。

图2 BiTE-anti-EpCAM×anti-CD3 抗体的Western blot 检测

图3 BiTE-anti-EpCAM×anti-CD3 与T 细胞特异性结合
2.3.1 抗EpCAM/抗CD3 BsAb 靶向结合卵巢癌细胞检测结果 单一卵巢癌细胞的MFI:1809。抗体加卵巢癌细胞后的MFI:84526。由图可见未结合抗体的卵巢癌细胞与结合抗体卵巢癌细胞在流式细胞仪下明显区分,提示抗体能够靶向结合卵巢癌细胞。见图4。
2.4 抗体介导T 细胞对人卵巢癌的细胞毒性作用的形态学变化
2.4.1 光镜和Calcein-AM 染色图 见T cells+CaOV3肿瘤细胞均散在分布,少许T 细胞围绕肿瘤细胞。T cells +SKOV-3+抗体图:T 细胞和肿瘤细胞聚集成块的卵巢癌肿瘤-T 细胞团,散在T 细胞较少。见图5。
2.4.2 PI 染色图 卵巢癌细胞和T 细胞组:少量卵巢癌细胞及少量T 细胞被PI 染色,说明卵巢癌细胞和T 细胞中有少量死细胞。T cells+CaOV3 组见死亡细胞增多并聚集。T cells +SKOV-3+抗体组:T 细胞和卵巢癌细胞大量聚集,并成块的卵巢癌肿瘤-T 细胞团,死亡细胞明显增加。见图5。
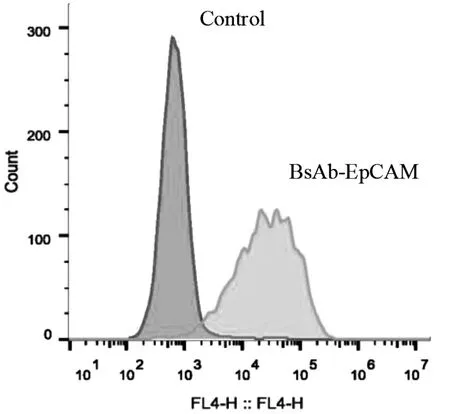
图4 BiTE-anti-EpCAM×anti-CD3 与卵巢癌细胞CaOV3-luc cells特异性结合
2.4.3 融合图 增加抗体后的卵巢癌细胞死亡细胞数较明显增多,并聚集成团。见图5。
2.5 抗体对于诱导T 细胞杀伤卵巢癌细胞的细胞特异性杀伤率随时间以及浓度的变化情况
抗体对于诱导T 细胞杀伤卵巢癌细胞的细胞特异性杀伤率随时间的延长效果不是一直增强。抗体的浓度低于1×10-6μg/mL 时,6 h 的特异性杀伤率与12 h比较,差异无统计学意义(P>0.05);而浓度升高时,12 h 的效果较6 h 更强,随着剂量的增加而杀伤效果更好,直到浓度到达1×10-3μg/mL,出现效果下降。抗体的浓度≥1×10-5μg/mL 时,两个时间的特异杀伤率比较,差异有统计学意义(P<0.05)。两个不同时间的特异杀伤率均在1×10-4μg/mL 的浓度时,杀伤效率最强。见表1。
3 讨论
卵巢癌是妇科死亡率第一[11]的恶性肿瘤。耐药及杀伤自身健康细胞是造成其高死亡率的重要原因之一[12]。近年来,癌症的免疫治疗在血液系统等恶性肿瘤治疗中取得卓越的成就[13-14],免疫治疗的巨大优越性让其在肿瘤化疗治疗中成为研究的热点[15-16]。传统的抗体基因疗法中抗体半衰期短,技术要求高精阻碍免疫治疗的推广。本研究采用的非病毒载体的微环DNA 可以在同等条件下实现持续表达。微环DNA 能在体内长期、稳定、高效地表达目的基因且几乎无毒性。目前本实验所使用的微环DNA 的制备技术在已实现安全、无毒、高质量的规模化制备[17]并取得中国专利201510859263.2。
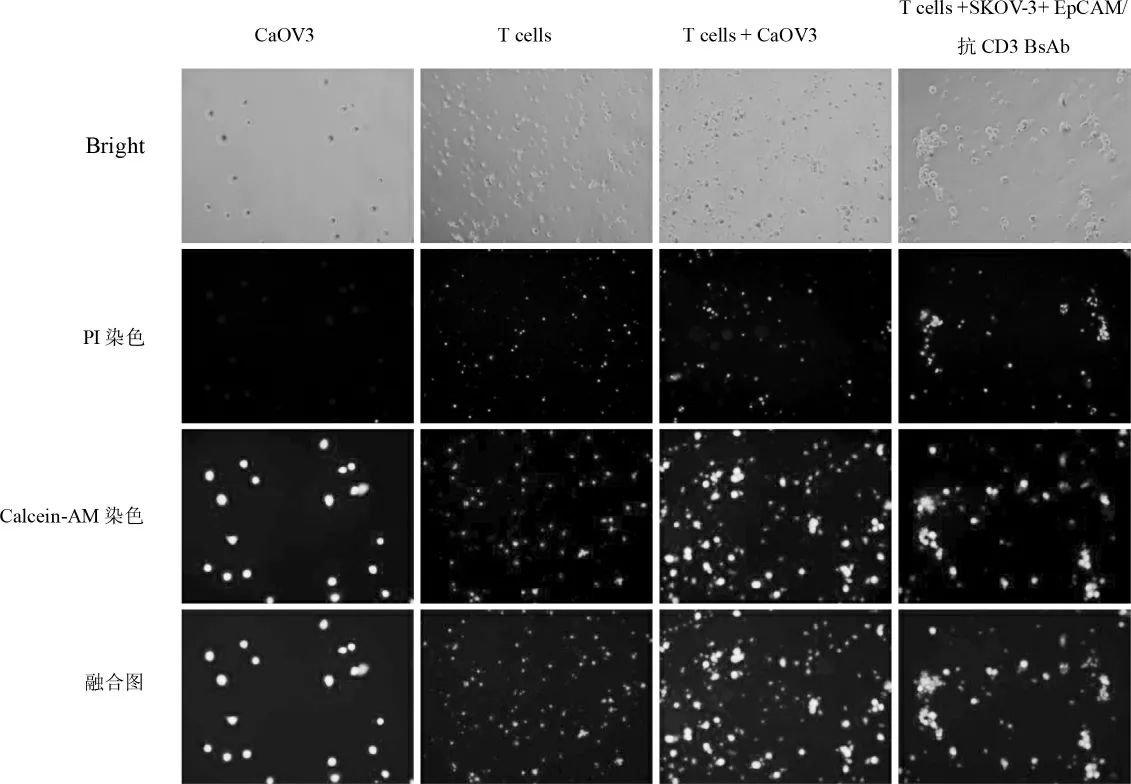
图5 Calcein-AM 和PI 双染色观察细胞凋亡情况(标尺:200μm)

表1 不同浓度BiTE-anti-EpCAM×anti-CD3 作用不同时间对卵巢癌细胞的特异杀伤率比较(n=4)
EpCAM 在卵巢癌细胞中高表达并可促进卵巢癌细胞生长,种植,转移等[7],本实验BiTE 的两种抗体[18],一靶向肿瘤细胞EpCAM,另一靶向T 细胞表面分子CD3,桥接卵巢癌细胞和T 细胞,介导特异性杀伤。本实验可清晰看到非病毒载体MC 系统成功表达抗Ep-CAM/抗CD3 BsAb。
研究表明肿瘤细胞的免疫杀伤主要是通过双特异抗体在肿瘤细胞和T 细胞之前形成“免疫突触”[19-20],起到抗肿瘤的免疫反应。本实验通过PI 和Calcein-AM 双染色,倒置显微镜下见T 细胞+卵巢癌+抗体组中T 细胞向卵巢癌细胞的集结增加,并出现大量细胞死亡。侧面上证明抗体能够增强诱导T 细胞靶向杀伤卵巢癌细胞。
观察升高浓度和延长时间下,抗体对于诱导T 细胞的特异杀伤率并不是无限增强。在同样6 h 的作用下抗体浓度高于1×10-7μg/mL 后,随着浓度的上升,特异杀伤率升高,差异有统计学意义(P<0.05),但这样的趋势并不是无限的延伸;在浓度1×10-3μg/mL 后,才出现特异杀伤效果下降。在浓度达1×10-6μg/mL 之前,6 h 的特异杀伤率较高;浓度达1×10-6μg/mL 后12 h 的杀伤较6 h 的杀伤率高。浓度在1×10-4μg/mL时,两时间均达到最大的杀伤。也可以理解,在使用抗体浓度方面需要,1×10-5μg/mL~1×10-4μg/mL 持续时间12 h 时,抗体诱导T 细胞杀伤卵巢癌细胞最强。由此推断,抗EpCAM/抗CD3 BsAb 诱导T 细胞特异性杀伤卵巢癌细胞具有一定的时间以及药物浓度的依赖性,大剂量药物浓度并不会提高其对卵巢癌细胞的杀伤性,而过于密集的使用亦不能提高其杀伤性,而是在一定的浓度以及时间时间间隔里使用方可提高此抗体诱导T 细胞特异杀伤卵巢癌。此实验亦为未来动物以及人体实验提供一个浓度以及时间节点。
综上所述,本实验进一步证明anti-EpCAM/CD3双特异抗体具有介导T 细胞靶向、高效清除卵巢癌细胞;本实验所使用的非病毒载体的方法,基于微环DNA 载体表达双特异抗体的抗癌策略的具有可行性,为卵巢癌的免疫治疗提供一种可选的基因药物。本实验同时提出,抗EpCAM/抗CD3 BsAb 诱导T 细胞杀伤具有一定的时间以及剂量的依赖性,为未来临床试验提供一可行的时间以及剂量数据。
