基于对照制剂的牛黄清胃丸中冰片的质量评价
2019-11-21查祎凡聂黎行于健东忠马双成
查祎凡 聂黎行∗于健东∗戴 忠马双成
(1.中国食品药品检定研究院,北京100050;2.中国药科大学,江苏 南京211198)
牛黄清胃丸收载于《卫生部药品标准中药成方制剂(第一册)》,由牛黄、大黄、菊花、麦冬、薄荷、石膏、栀子、玄参、番泻叶、黄芩、甘草、冰片17味中药组成,具有清胃泻火、润燥通便的作用,用于心胃火盛、头晕目眩、口舌生疮、牙龈肿痛、乳蛾咽痛、便秘尿赤[1]。方中冰片功效清热止痛,但执行标准中缺乏其质量控制项目;另一方面,在合成过程中会产生副产物樟脑,气味和外形相似,但具有毒性[2],同时市售品存在该成分含有量超标的问题[3-4],故需要进行检查。
中成药中冰片质量控制的方法常采用GC 技术[5-10],但其易挥发,含有量限度设定往往无据可依。为了科学地评价牛黄清胃丸中冰片质量,本实验创新性地引入对照制剂,采用GC 法测定龙脑、异龙脑含有量,对樟脑进行限量检查,同时研制了相关对照制剂,考察了生产、贮存过程中冰片转移和损失情况,以期为含冰片原粉制剂的质量和安全控制提供参考。
1 材料
AE240(十万分之一)、FX-200(万分之一)电子分析天平(瑞士梅特勒-托利多公司);Agilent 7890N 气相色谱仪(美国Agilent 公司);Climacell 恒温恒湿箱(德国MMM公司);KQ3200DB 数控超声波清洗器(昆山市超声仪器有限公司)。
樟脑(110747-201409)、异龙脑(111512-201603)、龙脑(110881-201508)对照品,以及人工牛黄(121197-201204)、大 黄(120902-201311 )、菊 花(121384-201504)、麦 冬(121013-201310 )、薄 荷(120916-201310)、栀 子(120986-201610 )、玄 参(121008-201609)、番泻叶(120996-201205)、黄 芩(120955-201309)、甘 草(120904-201620 )、桔 梗(121028-201612)、黄 柏(121510-201606 )、连 翘(120908-201216)、牵牛子(121024-201606)、枳 实(120936-201606)对照药材均由中国食品药品检定研究院提供;石膏购于北京华邈药业有限公司,经中国食品药品检定研究院聂黎行副研究员鉴定为正品。牛黄清胃丸对照制剂由中国食品药品检定研究院按大生产规模自行研制,其中冰片来自福建青松股份有限公司。炼蜜由北京同仁堂股份有限公司同仁堂制药厂提供。无水乙醇、乙酸乙酯,硅藻土为分析纯(国药集团化学试剂有限公司)。
2 方法
2.1 溶液制备
2.1.1 对照品溶液 精密称取樟脑、异龙脑、龙脑对照品适量,无水乙醇制成每1 mL 分别含三者10 μg、0.1 mg、0.1 mg,即得。
2.1.2 供试品溶液 取重量差异项下丸剂适量,研细,精密称取3 g,加入无水乙醇30 mL,称定质量,冰浴超声(100 W、40 kHz)45 min,冷却至室温,无水乙醇补足减失的质量,摇匀,滤过,即得。
2.1.3 阴性样品溶液 按照丸剂处方和制法,制备缺冰片的阴性样品,按“2.1.2”项下方法制备,即得。
2.2 色谱条件[11]HP-INNOWax 色谱柱(0.32 mm×30 m,0.25 μm);进样口温度250 ℃;柱温100 ℃;FID 检测器温度300 ℃;载气体积流量1.8 mL/min;进样量1 μL;分流比10 ∶1。
3 结果
3.1 样品溶液制备方法 本实验对是否加硅藻土、提取溶剂种类和用量、提取时间进行了比较,发现不加硅藻土直接研磨时冰片提取效率更高;无水乙醇提取效率高于乙酸乙酯;无水乙醇加入量30 mL、超声时间45 min 时,龙脑、异龙脑含有量不再增高。
3.2 方法学考察
3.2.1 专属性试验 取对照品、供试品、阴性样品溶液,在“2.2”项色谱条件下进样测定,结果见图1。由图可知,阴性样品在对照品保留时间处无干扰,表明该方法专属性良好。
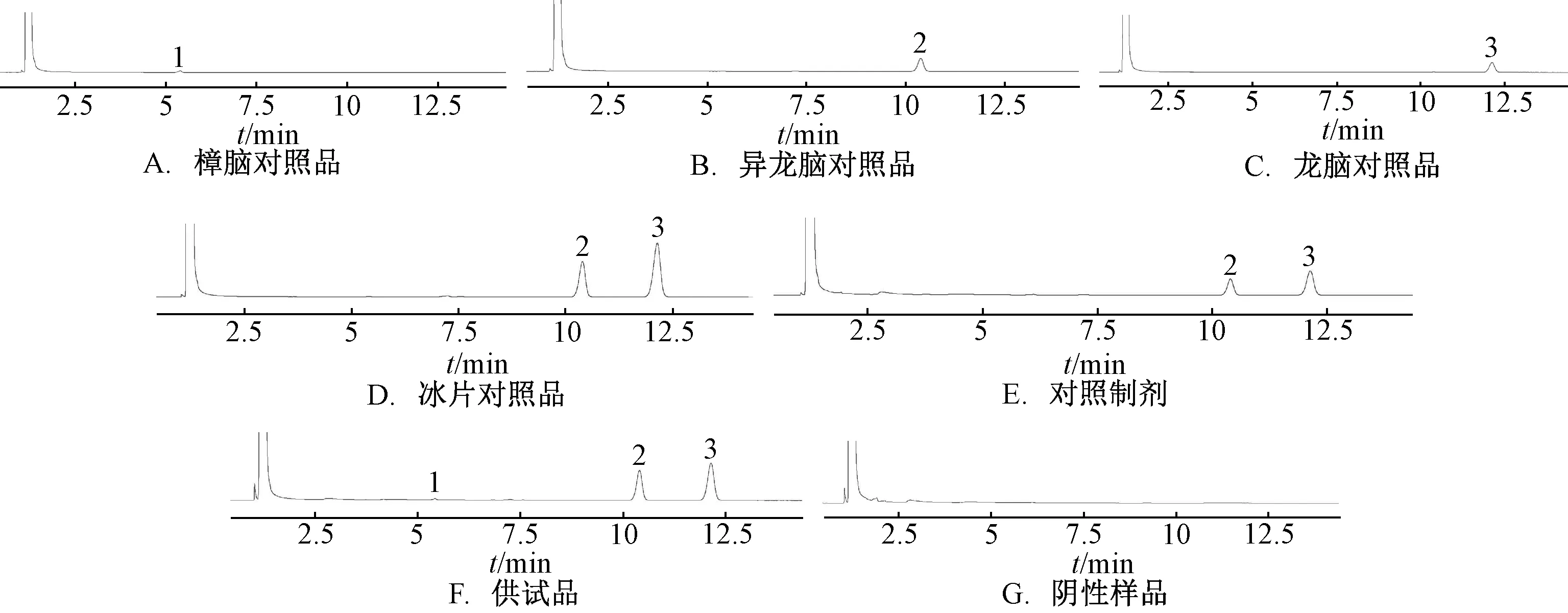
图1 各成分GC 色谱图
3.2.2 检出限、定量限 取质量浓度已知的樟脑对照品溶液,在“2.2”项色谱条件下进样测定,测得检出限(信噪比3 ∶ 1)为0.26 μg/mL,定量限(信噪比10 ∶ 1)为1.51 μg/mL。
3.2.3 线性关系考察 精密称取各对照品适量,无水乙醇制成每1 mL 分别含樟脑19.26 μg、异龙脑1.01 mg、龙脑1.01 mg 的贮备液,将其稀释成不同质量浓度,在“2.2”项色谱条件下各进样1 μL 测定。以溶液质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表1,可知各成分在各自范围内线性关系良好。
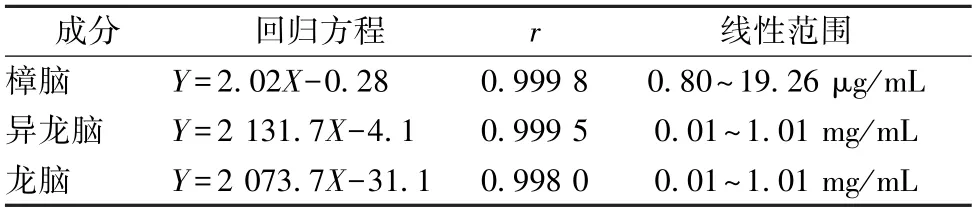
表1 各成分线性关系
3.2.4 精密度试验 取供试品溶液(批号20170602),在“2.2”项色谱条件下进样测定6次,测得樟脑、异龙脑、龙脑峰面积RSD 分别为2.33%、1.79%、1.43%,表明仪器精密度良好。
3.2.5 稳定性试验 取供试品溶液(批号20170602),室温下放置0、1、2、4、6、8 h 后在“2.2”项色谱条件下进样测定,测得樟脑、异龙脑、龙脑峰面积RSD 分别为2.37%、1.70%、1.04%,表明溶液在8 h 内稳定性良好。
3.2.6 重复性试验 取同一批丸剂(批号20170602),按“2.1.2”项下方法平行制备6份供试品溶液,在“2.2”项色谱条件下进样测定,测得樟脑、异龙脑、龙脑含有量RSD 分别为2.38%、2.37%、2.94%,表明该方法重复性良好。
3.2.7 加样回收率试验 取含有量已知的丸剂(批号20170602),研细,精密称取1.5 g,按高、中、低3个水平精密加入对照品溶液,每个水平按“2.1.2”项下方法平行制备3份供试品溶液,在“2.2”项色谱条件下进样测定,计算回收率,结果见表2。
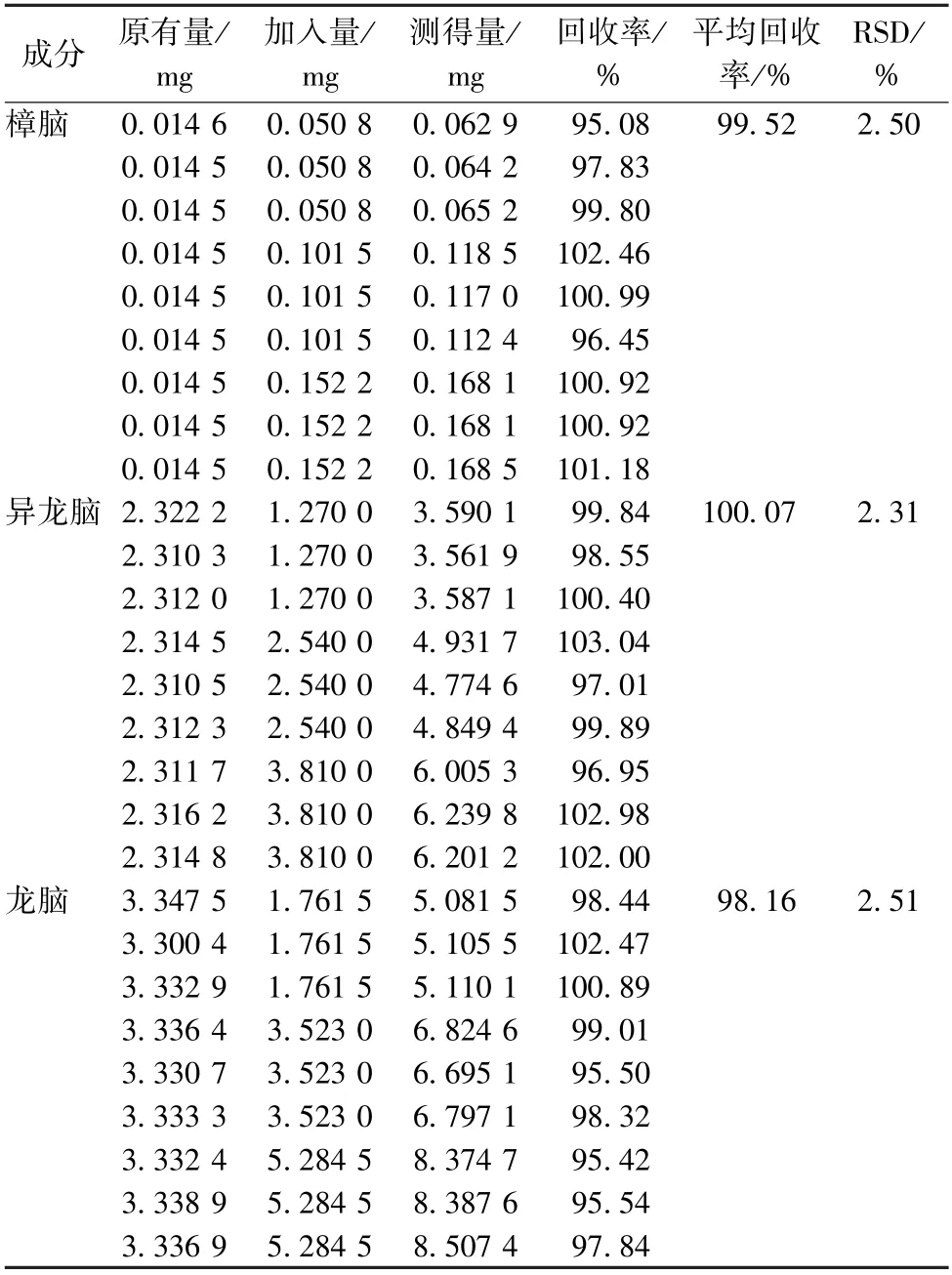
表2 各成分加样回收率试验结果(n=9)
3.3 样品含有量测定 取46批样品,每批按“2.1.2”项下方法平行制备2份供试品溶液,在“2.2”项色谱条件下进样测定,计算含有量,结果见表3。
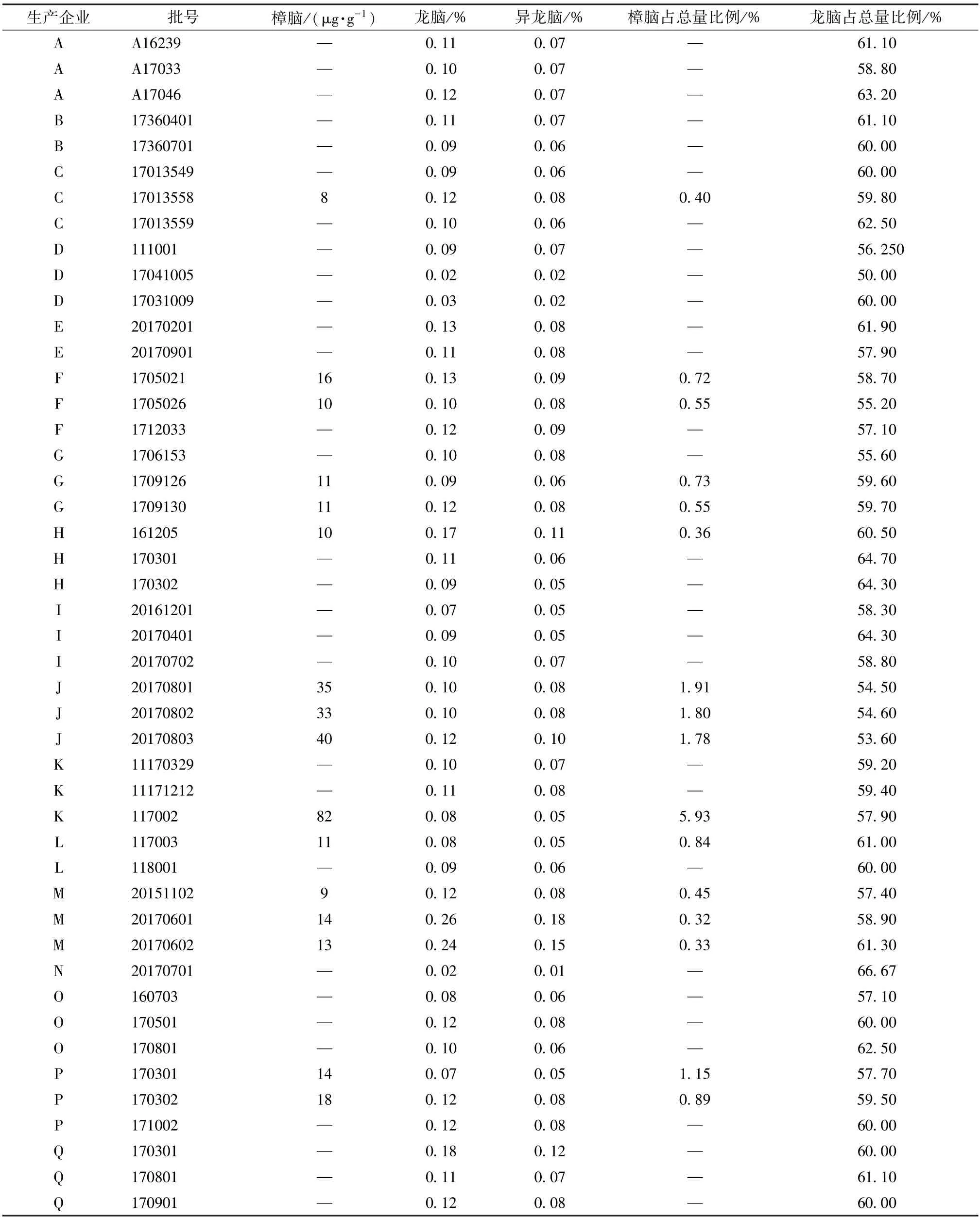
表3 各成分含有量测定结果(n=2)
3.4 冰片转移率、损失率测定 取对照制剂及冰片,同法测定,以龙脑含有量为指标,根据冰片处方量和对照制剂中炼蜜加入量,测得冰片转移率为38%。再取新制备、包装完好的对照制剂,置于温度60 ℃、相对湿度60%的恒温恒湿箱中10 d,于第0、5、10天取样,同法测定,以龙脑含有量为指标,测得损失率分别27%、48%。由此确定,冰片在贮存过程中的损失率暂以48%计。
4 讨论
4.1 牛黄清胃丸中与冰片质量相关的安全性评价《中国药典》 规定,冰片中樟脑含有量限度为0.50%[12]。牛黄清胃丸用量为1次2丸,每天2次,最大日服用剂量为24 g,按樟脑每天最大服用量1.5 mg 计算,本实验拟定樟脑安全限度为62 μg/g,并发现46批样品中有1批超过限度。另外,10批样品中樟脑含有量占樟脑、异龙脑、龙脑总量的比例大于0.50%,可能是由于企业投料用的冰片杂质过多,故建议提高原料质量。
4.2 牛黄清胃丸中与冰片质量相关的有效性评价 《中国药典》 规定,冰片中龙脑含有量不得低于55.0%[12]。本实验发现46批样品中龙脑占樟脑、异龙脑、龙脑总量的比例均在55.0%左右,表明投料用冰片中龙脑含有量基本符合规定。按处方量折算,牛黄清胃丸中龙脑理论含有量为0.36%,但“2.4”项下结果显示对照制剂所含冰片在生产过程中的转移率为38%,贮存过程中的损失率为48%,故拟定其含有量限度为0.12%。同时,有16批样品达到该拟定限度,占34.8%,提示企业应加强生产过程控制,改善包装材料,以降低冰片损失;D 厂家2批样品、N 厂家1批样品测定值明显偏低,仅在0.03%左右,可能是企业未按处方量投料。
4.3 对照制剂在中药质量控制中的应用 对照制剂作为中药标准物质的新形式,是指采用道地、优质、规范加工的原料药材(饮片)和辅料,严格按照制法和生产工艺规程,并遵循药品生产质量管理规范制备的实物对照,主要用于中成药质量控制,评价产品投料真实性(是否投入正确原料)和投料量可靠性(是否按处方量投料)[13]。将对照制剂用于中药研究、生产、质量控制时,可提供化学成分(群)从原料到制剂的转移率等关键信息,有助于完善质量标准,提高工艺水平,保证用药安全有效。
