青藤碱对体外人胆管癌细胞的抑制作用
2019-11-21吕彦霖朱昌毫潘耀振孙诚谊
吕彦霖,朱昌毫,潘耀振,陈 玲,喻 超,孙诚谊
(贵州医科大学附院肝胆外科,贵州 贵阳550004)
近些年来,胆管癌已经成为南美和亚洲第二常见的原发性肝癌,且早期难以诊断,大多数患者诊断时已为晚期[1]。尽管随着科技的发展,对于胆管癌的治疗有了很多先进的方法,比如手术治疗、放射治疗和化学药物治疗等,但是在晚期患者中总体预后较差,5年生存率仅为20%~30%[2]。最近研究表明,中国传统中药对包括胆管癌在内的多种癌症都有治疗作用[3-4]。
青藤 碱(7,8-didehydro-4-hydroxy3,7-dimethoxy-17-methyl-9a,13a,14a-morphinan-6-one,SIN)是一种从中草药青藤中提炼出来的活性成分,在中国已经有两千多年用治风湿病的历史[5]。近年来随着对青藤碱的深入研究,发现青藤碱不仅在治疗免疫相关疾病时具有抗炎[6]、镇痛[7]、免疫抑制和抗血管生成[8]以及改善关节炎等作用,而且其抗肿瘤作用也尤为显著。近年来,许多研究人员做了大量关于青藤碱在抗肿瘤方面的科学实验,发现青藤碱对胃癌[9]、肝癌[10]、卵巢癌[11]以及胰腺癌[12]等多种肿瘤具有明显的抑制作用。然而,青藤碱是否对胆管癌也具有相同的抑制作用,相关的研究目前还比较少。
本研究通过研究青藤碱对人类胆管癌细胞系HUCCT-1及TFK-1生长增殖和侵袭转移的调节作用,探讨青藤碱对胆管癌的治疗作用,为开发和寻找新型抗胆管癌药物做积极探索。
1 材料
1.1 细胞株 HuCCT-1、TFK-1胆管癌细胞株购自湖北省武汉市同济医院肝胆胰外科实验室。
1.2 试药 青藤碱(Selleck,批号S235901),胎牛血清(Gibco,批 号 1992275)、RPMI-1640(Gibco,批 号 22400105)、0.25% 胰蛋白酶(Gibco,批号25200056)、0.05%不含EDTA 的胰蛋白酶(Gibco,批号15400054),Cell Counting kit-8(CCK-8)(碧云天,批号C0037),Transwell小室(Corning,批号3422),Matrigel 胶(BD,批号354234)、AV-FITC/PI 凋亡试剂盒(Solabio,批号CA1020),RIPA 裂解缓冲液(Solabio,批号R0020),BCA 蛋白浓度测定试剂盒(Solabio,批号 PC0020)、SDS-PAGE 凝胶配置试剂盒(Millipore,批 号 V900858 ),Cleaved-Caspase3(CST,批号9661S)、Cleaved-Caspase9(CST,批号9502S)、Vimentin(CST,批号5741S)、E-cadherin(CST,批号3195S)、GAPDH(CST,批号5174S),羊抗鼠(Boster Bio,批号BM2002)、羊抗兔(Boster Bio,批号BA1066)。
1.3 青藤碱溶液的配制 青藤碱首先溶于二甲基亚砜DMSO 溶液溶解,配制终浓度为50 mmol/L 的储存液,放进4 ℃冰箱低温避光存放。需使用时,采用无血清RPMI-1640将贮备液稀释为10 mmol/L的工作液用以加药处理细胞。使每组培养基中含有DMSO 的浓度为0.1%,来表明DMSO 对胆管癌细胞无毒性。
2 方法
2.1 细胞培养 2种人类胆管癌细胞株HuCCT-1、TFK-1均用含10%胎牛血清的RPMI-1640培养液,放进恒温培养箱(37 ℃,5% CO2)中进行孵育培养,待细胞铺满培养瓶底部70%~80%后用胰蛋白酶进行消化后传代处理,后续试验选取处于对数生长期细胞。
2.2 CCK-8检测细胞存活率 取对数生长期细胞,PBS 清洗,0.25%胰蛋白酶消化后,用含10%血清的培养基中和,制备细胞悬液。细胞计数后,接种4 000个细胞于96孔板每孔中,每个孔用培养基配足200 μL 体积。实验分组分为6组,空白对照组(用不含青藤碱的1640处理)、0.125 mmol/L 青藤碱组、0.25 mmol/L 青藤碱组、0.5 mmol/L 青藤碱组、1.0 mmol/L 青藤碱组、2.0 mmol/L 青藤碱组,每组5个生物学重复,培养24 h 后按照分组进行加药处理,处理完毕后封闭盖子,置于细胞培养箱中培养。根据实验分组情况,各组给予不用浓度的青藤碱处理24、48、72 h 后,分别弃去96孔板内的培养基,向每孔中加入110 μL CCK-8显色液(10 μL CCK-8溶于100 μL 无血清培养基)。加液完毕后将96孔板置于培养箱中孵育,每隔1 h 用酶标仪测定450 nm 处的OD 值,测量3次;最后根据实验数据,汇总分析并作图。其公式为细胞存活率=[(空白对照组OD值-实验组OD值)/对照组OD值]×100%。
2.3 克隆平板检测长期细胞增殖抑制率 取对数生长期细胞,PBS 清洗,0.25% 胰酶消化,用含10%血清的培养基中和后得到细胞悬液。细胞计数后,接种4 000个细胞于六孔板每孔中进行培养,需要反复吹打混匀,防止细胞抱团生长。待细胞贴壁后,将细胞分为4组,空白对照组(用不含青藤碱的1640处理)、0.5 mmol/L 青藤碱组、1.0 mmol/L 青藤碱组、2.0 mmol/L 青藤碱组,每组6个生物学重复,进行加药处理。各孔中青藤碱和RPMI-1640培养基总体积配足3.5 mL,放入无菌细胞培养箱继续培养。培养10~14 d 后终止培养,用PBS 漂洗细胞后,用4%多聚甲醛固定30 min,再用1%结晶紫染色30 min,最后使用PBS 清洗数遍后放入烘箱,烘干进行拍照处理并统计分析克隆形成数量。
2.4 Annexin V/PI 双染色检测细胞凋亡率 取对数期生长胆管癌细胞,PBS 清洗,0.25% 胰酶消化,用含10%血清的培养基中和后得到细胞悬液。显微镜下计数后按每孔接种5 ×104个胆管癌细胞均匀接种于六孔板中。后放入培养箱中培养,待细胞贴壁后,细胞分组同“2.3”项下。按照分组加入不同浓度的青藤碱,继续培养24 h 后,收集各组细胞。将六孔板内各孔上清液收集于15 mL 离心管,PBS 清洗后收集于15 mL 离心管内,再使用1.0 mL 不含EDTA 的胰蛋白酶消化细胞,2.0 mL含血清培养基中和后收集于15 mL 离心管,后再用PBS 清洗一遍六孔板,各收集于相应15 mL 离心管内,设置离心机1 200 r/min,离心5 min,弃上清。后加入3 mL PBS 于15 mL 离心管,转移细胞悬液于流式管内,继续离心,1 200 r/min,离心5 min,以清洗细胞。弃上清后,每管加入500 μL 1×Binding buffer、悬浮细胞数目为1 ×106/mL,再加入5 μL 的AnnexinV FITC 染液和10 μL PI 染色液,轻轻吹打均匀后,4 ℃避光孵育15 min,流式细胞仪上机检测,分析记录结果。
2.5 划痕实验检测细胞迁移能力 取对数期生长胆管癌细胞,PBS 清洗,0.25% 胰酶消化,用含10%血清的培养基中和后得到细胞悬液。显微镜下计数后按每孔接种2×106个胆管癌细胞均匀接种于六孔板中。后放入培养箱中培养,待细胞贴壁后,将细胞分为4组,分组情况同“2.3”项下,每组设置5个生物学重复。使用200 μL 无菌枪头在六孔板底部细胞层上划痕,力度和角度一致,使各条划痕粗细均匀。后用PBS 清洗两次将划痕脱落的细胞清洗干净,加入不含血清的RPMI 1640培养基后,使用倒置相差显微镜观察划痕的宽度并拍照,计算并记录0 h 划痕面积。后按照分组按照各组所设浓度加入青藤碱。放入培养箱进行培养24 h后,再次使用倒置相差显微镜拍照并计算划痕面积,最后根据实验数据计算细胞迁移率(%)。细胞迁移率=[(0 h 划痕面积-48 h 划痕面积)/0 h划痕面积]×100%。
2.6 Transwell 实验检测细胞侵袭能力 将Matrigel与RPMI-1640培养基按照1 ∶5的比例稀释后,取50 μL 均匀地涂覆到Transwell 上室的底部,将Transwell 小室放入24孔板中,室温通风过夜使之形成凝胶状。取对数期生长胆管癌细胞,PBS 清洗,0.25%胰酶消化,用无血清培养基中和后得到细胞悬液。显微镜下计数后按每孔接种2×104个胆管癌细胞均匀接种于上室中,使用无血清培养基配足200 μL 体积。下室加入660 μL 含10%FBS 的1640培养基后,放入培养箱进行培养。待细胞贴壁后进行分组,将细胞分为4组,分组情况同“2.3”项下,每组设置3个生物学副孔,按照分组情况进行加药处理,后继续放入培养箱进行培养。培养24 h后终止培养,用PBS 漂洗细胞后,用4%多聚甲醛固定30 min,再用1%结晶紫染色30 min,最后使用PBS 清洗数遍后放入烘箱,烘干进行拍照处理并计算穿膜细胞数。
2.7 Western blot 检测凋亡及侵袭相关蛋白表达取对数期生长胆管癌细胞,PBS 清洗,0.25%胰酶消化,用含10%血清的培养基中和后得到细胞悬液。显微镜计数后接种5×105个细胞于六孔板每孔内,放入培养箱进行培养。待细胞贴壁后,对细胞进行分组,分组情况同“2.3”项下,按照分组对细胞进行加药处理。药物处理24 h 后,收集细胞干粉。使用RIPA 裂解液在4 ℃环境下提取细胞总蛋白,使用BCA 蛋白测定浓度试剂盒测定蛋白浓度,按照蛋白上清液:5×Loading Buffer=4 ∶1的比例加入5×loading buffer,95 ℃煮10 min。取每孔泳道20 μg 蛋白样品进行SDS-PAGE 电泳,90 V,2 h。后恒流300 mA 电转2 h 转至PVDF 膜上,用5%脱脂牛奶室温封闭2 h,加入抗Cleaved caspase 3、Cleaved caspase 9、E-cadherin、Vimentin 等一抗于4 ℃摇床孵育过夜。TBST 洗膜3次15 min/次。加入二抗室温孵育2 h,TBST 再洗膜3次,15 min/次,最后使用ECL 发光液曝光显色,灰度值分析使用ImageJ 1.45 s 软件。
2.8 统计学分析 采用SPSS 22.0软件进行统计学分析处理。实验数据以()表示,多组间比较采用方差分析,2组间比较采用t检验。P<0.05差异有统计学意义。
3 结果
3.1 青藤碱抑制胆管癌细胞系HuCCT-1、TFK-1增殖 CCK-8实验结果显示,人类胆管癌细胞系HuCCT-1、TFK-1经过青藤碱处理后,2种胆管癌细胞生存率均明显降低,且随着药物浓度增大以及药物作用时间的延长,抑制作用逐渐加强,呈剂量和时间依赖性。除青藤碱0.125 mmol/L,24 h 这组外,与空白对照组比较,青藤碱能显著抑制HuCCT-1、TFK-1细胞存活率(P<0.05,P<0.01),见图1。此外,克隆平板表明青藤碱对于胆管癌细胞的长期增殖具有明显抑制作用,且抑制效果与药物浓度呈剂量依赖性(P<0.05,P<0.01),见图2。表明青藤碱可以抑制胆管癌细胞系HuCCT-1、TFK-1增殖。
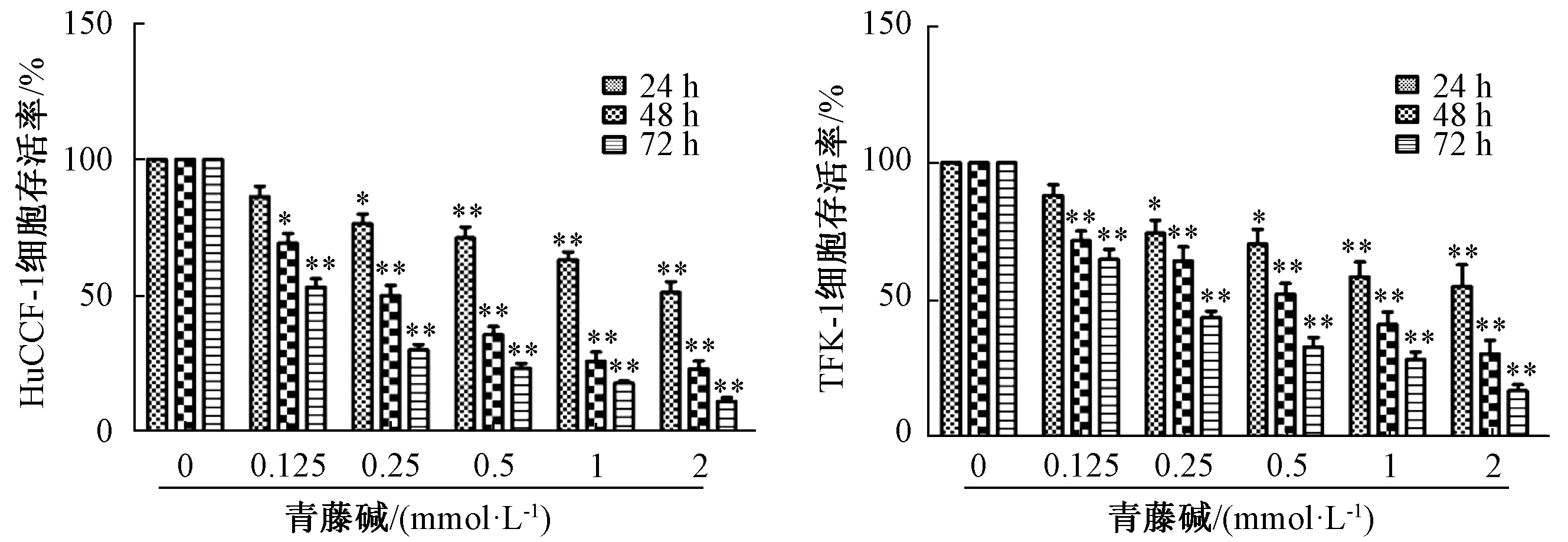
图1 不同浓度的青藤碱对胆管癌细胞存活率的影响Fig.1 Effects of different concentrations of sinomenine on celluar viability of cholangiocarcinoma

图2 不同浓度的青藤碱对胆管癌细胞长期增殖能力的影响Fig.2 Effects of different concentrations of sinomenine on long-term cellular proliferation of cholangiocarcinoma
3.2 青藤碱促进胆管癌细胞系HuCCT-1、TFK-1凋亡 流式细胞数表明,随着青藤碱药物浓度的提升,胆管癌细胞凋亡率明显增加,且呈剂量依赖性(P<0.01),见图3~4。与空白对照组比较,青藤碱显著促进凋亡关键蛋白 cleaved caspase-3、cleaved caspase-9蛋白表达,且呈剂量依赖性(P<0.05,P<0.01),见图5~6。表明青藤碱可以促进胆管癌细胞系HuCCT-1、TFK-1凋亡。
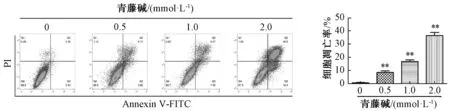
图3 不同浓度青藤碱对HuCCT-1细胞凋亡的影响Fig.3 Effects of different concentrations of sinomenine on apoptosis of HuCCT-1 cells
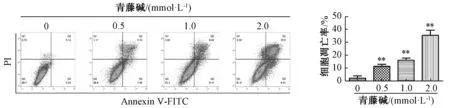
图4 不同浓度青藤碱对TFK-1细胞凋亡的影响Fig.4 Effects of different concentrations of sinomenine on apoptosis of TFK-1 cells
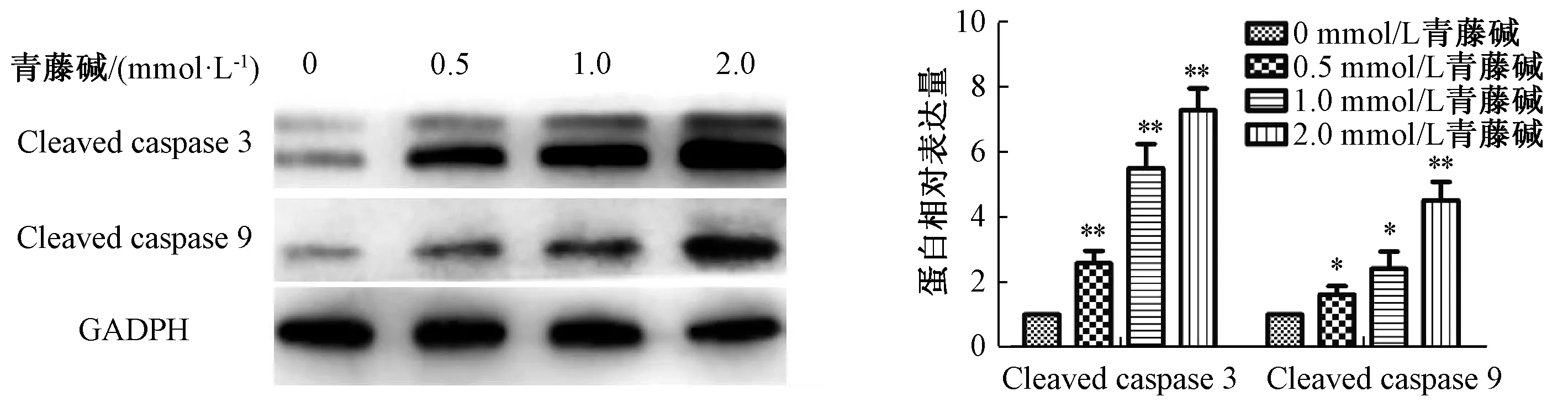
图5 不同浓度青藤碱对HuCCT-1 Cleaved caspase 3、Cleaved casepase 9蛋白表达的影响Fig.5 Effects of sinomenine at different concentrations on the expressions of cleaved caspase-3 and cleaved caspase-9 proteins in HuCCT-1 cells
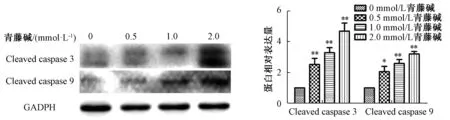
图6 不同浓度青藤碱对TFK-1 Cleaved caspase 3、Cleaved casepase 9蛋白表达的影响Fig.6 Effects of sinomenine at different concentrations on the expressions of cleaved caspase-3 and cleaved caspase-9 proteins in TFK-1 cells
3.3 青藤碱抑制胆管癌细胞系HuCCT-1、TFK-1侵袭迁移 Transwell 实验结果表明,随着青藤碱浓度的递增,胆管癌细胞穿过铺有Matrigel 胶小室的细胞数目也相应减少,胆管癌细胞的侵袭率逐渐下降,且结果呈剂量依赖性(P<0.05),见图7。划痕实验结果表明,与空白对照组比较,青藤碱组划痕宽度增宽,细胞迁移率显著下降,细胞迁移能力越来越慢,呈剂量依赖性(P<0.05),见图8。此外,上皮-间叶转化(EMT)为恶性肿瘤浸润的机制,E-cadherin、vimentin 为上皮间质转化标记物的表达,与空白对照组比较,青藤碱以剂量依赖的方式显著升高E-cadherin、且降低vimentin 蛋白表达(P<0.05),见图9~10。
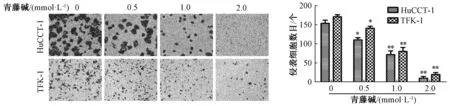
图7 不同浓度青藤碱对胆管癌侵袭能力的影响Fig.7 Effects of different concentrations of sinomenine on invasion ability of cholangiocarcinoma
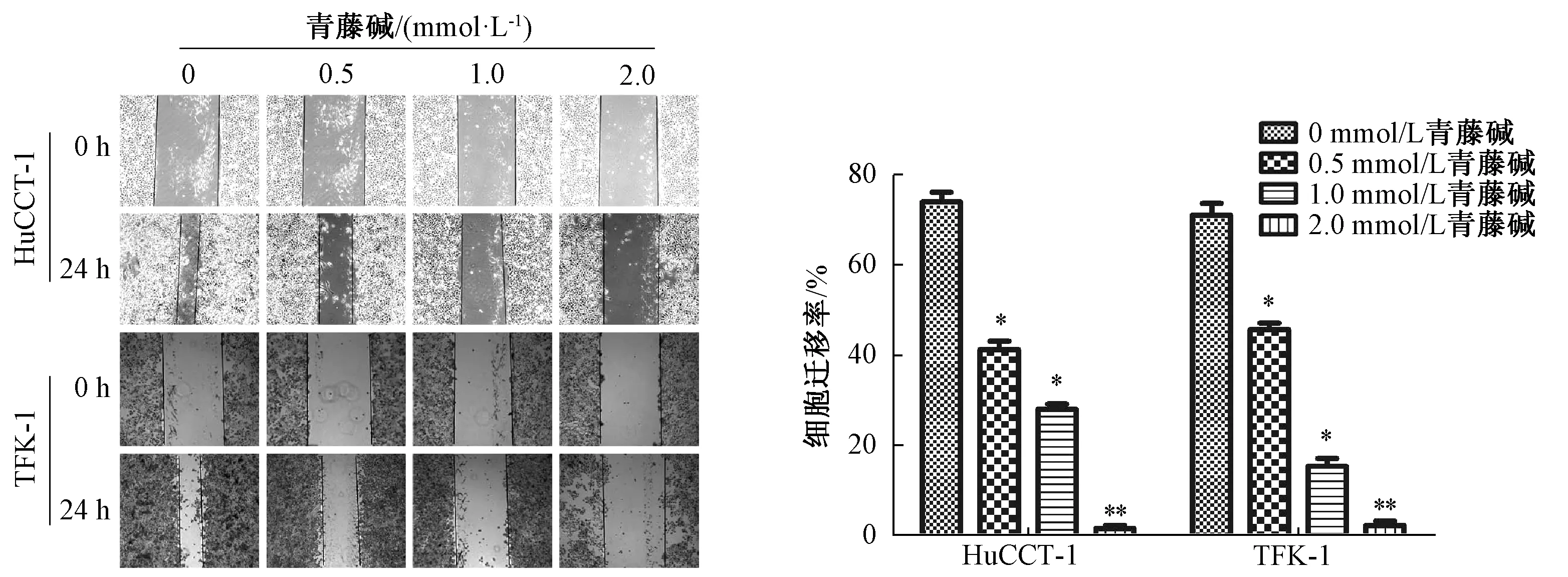
图8 不同浓度的青藤碱对胆管癌细胞迁移能力的影响Fig.8 Effects of sinomenine on invasion of cholangiocarcinoma

图9 不同浓度青藤碱对HuCCT-1 Vimentin、E-Cadherin 蛋白表达的影响Fig.9 Effects of sinomenine at different concentrations on the expressions of Vimentin and E-Cadherin proteins in HuCCT-1 cells
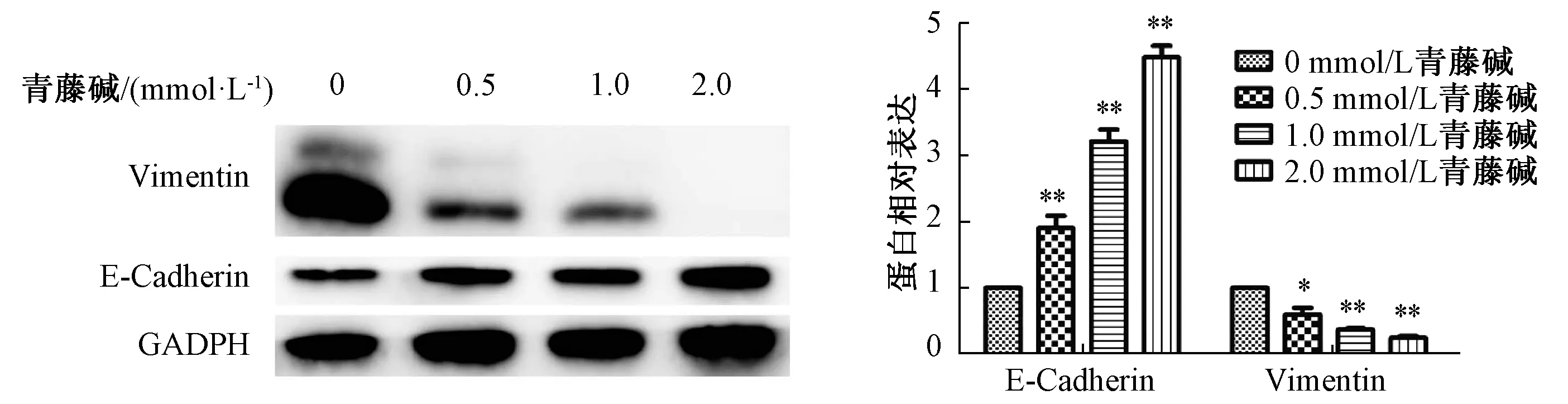
图10 不同浓度青藤碱对TFK-1 Vimentin、E-Cadherin 蛋白表达的影响Fig.10 Effects of sinomenine at different concentrations on the expressions of Vimentin and E-Cadherin proteins in TFK-1 cells
4 讨论
胆管癌早期诊断困难,是以高发病率和高死亡率为特征的肝胆肿瘤。目前针对胆管癌的治疗取得了很大进展,但是患者的5年生存率依旧很低[13]。现临床上应用的许多抗肿瘤药物不仅价格昂贵且不良反应较多[14]。因此,寻找一种新的、廉价的、不良反应较小的抗肿瘤药物,从而提高患者的生活质量是非常必要且紧要的。据报道,青藤碱可以在体内体外发挥良好的抗肿瘤作用,且不良反应较小[15]。本次实验,研究了青藤碱作用于胆管癌之后产生的抗肿瘤作用。
本实验以人类胆管癌细胞为研究对象,采用一系列体外实验研究青藤碱对胆管癌的抗肿瘤作用。CCK-8与克隆平板实验表明,青藤碱对胆管癌细胞的存活及增殖能力有明显的抑制作用,且成时间和剂量依赖性。Annexin V/PI 双染色法结果发现,青藤碱可以促进胆管癌细胞凋亡,且该凋亡作用呈剂量依赖性。Transwell 侵袭实验结果表明,胆管癌细胞的侵袭能力随着青藤碱浓度的升高逐渐降低。划痕实验结果表明,两株胆管癌细胞在相同的时间内的迁移距离明显受到青藤碱浓度的影响,2 mmol/L 浓度的青藤碱基本上使胆管癌细胞丧失迁移能力。
细胞凋亡,即细胞自主的有序的死亡。细胞凋亡在消除突变和恶性肿瘤细胞中发挥着重要作用[16]。已知多种中药可以通过诱导肿瘤细胞凋亡来达到抑制肿瘤生长的目的[17-19]。Annexin V/PI双染色法表明,青藤碱以剂量依赖性地促进胆管癌细胞凋亡。caspases 家族可以调节多种生物过程,包括细胞凋亡、分化、炎症等。其中caspase-3、caspase-9又归为促凋亡caspases。caspase-3如今视为细胞凋亡过程中最主要的终末剪切酶,而caspase-9被归类为凋亡效应者。活化的caspase-9(cleaved-caspase-9)可以进一步激活caspase-3,而活化的casepase-3(cleaved-caspase-3)的作用主要是催化多聚(ADP-核糖)聚合酶裂解,该酶与DNA 修复和基因完整性监护有关,从而诱导细胞凋亡的发生[20-21]。本实验结果表明,青藤碱可能通过促进胆管癌细胞凋亡以达到其抗肿瘤作用。
肿瘤转移全身往往是导致肿瘤患者死亡的主要原因。众所周知,EMT 在肿瘤转移方面起着决定性的作用,是肿瘤细胞侵袭和迁移的主要因素[22]。当细胞发生EMT 时,上皮标志物,如E-cadherin表达量下降;而间质标志物,如波形蛋白vimentin表达量上升[23]。本实验结果表明,青藤碱可能通过逆转胆管癌细胞EMT 来达到抑制胆管癌细胞侵袭和迁移的目的。
总而言之,青藤碱可以升高cleaved caspase 3、cleaved caspase 9和E-cadherin 以及降低vimentin 蛋白的表达水平,有效地抑制胆管癌细胞增殖,侵袭迁移并促进凋亡。研究表明青藤碱对胆管癌具有明显的抗肿瘤作用,可能为胆管癌的临床治疗提供新的视角。但是若要实现青藤碱的临床用药,还需更多的临床试验对青藤碱做出进一步研究。
