Krüppel样转录因子2的表达调控
2019-11-19荆堂堂胡俊秀倪晋泽穆靖洲赵玉菲
荆堂堂,胡俊秀,倪晋泽,穆靖洲,赵玉菲,朱 亮※
(1.大连医科大学基础医学院 a.生理教研室,b.中西医结合基础教研室,辽宁 大连 116044;2.复旦大学附属华山医院胸外科,上海 200040)
内皮可在循环血液与血管壁内层及周围组织之间形成界面。内皮的特殊位置结构导致内皮表型受到多种调控因素的影响[1-2]。层流剪切力可刺激内皮细胞产生血栓调节蛋白和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)等保护型分子物质,对内皮抗炎、抗血栓作用起保护作用。一些有害性刺激(如血液湍流、炎症因子、糖尿病患者体内增加的糖基化产物)均可导致内皮功能紊乱[3]。Krüppel样转录因子(Krüppel-like transcription factor,KLF)2参与调节血管张力、抗炎、抗血栓以及血管形成/血管新生等重要过程,对维持血管稳态至关重要[4]。阐明KL2的表达调控机制有助于临床器官保存以及心血管疾病的治疗。现对KLF2的表达调控机制予以综述。
1 概 述
1.1KLFs的特点 KLFs的特征与其他锌指蛋白类转录因子不同。KLFs的C端锌指结构为3个连续的Cys2/His2结构(两个半胱氨酸和两个组氨酸残基)分别螯合一个Zn2+组成,各锌指结构之间依靠7个氨基酸组成的空间序列 TGEKP(Y/F)X连接,其锌指结构可与DNA分子上的GT盒或CACCC序列结合发挥作用(图1)[5]。与DNA结合域的高度同源性不同,KLFs的非DNA结合域结构的同源性较少,其N端有共同的保守序列,称为转录激活/抑制区,KLFs各成员主要通过识别各自不同的转录激活区和转录抑制区,发挥不同的调控作用[6]。

Activation/Repression Domain:激活/抑制区;TGERP:7个氨基酸组成的空间序列
图1 KLF家族结构示意图
1.2KLF2的基本特性 自1993年发现EKLF/KLF1以来,共有17种KLF蛋白相继被发现,根据发现的先后顺序依次命名为KLF1~17,此外,根据各因子最早发现的组织或器官部位的不同,又分别有特殊的命名。KLF2编码区包括转录激活区和转录抑制区,共编码354个氨基酸,泛素连接酶1可与相应的转录抑制区结合,使KLF2发生降解和泛素化[7]。KLF2的表达在机体发育过程中不断变化,小鼠胚胎发育第7天,可以检测到KLF2的表达;第11天时,KLF2表达下降,而第15天时又迅速上升。
转录因子KLF2通过调节内皮生物活性发挥调节血管张力、抗炎、抗血栓、抗动脉粥样硬化等重要作用。有针对性的缺失位点分析显示,KLF2对调控T细胞成熟和维持T细胞静息状态至关重要,可在胸腺细胞和T细胞的增殖分化过程中发挥关键作用,是正常肺发育所必需的因子[8]。Zhong等[8]对KLF2基因敲除单侧肾切除小鼠模型的研究发现,模型小鼠肾小球滤过率降低、下游基因eNOS表达减少,且肾KLF2表达的减少与肾脏疾病发展相关。Liu等[9]对肝移植模型的研究发现,冷保存肝脏中KLF2及下游血管保护性因子的表达下调。
1.3应力转导和KLF2表达 应力转导指将细胞受到的摩擦力、压力、牵引力、重力和剪切力等刺激的机械能转化为电信号或生物化学信号,并最终引起细胞生理反应的过程[10]。目前,关于应力转导的具体机制尚未完全明确,但应力转导组件多定位于胞膜或胞质,激活细胞的多种级联信号反应,即最终的细胞反应是基于作用于细胞表面的机械刺激而发生。机械力通过细胞-细胞和细胞-基质连接组成的多蛋白复合-微管骨架的三维变化作用于内皮细胞表面,并将机械信号进一步转导到细胞[11]。
内皮细胞应力转导过程可分为两个阶段:第一阶段为纤毛弯曲引起细胞内钙的增加和一氧化氮、内皮素等血管活性物质的释放;第二阶段为细胞骨架的改变,首先引起KLF2等基因表达的改变,然后调节内皮细胞适应动态机械力的变化。KLF2是首个被报道的可受流体调控的内皮细胞转录因子[11-12]。Dekker等[12]发现,与静置培养相比,人脐静脉内皮细胞置于层流血流剪切力24 h(2.5 N/m2)后,KLF2基因的表达量增加5倍。
2 KLF2的表达调控机制
人类KLF2定位于染色体的10p13.1,与小鼠KLF2基因的同源性大于85%[13]。位点分析显示,KLF2转录起始点上游含有一段长约75 bp的高度保守序列,包含肌细胞增强因子2(myocyte enhancing factor 2,MEF2)的结合部位[14]。当血流正常时,MEF2可在剪切力的作用下与KLF2启动子上MEF2的结合位点结合,激活KLF2表达通路,使KLF2信使RNA(messenger RNA,mRNA)和蛋白水平的表达增加[15]。血流剪切力不仅可在转录水平激活KLF2启动子诱导KLF2表达,还可使KLF2 mRNA水平保持稳定[16]。MEF2与KLF2相应位点的结合受血流影响不大,但MEF2的转录激活受其上游胞外信号调节激酶(extracellular signal-regulated kinase,ERK)5的调节,此外,促分裂原活化的蛋白激酶激酶5(mitogen-activated protein kinase kinase 5,MEK5)可上调ERK5[17]。另有研究发现,促AMP活化的蛋白激酶可激活MEF2,由于促AMP活化的蛋白激酶处于MEK5/ERK5/MEF2的上游,故其活化对剪切应力诱导的ERK5和MEF2磷酸化至关重要,见图2[18]。
3 调控KLF2表达的因素
由于血管内皮处在循环血液与血管壁之间的特殊位置结构,内皮表型除受到上述主要血流剪切力的生物力学影响外,还受一些体内内源性物质和化学药物的影响,如他汀类药物、白藜芦醇、多巴胺、雷帕霉素等刺激性因素和炎症因子、高血糖等抑制因素[1-2]。利用KLF2的某一调控因素可间接增加或减少KLF2的表达,从而达到治疗疾病的目的,为临床疾病治疗提供新的方案。
3.1调控KLF2表达的刺激因素
3.1.1组蛋白去乙酰化酶(histone deacetylase,HDAC)5 在静态或血流中断条件下,HDAC5可与KLF2启动子上的MEF2结合,抑制MEF2的转录活性。当血流剪切力(12 dyne/cm2)存在时,可通过激活钙离子/钙调蛋白依赖的蛋白激酶信号通路,使HDAC5发生磷酸化,HDAC5的细胞定位由细胞核到细胞质,解除对KLF2的抑制,促使KLF2转录[19],见图2。湍流剪切应力促进 Ⅰ 类和 Ⅱ 类HDAC(HDAC3、HDAC5、HDAC7)的表达,通过磷脂酰肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)/蛋白激酶B信号通路与MEF2结合,使KLF2表达下调,而层流切应力诱导磷酸化依赖的Ⅱ类HDAC(HDAC5、HDAC7)出核,诱导KLF2的表达[20]。
3.1.2硫氧还蛋白互作蛋白 在层流剪切力作用下,内皮硫氧还蛋白互作蛋白的表达下调,硫氧还蛋白活性增加,从而诱导KLF2的表达,抑制炎症反应[21]。相反,血流中断时,硫氧还蛋白互作蛋白的表达上调,通过促进白细胞黏附和降低KLF2表达促进炎症反应。Wang等[22]通过荧光素酶和染色质免疫沉淀实验发现,硫氧还蛋白互作蛋白可与KLF2启动子的-157~-78 bp区域结合,形成转录抑制复合物的一部分,抑制KLF2表达。
3.1.3他汀类药物 他汀类药物是临床广泛应用的降脂药物,一些他汀类药物可以剂量依赖方式诱导 KLF2表达[23]。他汀类药物诱导KLF2表达的机制为:他汀类药物通过抑制RhoA蛋白的关键基团——牛儿基焦磷酸基团的补充解除RhoA蛋白对MEK5/ERK5/MEF2通路的抑制效应,诱导KLF2的表达,见图2。有证据表明,临床上可通过上调KLF2达到他汀类药物的治疗效果,可在冷保存液中添加辛伐他汀,以维持移植肝脏等移植物中KLF2表达,减少内皮细胞的损伤[8]。
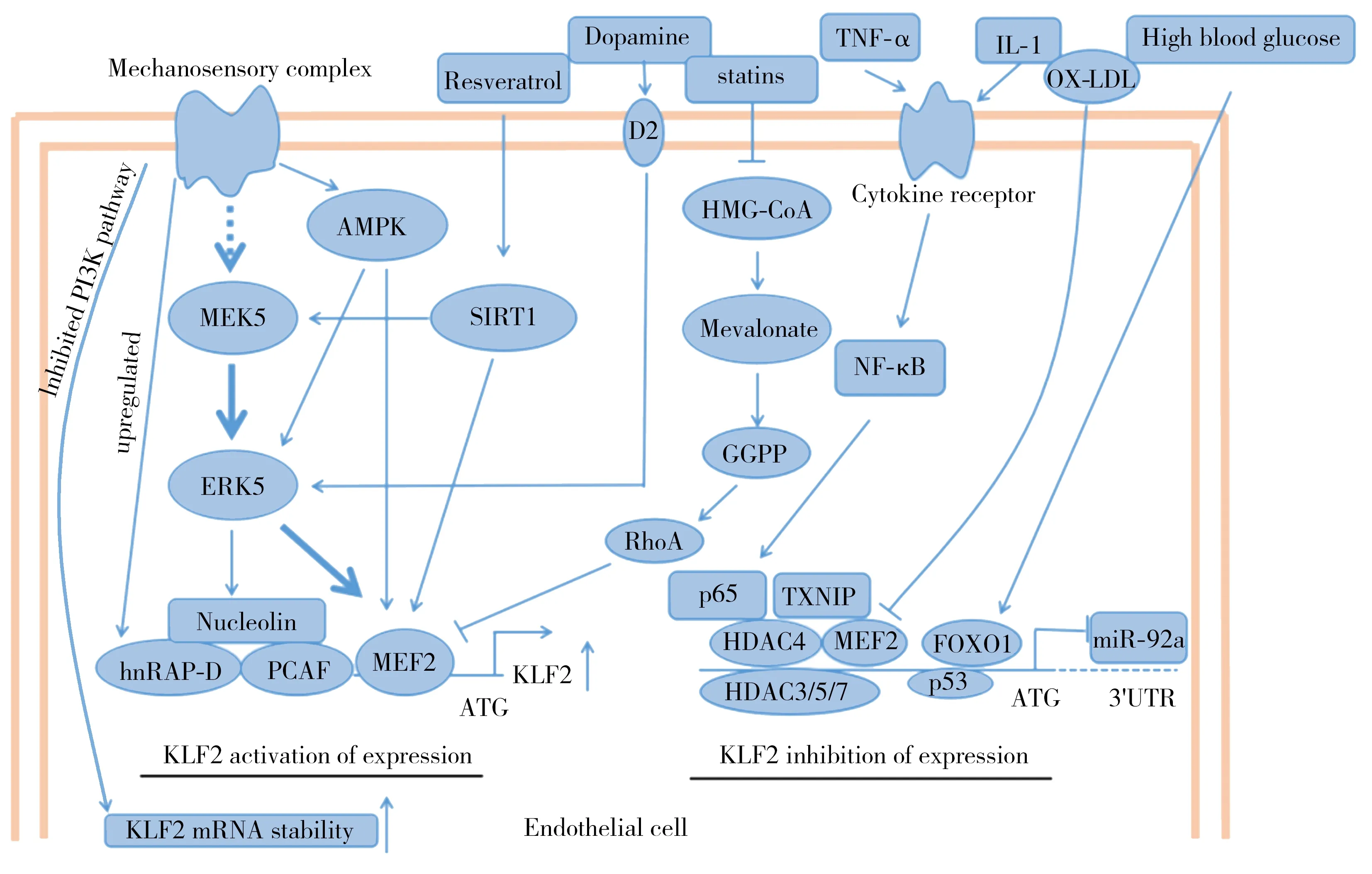
KLF2:Krüppel样转录因子2;Mechanosensory complex:机械感受器复合体;Inhibited PI3K pathway:抑制磷脂酰肌醇-3-激酶通路;upregulated:上调;AMPK:AMP活化的蛋白激酶;MEK5:促分裂原活化的蛋白激酶激酶5;ERK5:胞外信号调节激酶5;Nucleolin:核仁素;hnRAP-D:异质核蛋白D;PCAF:P300/CBP相关因子;MEF2:肌细胞增强因子2;KLF2 activation of expression:促进KLF2表达;KLF2 mRNA stability:稳定KLF2的信使RNA;ATG:起始密码;Resveratrol:白藜芦醇;SIRT1:乙酰化酶1;Dopamine:多巴胺;D2:多巴胺受体;statins:他汀类药物;HMG-CoA:3-羟基-3-甲基戊二酰辅酶A还原酶;Mevalonate:甲羟戊酸;GGPP:牛儿基焦磷酸基团;RhoA:Ras同源基因家族成员;TNF-α:肿瘤坏死因子-α;IL-1:白细胞介素-1;Cytokine receptor:细胞因子受体;NF-κB:核因子κB(由p50和p65基团组成的核因子);p65:核因子NF-κB的组成基团;TXNIP:硫氧还蛋白互作蛋白;HDAC:组蛋白去乙酰化酶;OX-LDL:氧化型低密度脂蛋白;High blood glucose:高血糖;FoxO1:叉头框蛋白O1;miR-92a:微RNA-92a;p53:一种抑癌基因;KLF2 inhibition of expression:抑制KLF2表达;3′-UTR:3′非翻译区;Endothelial cell:内皮细胞
图2 KLF2的表达调控
3.1.4白藜芦醇 白藜芦醇是一些植物和红酒中含有的一种多酚成分,是KLF2的有效诱导剂。Gracia-Sancho等[24]研究表明,白藜芦醇首先激活去乙酰化酶1,然后通过去乙酰化酶1激活下游MEK5和MEF2,促使KLF2表达上调,见图2。白藜芦醇通过上调KLF2的表达和抑制细胞间黏附分子-1和单核细胞趋化蛋白-1的表达,抑制肿瘤坏死因子-α诱导的炎症损伤,间接保护内皮细胞[25]。
3.1.5多巴胺 结构和功能异常的肿瘤血管缺乏交感神经支配和多巴胺调节。Chakroborty等[26]研究表明,外源性多巴胺可通过与D2受体结合纠正异常肿瘤血管形态,改善血流并降低肿瘤缺氧。多巴胺主要通过增加ERK5表达增加KLF2表达,提高肿瘤中血管生成素-1的表达,从而发挥改善肿瘤缺氧的作用,见图2。研究表明,多巴胺可促进肿瘤血管内皮细胞中KLF2的表达,通过上调KLF2信号通路调节肿瘤血管内稳态,提高抗肿瘤药物5-氟尿嘧啶的治疗效果,发挥抗肿瘤作用[27]。
3.1.6雷帕霉素 雷帕霉素是从冠状动脉支架中洗脱以减少再狭窄的药物之一,其对内皮细胞的作用较复杂,可能通过增加内皮细胞中KLF2的表达抑制血栓形成[28]。研究认为,KLF2可能作用于PI3K/蛋白激酶B/哺乳动物雷帕霉素靶蛋白通路的下游靶点,雷帕霉素通过抑制哺乳动物雷帕霉素靶蛋白抑制PI3K/蛋白激酶B/哺乳动物雷帕霉素靶蛋白通路并利用ly2940002特异性抑制PI3K稳定KLF2的mRNA水平[29],见图2。
3.1.7其他因素 其他参与剪应力诱导KLF2表达的辅助因子包括p300/CBP-相关因子,核内不均一核糖核蛋白D、核仁素等。Che[30]的研究表明,p300/CBP-相关因子和核内不均一核糖核蛋白D通过与KLF2启动子-157~-95 bp区域长约30 bp的剪切力诱导区结合形成复合物,促进PI3K依赖途径的组蛋白H3和H4乙酰化诱导KLF2启动子染色质重塑,促使KLF2表达。
3.2调控KLF2表达的抑制因素
3.2.1微RNA(microRNA,miRNA) miRNA是一类分子量为18~24 bp的具有调控功能的非编码RNA,可结合到目标mRNA的3′非翻译区,通过翻译抑制或mRNA降解在转录后水平调节基因表达[31]。敲除HUVECs合成miRNA途径的关键组件发现,KLF2表达增加,表明miRNA可在血流依赖性调节KLF2表达过程中发挥重要作用。KLF2的3′非翻译区包含1个miR-92a的结合位点,表明层流可下调miR-92a,并诱导KLF2的表达[32]。
3.2.2炎症因子 某些炎症因子可抑制KLF2表达。人脐静脉内皮细胞暴露于白细胞介素-1时,KLF2的表达明显降低,此外,肿瘤坏死因子-α也有类似作用[33]。肿瘤坏死因子-α通过核因子κB抑制KLF2表达,但不依赖于核因子κB与KLF2启动子的直接结合。Kumar等[14]的研究表明,核因子κB的p65亚单位与HDAC4结合后,可与KLF2启动子结合,对MEF2介导的KLF2表达起抑制作用,见图2。
3.2.3低密度脂蛋白 低密度脂蛋白通过DNA和组蛋白的甲基化抑制内皮KLF2表达。低密度脂蛋白下调KLF2的表达,导致内皮功能失调,使血管内皮处于高凝状态[34]。Kumar等[35]的研究表明,低密度脂蛋白导致血管内皮处于高凝状态的机制为低密度脂蛋白经过DNA甲基转移酶1诱导CpG二核苷酸甲基化,甲基化CpG岛使MEF2与KLF2启动序列的结合发生障碍,促进由甲基化CpG结合蛋白2和组蛋白甲基转移酶组成的转录抑制复合物的组装,从而抑制KLF2的表达,见图2。
3.2.4高血糖 高血糖(血浆葡萄糖≥35 mmol/L)可抑制人脐静脉内皮细胞和糖尿病大鼠颈总动脉中KLF2和eNOS的表达,由叉头框蛋白O1(forkhead box protein O1,FoxO1)直接与KLF2启动子结合介导(图2),可能是糖尿病患者内皮功能障碍的机制之一[36]。Lee等[37]通过染色质免疫沉淀分析实验发现,阿托伐他汀可抑制FoxO1对KLF2和eNOS的负调控,恢复高糖培养条件下内皮细胞KLF2和eNOS的表达。可见,阿托伐他汀可使FoxO1磷酸化,磷酸化的FoxO1从细胞核转移到细胞质,转移到细胞质具有活性的FoxO1可完全阻止阿托伐他汀对KLF2的诱导(图2)。
3.2.5衔接蛋白p66shc 衔接蛋白p66shc具有促进细胞氧化、细胞凋亡的作用,可导致动脉粥样硬化。KLF2是调控eNOS和抗氧化酶表达的正性调节因子,与内皮细胞中衔接蛋白p66shc的表达呈负相关。Kumar等[38]的研究表明,衔接蛋白p66shc可下调MEF2A表达,导致KLF2和血栓调节蛋白的表达降低;敲除衔接蛋白p66shc后,KLF2和血栓调节蛋白的表达增加,且过氧化氢水平下降。
3.2.6p53 p53是一种抑癌基因,对调节细胞周期、DNA修复和凋亡等起重要作用。Kumar等[39]研究表明,p53可通过与KLF2启动序列上对应的p53结合区(图2)结合、动员HDAC、促进组蛋白H3乙酰化抑制KLF2的表达。KLF2在调节血管功能(包括脑屏障通透性)方面起重要作用。β淀粉样蛋白1~42诱导的KLF2表达的减少由p53介导,阿尔茨海默病患者体内β淀粉样蛋白1~42的表达累积可抑制KLF2的表达[40]。
4 小 结
多种调控机制对KLF2表达具有调节作用,血流依赖性转录因子KLF2的调控机制是临床心血管疾病研究的重点。动脉粥样硬化、糖尿病和脑卒中等心血管疾病中KLF2的表达降低,利用KLF2的调控机制增加KLF2表达有利于心血管疾病的治疗[41]。研究KLF2表达机制与血管内皮之间的关系对探索新的心血管疾病或癌症治疗方法以及器官保存液的配置和器官保存方法的新思路具有重要意义。根据KLF2的表达机制,通过调节KLF2的表达或功能将为一系列人类疾病治疗提供新的治疗策略。
