机械通气对猪腹腔间隔综合征后心脏继发改变的影响
2019-11-18王宏业尉继伟
王宏业 尉继伟
腹腔间隔室综合征(abdominal compartment syndrome,ACS)有病情发展快、临床病死率高等特点,是目前临床研究的热点问题之一[1-5]。心脏功能衰竭可能是导致ACS患者死亡的直接原因,但相关的病理机理尚不明确。机械通气可加重患者的腹腔高压[6],从而进一步加重心脏功能恶化。而机械通气下腹腔高压对临床ACS患者心脏损伤的影响尚未见报道。笔者制作机械通气腹腔高压液体动物(猪)模型,观察实验猪心肌酶谱和心脏病理改变,探索机械通气下腹腔高压对ACS心脏造成的继发损伤,以指导临床治疗。
材料和方法
一、材料
(一)实验动物
健康成年实验猪10头,体质量18.2~25.6 kg,平均体质量(21.40±1.72)kg,雌雄不限,由山西大同大学实验动物中心提供,动物合格证号[SCXK(2015-0002)]。
(二)主要实验器械
麻醉机(上海德尔格医疗器械有限公司),全自动生化分析仪(日本株式会社日立高新技术),安全套(青岛双碟集团股份有限公司),引流袋(山东威高集团医用高分子制品股份有限公司)。
(三)主要试剂
生化检验试剂:生产许可证编号:京食药监械生产需20022023号,注册证编号:京械注准20162400540,北京九强生物技术有限公司。
二、方法
(一)水囊的制作和选择
1.常规水囊的制作:普通安全套消毒后注入250 mL生理盐水封口。
2.加压水囊的制作:使用1 000 mL引流袋作为加压水囊。
(二)腹腔高压液体动物模型制作
将10头实验猪按随机数字表法分为两组:实验组6头,对照组4头。实验组采用水囊叠加加压法制作腹腔高压液体动物模型[7],术后通过加压水囊引流管注液加压。对照组在手术置入空瘪的加压水囊后即关腹,且不注液加压。术后两组分别在全身麻醉下行机械通气,直至实验动物被处死。
1.麻醉与机械通气:将实验猪称重后仰卧位置于手术台,经耳缘静脉穿刺置入22-0号号静脉穿刺导管后固定,先予丙泊酚3~5 mg·kg-1和维库溴铵0.4 mg·kg-1行麻醉诱导,再以丙泊酚12 mg·kg-1·h-1和维库溴铵0.4 mg·kg-1·h-1静脉泵注维持麻醉。经口气管插管后接呼吸机辅助呼吸:容量控制通气(volume controlled ventilation,VCV)模式,潮气量10 mL·kg-1,呼吸频率16次/min,吸入氧浓度(FiO2)40%,呼气末正压(positive end expiratory pressure,PEEP)5 cmH2O(1 cmH2O=0.098 kPa)。
2.手术方法:将实验猪仰卧位固定于操作台,沿腹中线作一长8.0~10.0 cm的纵向切口,预置全层缝合切口的缝线8~10根。沿切口首先置入空瘪的加压水囊,加压水囊的加压管通过切口置于腹外,然后在确保可无张力关腹的情况下置入最大数量的常规水囊(本组均为8个)后,切口预置缝线打结关腹。
3.腹腔高压模拟:经过加压管向加压水囊中注入0.9%氯化钠注射液,每注入50 mL,测压1次,直至腹腔压力达到30 mmHg(1 mmHg=0.133 kPa),之后通过调整液量达到动物模型所需的压力(25 mmHg)。注液时维持注液速度均匀,时间约为20~30 min。注液温度维持在30℃~35 ℃,以排除注液温度对实验动物的影响。
4.测压方法:取1 m普通T形塑料尺,长臂垂直位固定于床边,0 cm刻度在下,100 cm刻度在上,将输液器由输入端到穿刺端由上到下拉直,固定在T形尺上,前端通过三通管和加压水囊的引流管相连,测压管内稳定液平的高度与实验猪的腋中线高度差即为腹腔压力[8]。
三、观察指标
(一)腹腔压力-增容量曲线
通过加压水囊引流管向加压水囊内注入0.9%氯化钠注射液,每50 mL测压一次,根据每个实验动物的每次测压结果取算数平均值,绘制与注液体积相对应的腹腔压力-增容量曲线。
(二)心肌酶谱
在动物模型建立前由实验猪的耳缘静脉置入静脉穿刺导管1根,建模成功后调整两组腹腔压力维持在25 mmHg,分别于模型制作前和压力维持后的1,2,3,4 h各抽取静脉血5 mL,共计5次,行心肌酶谱[乳酸脱氢酶(lactate dehydrogenase,LDH)、α-羟基丁酸脱氢酶α-hydroxybutyrate dehydrogenase,α-HBDH]、 肌酸激酶同工酶(creatine kinase isoenzymes,CK-MB)]检查。观察两组心肌酶谱的差异。
(三)心脏病理改变
建模后4 h后使用过量丙泊酚静脉推注处死两组实验猪,即刻完整切取心脏,置于10%甲醛溶液中固定24 h后常规石蜡包埋、冠状面连续切片,切片厚度为4 μm。经苏木精-伊红(hematoxylin-eosin,HE)染色后在生物光学显微镜下观察病理改变,放大倍数200倍。
四、统计学分析
采用SPSS 16.0软件进行统计学分析,计量资料以Mean±SD表示,采用两独立样本t检验;采用简单线性回归分析腹腔内压与腹腔容量增加的相关性。P<0.05为差异有统计学意义。
结 果
一、腹腔压力-增容量变化曲线
实验组6头猪成功复制腹腔液体高压模型,且在实验全过程中无1例发生气压伤和死亡。腹腔高压液体(猪)动物模型腹腔压力-增容量曲线为线性函数关系,腹腔内压与腹腔容量增加呈正相关,函数方程:Y=0.1074X-206.045(r2=0.8396,P<0.05)。见图1。
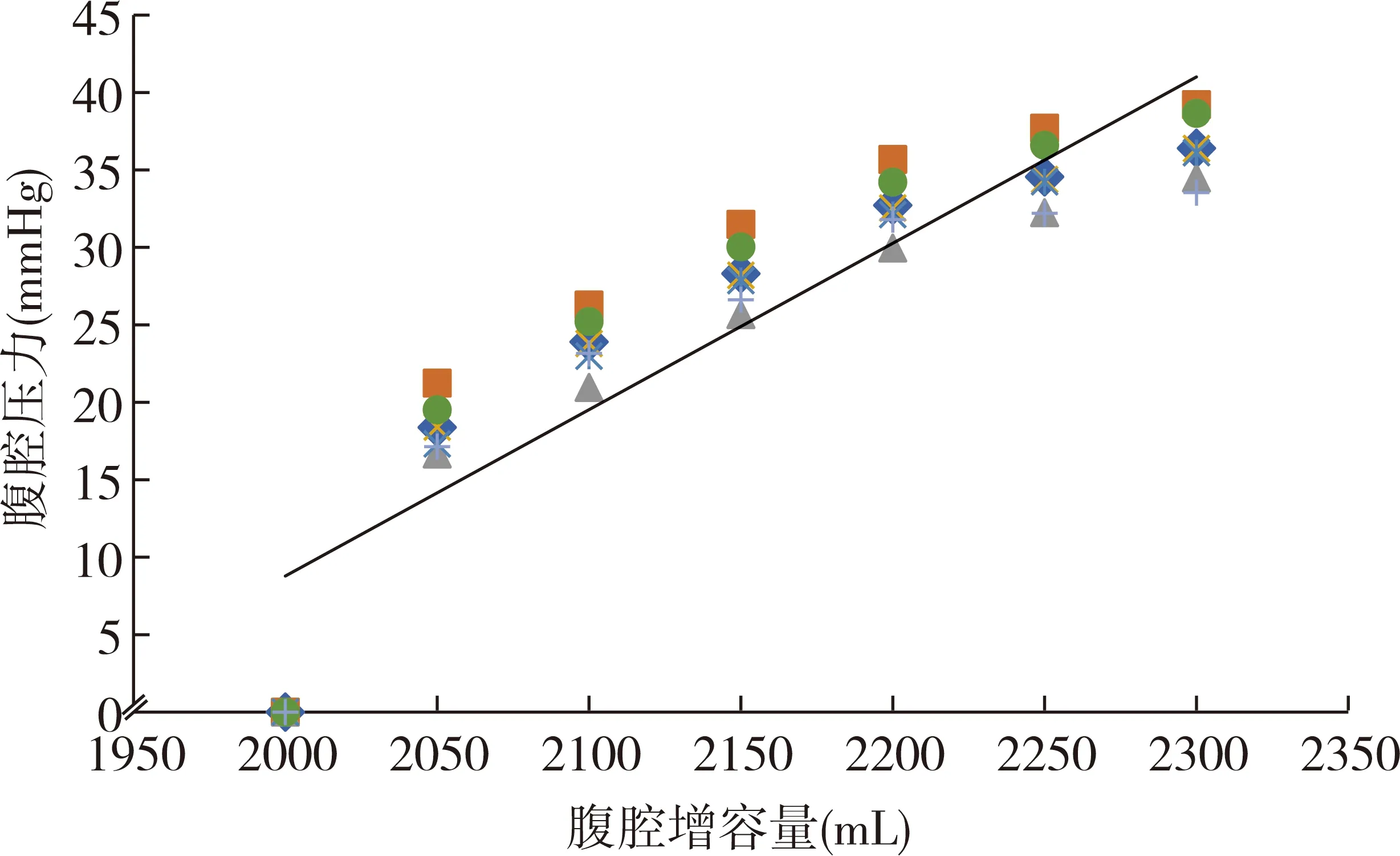
图1 机械通气腹腔高压液体动物(猪)模型腹腔压力-增容量曲线
二、心肌酶谱变化
实验组动物模型(n=6)在术前及术后1,2,3,4 h心肌酶谱变化情况见表1。
三、心脏病理改变
对照组(图2a):心肌纤维呈短圆柱状,有分支,互相连接成网;可见闰盘及横纹;心肌纤维的细胞核呈卵圆形,位居中央;肌质丰富,居于核的两端处;可见心肌纤维横纹,但不明显。实验组(图2b):心肌纤维呈嗜酸性变,心肌纤维部分萎缩,部分肥大,局部可见玻璃样变性,横纹消失,可见细胞核聚集。

图2 机械通气改良腹腔高压液体动物(猪)模型的心脏病理改变(HE染色,×200)
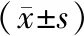
表1 机械通气改良腹腔高压液体动物(猪)模型的心肌酶谱变化一览表
注:LDH为乳酸脱氢酶,α-HBDH为a-羟丁酸脱氢酶,CK-MB肌酸激酶同工酶
讨 论
ACS可引起心、肺、肾等多脏器的功能不全,临床表现为心率增快、呼吸困难、难以纠正的低氧血症和利尿剂无效的少尿。升高的腹腔压力可通过腹-胸相互作用使胸腔压力升高[9]、循环血量下降[10]以及细胞因子的大量释放[11],继而引起心脏继发损伤。机械通气在有效维持呼吸功能、减少腹腔压力对胸腔器官的损伤,对心脏和肺脏起到一定程度保护作用的同时[2],也限制了膈肌的运动范围,导致腹腔内压力上升的代偿空间被压缩,使ACS的发病压力阈值下调。2006年,国际腹腔间隔综合征委员会(World Society of the Abdominal Compartment Syndrome,WSACS)指出,高PEEP是腹腔压力升高的独立危险因素[13],更易导致ACS的发生。目前研究认为,腹腔高压动物模型的压力-容积曲线为一条腹腔压力随容积增加而逐渐增加的指数函数[14],腹腔压力与容积呈正相关关系。本研究中,猪腹腔压力-增容量曲线为线性函数,腹腔压力与腹腔增容量呈正相关,但与既往报道的曲线走行完全不同。而产生这种改变的原因则考虑与机械通气直接相关:机械通气与腹腔向胸腔传导的压力形成对抗,而且随着腹腔压力的上升,这种对抗也在同步增强,致使腹腔压力随容量增加而缓慢升高,而非既往报道的快速指数升高,造成了腹腔压力-容积曲线走向的改变。这也是机械通气能在一定程度上减轻胸腹腔脏器损害的可能原因。
心脏在出现损伤的情况下可表现为心肌酶谱的异常,测定心肌酶谱对诊断心脏的损伤程度有一定的参考价值[15]。本研究中,与建模前相比较,在建模后1 h,实验组的LDH、CK-MB、α-HBDH均出现升高(P<0.05),并在建模后2~4 h恢复正常,提示在制作机械通气腹腔高压液体动物模型的过程中,ACS发生的前1 h内对心脏造成的损伤较强,随后由于适应性代偿,心肌酶谱又逐渐恢复到正常水平。心肌病理检查结果证实:在机械通气下,ACS的发生发展伴随着心肌细胞的损伤,表现为心肌纤维嗜酸性变,心肌纤维部分萎缩,部分肥大,横纹消失,局部可见玻璃样变性,可见细胞核聚集等。
总之,在机械通气下,ACS的发展伴随明显的心肌细胞损伤和心肌酶谱改变。机械通气在维持肺通气功能的同时,可向下压迫膈肌,从而与腹腔高压形成对抗,在一定程度上减轻了腹腔高压对胸腔的压力传导[16],但对心脏的保护作用需要进行进一步的研究。
