外源NAA对甜瓜嫁接愈合关键期保护性酶活性及相关基因表达的影响
2019-11-17张颖刘义玲汤雨凡许传强
张颖 刘义玲 汤雨凡 许传强

摘 要:通過分析外源施用植物激素NAA(萘乙酸)条件下甜瓜嫁接愈合3个关键时期(隔离层形成期、愈伤组织形成期、维管束桥形成期)保护性酶活性及相关基因表达的变化,探析外源施用NAA对甜瓜愈合过程中生理及其基因表达特性的影响。以蘸取清水的嫁接苗为对照,外源施用40 mg·L-1 NAA的嫁接苗为处理,薄皮甜瓜‘银泉一号为接穗,白籽南瓜‘圣砧一号为砧木,采用顶端贴接法嫁接。利用石蜡切片筛选嫁接愈合关键时期,测定嫁接愈合过程中4种关键代谢酶(SOD、POD、PPO和PAL)活性,并利用实时荧光定量(qRT-PCR)测定其相关基因表达量。通过石蜡切片观察发现,外源NAA处理后,愈伤组织形成期和维管束桥形成期较对照提前1 d。SOD、POD酶活性呈先升高后降低的趋势,在愈伤组织形成期达到最高值,且酶活性显著高于对照,PAL酶活性在愈合过程中均高于对照,且在维管束桥形成时期达到最高值。PPO酶活性在隔离层形成期显著高于对照,随后其活性略低于对照,但差异不显著。除CmPOD外,外源NAA处理能够显著提高CmFe-SOD、CmCu-Zn-SOD、CmMn-SOD、CmPPO相对表达量,且其变化趋势与酶活性基本一致。综合分析表明,外源施用NAA后,缩短了甜瓜嫁接苗的愈合期,并且能够诱导影响嫁接愈合的关键酶基因表达,提高其相关酶活性,进而促进甜瓜嫁接苗的愈合进程。
关键字:甜瓜;嫁接愈合;NAA;保护性酶;基因表达
Effects of exogenous NAA on the protective enzymes activities and related genes expression at the key stages of melon graft healing
ZHANG Ying1,LIU Yiling1,TANG Yufan2,XU Chuanqiang1
(1. Key Laboratory of Protected Horticulture(Shenyang Agricultural University),Ministry of Education / National & Local Joint Engineering Research Center of Northern Horticultural Facilities Design & Application Technology (Liaoning) / College of Horticulture, Shenyang Agricultural University, Shenyang 110866, Liaoning, China:2. College of Horticulture,Jilin Agricultural University,Changchun 130118, Jilin, China)
Abstract: The protective enzyme activities and related gene expression were analyzed to investigate the effects of exogenous NAA (naphthalene acetic acid) application on the physiological and related genes expression characteristics at three key stages of melon graft healing process (isolated layer formation, callus formation, vascular bundle formation). In this experiment, the grafted seedlings that graft union dipped 40 mg×L-1 NAA were used as the treatment, and those dipped water were used as the control. We used the oriental melon ‘Yinquan No. 1 as the scion, and the white-seed pumpkin 'Shengzhen No.1' as the rootstock. Splice approach grafting was used as the grafting method. The paraffin sections screened out the key stages of graft healing process. The activities of four key metabolic enzymes (SOD, POD, PPO and PAL) during graft healing were determined, and the expression of related genes was determined by real-time quantitative quantification (qRT-PCR). It was observed by paraffin sections that the formation of the callus and vascular bundle were 1 day earlier than the control by exogenous NAA treatment. The activities of SOD and POD increased first and then decreased, reached the highest value at the stage of callus formation, and the enzyme activities were significantly higher than that of control. The activities of PAL were higher than that of control and reached the highest value at the formation of vascular bundle. The activities of PPO were significantly higher than that of control at the formation of the isolated layer and indistinctively lower than the control with the grafting seedlings growth. Exogenous NAA treatment significantly increased the relative expression of CmFe-SOD, CmCu-Zn-SOD, CmMn-SOD and CmPPO except CmPOD , and the trend of changes is basically consistent with the enzyme activities changes. The comprehensive analysis showed that the exogenous NAA application shortened the time of grafted healing, induced the expression of key enzyme genes that involved in graft union and increased the related enzyme activities, which promoted the graft healing process of grafting melon seedlings.
Key words: Melon; Graft healing; Naphthalene acetic acid; Protective enzyme; Gene expression
甜瓜(Cucumis melo L.)属于葫芦科(Cucurbitaceae)甜瓜属(Cucumis)一年生蔓性草本植物,在世界园艺生产中一直占有重要地位,具有很高的经济价值[1]。但在甜瓜生产中出现的土传病害和连作障碍严重等问题已成为制约甜瓜产业健康发展的主要原因。由于轮作困难、药剂防效不理想且易污染环境、抗病育种周期长等方法的局限,甜瓜嫁接技术已成为生产中防治土传病害和连作障碍的有效方法之一。此外,嫁接可通过切断和重连来自不同植物物种或品种的维管束来应对非生物和生物胁迫的抗性,提高植株抗逆性和抗病性,改变植株的发育进程等,从而使其增产、提高果实品质或改变植株大小[2-4]。
嫁接愈合是植物的器官、组织或细胞相互影响、相互作用结合成一个有机整体的过程。尽管嫁接愈合过程所分的阶段及所需时间因不同品种、年龄、嫁接方法及嫁接时间等的不同而有差异,但砧穗间所发生的愈合过程却基本相同。大致分为3个过程:接穗和砧木间的组织黏连及隔离层的形成;愈伤组织的形成;接穗和砧木间维管束桥的重连[5]。在植物嫁接愈合过程中,愈伤组织的分化产生及其延伸速度是决定形成愈伤组织时间长短的一个关键因素,而植物生长调节剂在嫁接愈合过程中起着非常重要的调节作用。在生产实践中,人们常用生长调节剂来处理植物的接穗或砧木,发现它们有促进愈合、提高成活率的作用[6]。萘乙酸(α-Naphthalene acetic acid,NAA)是一种生长素类的植物生长调节剂,其通过使细胞壁松弛、促进RNA和蛋白质等物质合成从而促进细胞生长。外源施加浓度较高(≥10-7 mol·L-1)的NAA,对根部生长有抑制作用,而对不亲和的嫁接体来说,其影响更大,但适宜的NAA浓度能有效促进嫁接成活。赵宇瑛等[7]对黄瓜子叶进行组织培养研究表明,极低浓度的NAA即能诱导大量愈伤组织,在0.05~0.10 mg·L-1浓度范围内,随NAA浓度的提高,出愈率提高,愈伤组织增殖加快。马庆等[8]在黄瓜嫁接研究中发现,外源施用40 mg·L-1的NAA处理后嫁接苗成活率最高,并能提高幼苗品质。但NAA的应用对嫁接苗内部生理的响应机制以及调控作用仍不明确。因此,笔者以薄皮甜瓜‘银泉一号为试材,以外源施用40 mg×L-1 NAA为处理,蘸取清水为对照,用石蜡切片技术,分析外源施用NAA对薄皮甜瓜嫁接苗愈合过程中组织变化的影响,确定薄皮甜瓜嫁接苗愈合的关键时期。其次,利用生理生化指标和qRT-PCR技术,明确外源施用NAA对薄皮甜瓜嫁接苗愈合关键时期主要相关酶活性及相关基因表达的影响,以期能够进一步解析外源NAA调控甜瓜嫁接愈合的生理及分子机制,为提高甜瓜嫁接效率提供理论和实践基础。
1 材料与方法
1.1 材料
以薄皮甜瓜品种‘银泉一号为接穗(辽宁省农业科学研究院提供),白籽南瓜品种‘圣砧一号为砧木(沈阳圣地亚农业科技有限公司提供)。待接穗1叶1心,砧木子叶展开时,采用顶端贴接法进行嫁接。
1.2 试验设计
试验于2018年4月在沈阳农业大学北山科研基地18号日光温室嫁接间进行。在嫁接过程中以接穗蘸取清水为对照(CK),蘸取40 mg×L-1的NAA溶液为处理(NAA),对照和外源NAA处理的嫁接苗管理方式一致。于嫁接后第1天开始取样,取嫁接接口处0.5~1.0 cm处放于配好的FAA固定液(含70%无水乙醇、福尔马林和冰乙酸)中,取至嫁接后第10天,将样品进行横切进行石蜡切片观察。取长势健壮的嫁接苗嫁接口处约0.2 g茎段,去离子水冲洗,吸水纸擦干,迅速放入液氮冷冻,保存于-80 ℃超低温冰箱中备用,3次重复。
1.3 方法
1.3.1 石蜡切片的制作 参照叶宝兴等[9]的方法处理样品,使用Lecia RM 2245輪转式切片机制作石蜡切片,厚度10 ?m,甲苯胺蓝染色。在光学显微镜下观察组织细胞结构变化并照相。
1.3.2 SOD、POD、PAL、PPO酶活性测定 通过石蜡切片观察后,筛选出关键时期,取出相对应的样品,进行相关酶活性的测定(以FW计)。超氧化物歧化酶(SOD)活性采用氮蓝四唑法测定[10],苯丙氨酸解氨酶(PAL)活性采用紫外分光光度法测定[11];过氧化物酶(POD)活性采用愈创木酚法测定[12];多酚氧化酶(PPO)活性采用邻苯二酚氧化法测定[13]。
1.3.3 实时荧光定量PCR分析 RNA提取试剂盒由康为世纪提供的超纯RNA提取试剂盒(Ultrapure RNA Kit),其详尽操作步骤参考说明书。并根据反转录试剂盒(PrimeScriptTM RT reagent Kit with gDNA Eraser,TaKaRa)提供的方法进行cDNA合成。荧光定量反应在定量PCR仪Jena上进行。利用荧光定量试剂盒(DRR041A,TANGEN)检测各个基因的表达量,步骤参照试剂盒说明。
PCR反应程序为:95 ℃ 10 min;95 ℃ 30 s, 60 ℃ 30 s,72 ℃ 30 s,40个循环,收集荧光信号;50~60 ℃ 6 s,生成溶解曲线。各引物序列见表1。每个样品做3次重复,计算各个基因的相对表达量。
采用Microsoft Excel 2007处理原始数据及绘图,采用SPSS 17.0软件进行差异显著性分析。
2 结果与分析
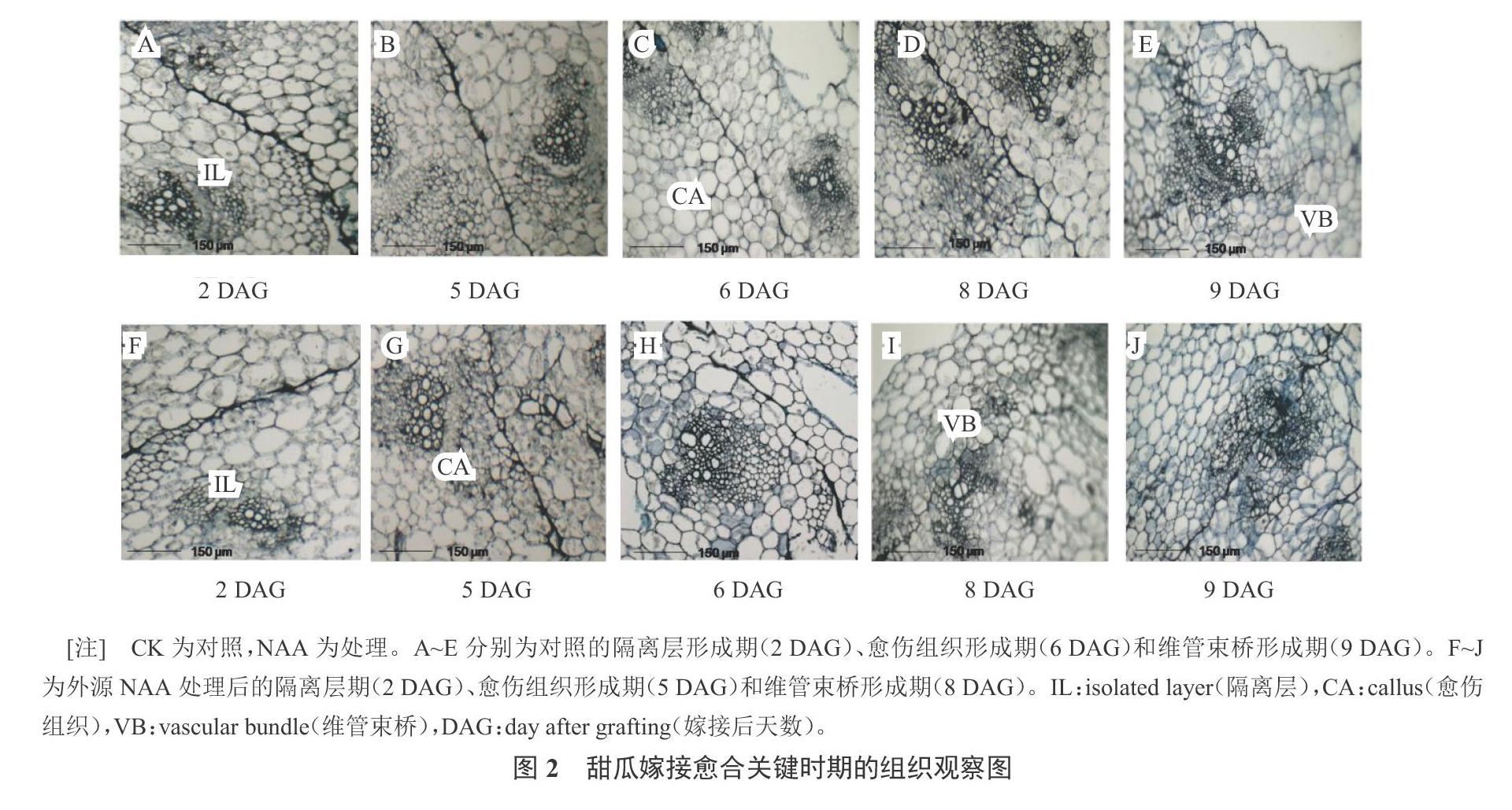
2.1 甜瓜愈合处石蜡切片观察
嫁接后第2天,在砧木和接穗相连接的区域可观察到1个染色较深的薄层。由图2-A、图2-F可知,对照和外源NAA处理均产生隔离层,隔离层的产生起到一种保护作用,防止接口处水分和营养物质的过量散失。可见,外源施用NAA并没有促进隔离层的形成。随着嫁接苗管理天数的增加,隔离层渐渐消失,接口处颜色变浅,形成愈伤组织。外源NAA处理的嫁接苗在第5天形成愈伤组织(图2-G),而对照植株愈伤组织形成则发生在第6天(图2-C)。在第8天时,外源NAA处理的嫁接苗形成维管束(图2-I),而对照植株新的维管束形成发生在第9天(图2-E)。维管束的重新连接预示着嫁接愈合过程的完成。可见,外源施用NAA能够促进愈伤组织的形成,从而使愈合进程提前。
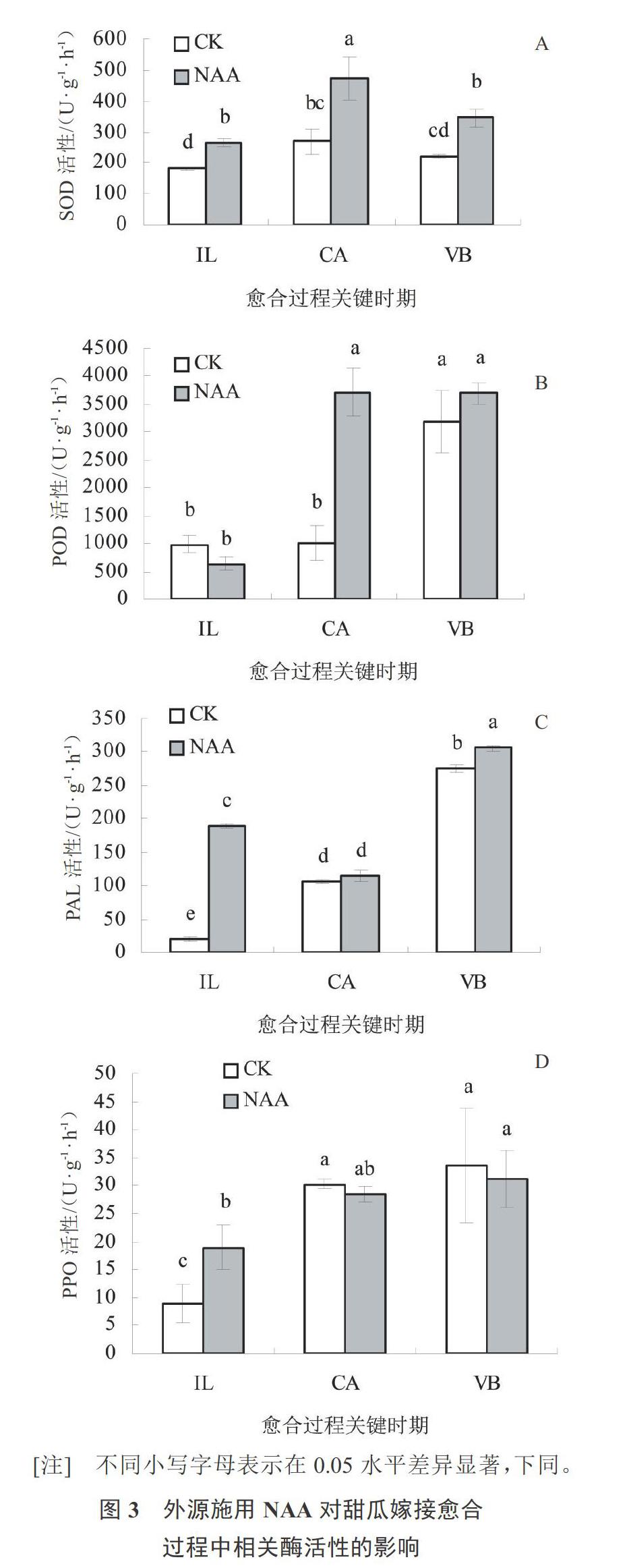
2.2 嫁接甜瓜愈合过程关键时期相关酶的活性变化
由图3-A分析得知,随着嫁接管理时间的延长,外源NAA处理和对照嫁接苗接口处的SOD酶活性均表现为先升高后降低的趋势,且在愈伤组织形成期达到最高值。外源NAA处理后,SOD活性在3个关键时期均比对照高,且在隔离层和愈伤组织形成期均显著高于对照。可见,外源NAA处理后,SOD酶活性增高,有效抑制了活性氧给植物体造成的伤害,从而促进薄皮甜瓜嫁接苗的愈合。
由图3-B可知,外源NAA处理后,POD酶活性在愈伤组织和维管束形成期高于对照。且在愈伤组织形成期,POD活性显著高于对照,活性达最高值(3 718 U·g-1·h-1)。而对照在维管束形成时期POD活性最高(3 183 U·g-1·h-1)。外源NAA处理后,POD活性较对照提前一个时期达到最高值,此时木质化程度最大。可见,外源NAA处理能够加快薄皮甜瓜嫁接苗的愈合速度。
由图3-C分析得知,外源NAA处理后,PAL酶活性在愈合过程3个关键时期均高于对照。除愈伤组织形成期外,PAL酶活性均显著高于对照,并在维管束形成时期达到最高值(306.67 U·g-1·h-1)。PAL酶活性升高可促进木质素合成和维管束的形成。可见,外源NAA处理后有利于维管束的形成,进而促进薄皮甜瓜嫁接苗的愈合过程。
由图3-D可知,外源NAA处理和对照嫁接苗的PPO酶活性均呈现上升的趋势。在隔离层时期,外源NAA处理的嫁接苗PPO酶活性显著高于对照。分析原因可能是外源NAA处理更利于砧木与接穗接口处酚类物质氧化成活性醌,从而保护嫁接口免受伤害。而在愈伤组织和维管束形成期,外源NAA处理的嫁接苗PPO酶活性低于对照,但差异不显著。可见,外源NAA处理使隔离层存在的时间短于对照,更有利于嫁接苗愈合。
2.3 甜瓜嫁接愈合过程关键时期关键酶相关基因的表达量变化
生理数据检测结果显示,外源NAA处理与对照嫁接苗的酶活性存在一定的差异,为了初步解析导致这种差异的原因,分析了愈合过程中关键酶相关基因的表达特性。从NCBI数据库(https://www.ncbi.nlm.nih.gov/)以及甜瓜基因组数据库(https://www.cucurbitgenomics.org/feature)中得到3个超氧化物歧化酶基因(CmFe-SOD、CmMn-SOD、CmCu-Zn-SOD)、1个过氧化物酶基因(CmPOD)和1个苯丙氨酸解氨酶基因(CmPAL),1个多酚氧化酶基因(CmPPO),并设计其特异引物(表1),分析了以上基因在甜瓜嫁接愈合过程关键时期的表达特性。
由图4-A~C可知,外源NAA处理后,3个SOD酶基因(CmFe-SOD、CmMn-SOD和CmCu-Zn-SOD)在各个时期的表达量均高于对照,且外源NAA处理使CmFe-SOD和Cm-Cu-Zn-SOD表达量在愈伤组织形成时期显著高于对照,分别为对照的3.03和3.57倍,但对CmMn-SOD表达量影响不显著。
由图4-D可知,对照嫁接苗CmPOD表达量在3个关键时期均高于外源NAA处理,并且在愈伤组织形成期表达量显著高于NAA处理。对照嫁接苗CmPOD表达量趋势呈先升高后降低的趋势,在第2个时期达到最高值为0.67。而外源NAA处理后其表达量变化呈下降趋势,并在隔离层和愈伤组织形成期显著低于对照。可见,外源NAA处理后,没有显著诱导CmPOD基因的表达。
由图4-E分析得知,在嫁接愈合过程中,CmPAL表达量变化呈先下降后上升的趋势。但是,外源NAA处理的嫁接苗CmPAL表达量在愈伤组织形成期和维管形成期均显著高于对照,分别为对照的3.02和4.02倍。可见,外源NAA处理显著诱导了CmPAL在愈伤组织形成期和维管束形成期表达。
由图4-F分析可知,在嫁接苗愈合过程中,CmPPO表达量变化呈现下降的趋势。在隔离层形成期,外源NAA处理的嫁接苗CmPPO表达量显著高于对照,为对照的2.69倍。而在愈伤组织形成期和维管束形成期,外源NAA处理的嫁接苗CmPPO表达量低于对照,但其差异不显著。可见,外源NAA处理可显著诱导CmPPO在隔离层形成期表达。
3 讨论与结论
3.1 外源施用NAA对甜瓜嫁接愈合过程中组织学的影响
已有研究表明,外源施用生长素可促进中柱鞘细胞形成愈伤组织,引起侧根的形成[14-15]。而NAA是一种合成的生长素类似物,有促进细胞的生长和促进植物体愈合的作用,并且适宜的NAA浓度能有效的促进嫁接成活率[16-17]。笔者研究发现,外源施用40 mg×L-1 NAA后,使愈伤组织形成时期较对照提前1 d,从而促进了维管束的连接,有效的促进了愈合过程。这与Lu和Song[18]的试验结果一致,外源施加植物激素可加快植物的愈合速率。
3.2 外源施用NAA对甜瓜嫁接愈合过程中关键酶及相关基因表达的影响
在嫁接愈合进程中,两种植物组织结合在一起,在愈合部位发生许多生理生化和结构过程变化[19-21]。超氧化物歧化酶(SOD)是植物体内清除自由基的最关键的酶类之一。本试验结果表明,嫁接初期,由于伤口的存在破坏了膜结构,活性氧增加,为了清除自由基对膜的破坏,抑制膜脂过氧化,维护膜的结构和功能,在嫁接初期,SOD酶活性呈上升趋势,在愈伤组织形成期活性最高,随着嫁接接口的愈合,其活性逐渐下降,这与陈红等[22]和冯金玲等[23]研究结果一致。并发现,外源施用NAA后SOD酶活性在愈合过程3个关键时期均高于对照,表明NAA的施用有效地清除了活性氧给嫁接口造成的伤害,促进甜瓜的愈合进程。POD在砧穗交流中是必需的,其活性变化趋势与SOD酶活性变化趋势相似,均呈先上升后下降的趨势[24]。本试验结果发现,外源施用NAA后,POD活性在愈伤组织形成期达到最高值,且显著高于对照。这与苏媛等[25]对黄瓜嫁接愈合的研究结果一致,即POD活性变化与嫁接愈合过程中愈伤组织的形成有关。杨冬冬等[26]对西瓜嫁接愈合的研究结果显示,POD活性的增加与木质素的合成密切相关。本试验中外源NAA处理使POD活性显著增加可能是其促进嫁接接合部愈合的重要原因之一。PAL酶是苯丙类代谢的限速酶和关键酶,参与愈伤组织细胞和管状分子的分化以及木质素的合成,主要分布在近表皮的细胞和维管组织中[27-28]。PAL酶是嫁接体组织发育和功能重建的重要指标。另外,细胞供能的情况也可根据PAL的活性高低来反映,随着植物嫁接愈合过程的发展,植物会供给大量的能量,而PAL酶活性的增高也为此提供了证据[29]。本试验结果发现,外源NAA处理和对照在维管束形成时期的PAL酶活性均上升达到最高值。并且,外源NAA处理使PAL酶活性显著高于对照。可见,外源施用NAA处理能够使嫁接口的木质化程度升高,更有利于甜瓜嫁接苗愈合。PPO酶主要参与植物细胞壁木质素的合成,并且能够氧化体内酚类物质[30]。张红梅等[31]发现木质化程度越高,PPO活性越高,砧木和接穗间嫁接口隔离层存在时间就越长,从而影响嫁接愈合的成活。通过本试验结果可以看出,外源NAA处理后,在隔离层形成时期,PPO活性显著高于对照,表明其更有利于形成隔离层,保护受伤的嫁接口。而在之后的两个时期低于对照,是因为隔离层消失,更好的形成愈伤组织和维管束,有利于提高愈合速度及成活率。
为了进一步解析甜瓜嫁接愈合过程中关键酶活性的变化原因,我们从转录水平上分析了愈合关键时期关键酶相关基因的表达。从NCBI数据库网站中,我们找到了6个关键酶相关的基因,分别是CmFe-SOD、Cm-Cu-Zn-SOD、CmMn-SOD、CmPAL、CmPOD、CmPPO。外源NAA处理后,CmFe-SOD、Cm-Cu-Zn-SOD、CmMn-SOD、CmPAL表达量均高于对照,其变化趋势与酶活性变化趋势基本一致,并且CmFe-SOD、Cm-Cu-Zn-SOD和CmPAL在愈伤组织形成期均显著高于对照,CmPPO在隔离层形成时期显著高于对照,且变化趋势也与酶活性变化趋势一致。可见,外源NAA处理是通过诱导甜瓜嫁接愈合过程中关键酶相关基因转录表达进而影响其相关酶活性变化。而CmPOD表达量的变化趋势与酶活性相反,其原因可能是POD酶的活性并不受CmPPO转录表达调控,但有待于进一步研究。
目前,已有研究报道,外源施用植物激素可促进植物的愈合过程。本试验结果表明,外源施用NAA通过诱导愈伤组织形成期的关键酶基因(CmFe-SOD、CmCu-Zn-SOD、CmPAL)转录水平的上调表达,提高其酶活性,进而促进了甜瓜嫁接苗的愈合进程。但是,有关外源NAA诱导愈合过程中关键酶基因表达的具体分子机制尚不明确。甜瓜嫁接体愈合的过程十分复杂,涉及很多生理生化代谢过程,用传统方法分析代谢物间的相互作用较困难。因此,在未来的研究中,可进一步应用转录组学、蛋白质组学、代谢组学及转基因或基因编辑技术(CRISPR/Cas9)等手段来揭示调控甜瓜嫁接愈合的关键因子,为能够系统阐明嫁接愈合的生理及分子化机制提供理论基础。
参考文献
[1] 李瑶.嫁接提高甜瓜耐低温生理机制的研究[D].长春:吉林大学,2014.
[2] VITALE A,ROCCO M,ARENA S,et al.Tomato susceptibility to Fusarium crown and root:effect of grafting combination and proteomic analysis of tolerance expression in the rootstock[J].Plant Physiology and Biochemistry,2014,83:207-216.
[3] FOSTER T M,WATSON A E,VAN HOOIJDONK B M,et al.Key flowering genes including FT-like genes are upregulated in the vasculature of apple dwarfing rootstocks[J].Tree Genetics & Genomes,2014,10(1):189-202.
[4] MELNYK C,SCHUSTER C,LEYSER O,et al.A developmental framework for graft formation and vascular reconnection in Arabidopsis thaliana[J].Current Biology,2015,25(10):1306-1318.
[5] MOORE R.Graft formation in Kalanchoe blossfeldiana[J].Journal of Experimental Botany,1982,33(3):533-540.
[6] 楊晓盆,王跃进.吲哚丁酸对高接酥梨成活率及新梢生长的影响[J].山西农业大学学报,1996,16(4):408-410.
[7] 赵宇瑛,李永辉,李丛玉,等.6-BA、NAA和IAA对黄瓜子叶离体培养分化的影响[J].长江大学学报(自然科学版)农学卷,2007(3):26-28.
[8] 马庆,赵瑞,陈俊琴,等.不同浓度NAA溶液对嫁接黄瓜苗期形态及生理指标的影响[J].中国蔬菜,2013(6):50-53.
[9] 叶宝兴,毕建杰,孙印石.植物细胞与组织研究方法[M].北京:化学工业出版社,2011.
[10] 汤章城.现代植物生理学实验指导[M].北京:科技出版社,1999,314-315.
[11] 张志安,陈展宇.植物生理学实验技术[M].长春:吉林大学出版社,2008.
[12] 王学奎.植物生理生化实验原理和技术[M].2 版.高等教育出版社,2006.
[13] 刘萍,李明军.植物生理学实验技术[M].1 版,北京:科学出版社,2007.
[14] SACHA T.The control of the patterned differentiation of vascular tissues[J].Advances in botanical research.Academic Press,1981,9:151-262.
[15] SCARPELLA E,MARCOS D,FRIML J,et al.Control of leaf vascular patterning by polar auxin transport[J].Genes and Development,2006,20(8):1015-1027.
[16] 黄坚钦,方伟,丁雨龙,等.植物生长调节物质对山核桃嫁接的效用[J].南京林业大学学报,2002,26(4):78-80.
[17] 唐辉,韦霄,梁惠凌,等.外源激素对银杏高位嫁接及其枝梢生长的影响[J].中南林业科技大学学报,2007,27(1):85-87.
[18] LU S,SONG Y.Relation between phytohormone level and vascular bridge differentiation in graft union of explanted internode autografting[J].Chinese Science Bulletin,1999,44(20):1874-1878.
[19] ERREA P,FELIPE A J,HERRERO M.Graft establishment between compatible and incompatible Prunnus spp.[J].Journal of Experimental Botany,1994,45(3):393-401.
[20] PINA A,ERREA P.A review of new advances in mechanism of graft compatibility–incompatibility[J].Scientia Horticulturae,2005,106(1):1-11.
[21] TRINCHERA A,PANDOZY G,RINALDI S,et al.Graft union formation in artichoke grafting onto wild and cultivated cardoon:An anatomical study[J].Journal of Plant Physiology,2013,170(18):1569-1578.
[22] 陈红,王永清,袁媛,等.茄子/番茄嫁接体发育过程中的蛋白质含量、POD、CAT和SOD活性及其同工酶研究[J].四川农业大学学报,2006,24(2):144-147.
[23] 馮金玲,杨志坚,陈辉,等.油茶芽苗砧嫁接体的亲和性生理[J].福建农业大学学报(自然科学版),2011,40(1):24-30.
[24] 胡艳青,苏媛,韩风叶,等.嫁接黄瓜在愈合过程中的解剖观察和抗氧化酶活性的变化研究[J].内蒙古农业大学(自然科学版),2007,28(3):224-230.
[25] 苏媛,郭金妹,胡彦青,等.黄瓜嫁接苗愈合过程的解剖观察及过氧化物同工酶分析[J].沈阳农业大学学报,2006,37(3):343-347.
[26] 杨冬冬,黄丹枫.西瓜嫁接体发育中木质素合成及代谢相关酶活性的变化[J].西北植物学报,2006,26(2):290-294.
[27] 勒栋梁,董凤祥,李宝.杂交榛不同枝段绿枝扦插生根特性及相关氧化酶活性变化[J].林业科学研究,2009,22(4):526-532.
[28] NAKASHIMA J,AWANO T,TAKABE K,et al.Immunocytochemical localization of phenylalanine ammonia-lyase and cinnamyl alcohol dehydrogenase in differentiating tracheary elements derived from Zinnia mesophyll cells[J].Plant Cell Physiology,1997,38(2):113-123.
[29] VENEMA J H,DIJK B E,BAX J M,et al.Grafting tomato(Solanum lycopersicum)onto the rootstock of a high-altitude accession of Solanum habrochaites improves suboptimal-temperature tolerance[J].Environmental and Experimental Botany,2008,63(1/3):359-367.
[30] 代丽,宫长荣,史霖,等.植物多酚氧化酶研究综述[J].中国农学通报,2007,23(6):312-316.
[31] 张红梅,丁明,姜武,等.不同苗龄接穗西瓜嫁接体愈合的组织细胞学研究[J].园艺学报,2012,39(3):493-500.
