长链非编码RNA 浆细胞瘤转化迁移基因1在结直肠癌组织和细胞中的表达及临床意义
2019-11-14平贯芳熊万成邓智建
平贯芳,熊万成,邓智建
(1.新乡医学院第一附属医院药学部,河南 卫辉 453100;2.新乡医学院第一附属医院普外科,河南 卫辉 453100)
结直肠癌(colorectal cancer,CRC)患者病死率居常见恶性肿瘤的第3位,仅次于肺癌和乳腺癌[1]。随着环境和生活方式的改变,CRC的发病率逐渐增加[2]。目前,手术联合放射治疗和化学治疗在CRC 的治疗中发挥重要作用,但由于CRC易发生复发和转移,患者的5 a生存率并未得到改善[3],肿瘤增殖、转移和耐药是 CRC治疗失败的主要原因[4]。因此,阐明其内在机制、探索CRC治疗的新靶点势在必行。长链非编码RNA (long non-coding RNA,LncRNA) 浆细胞瘤转化迁移基因1(plasmacytoma variant translocation 1,PVT1)位于人染色体8q24.21,与多种肿瘤细胞增殖、凋亡、淋巴侵袭、转移和预后相关[5]。有研究显示,PVT1表达上调在卵巢癌和乳腺癌的病理发展过程中起主要作用[6]。在胃癌组织中,PVT1的高表达可能作为一种新的诊断依据[7]。肝细胞癌组织中PVT1高表达患者一般预后不良[8]。GUO等[9]研究发现,PVT1在CRC组织中的表达高于正常组织。PVT1上调可抑制CRC细胞的凋亡[10]。本研究通过检测CRC组织中LncRNA PVT1 的表达量,分析其与CRC患者肿瘤 TNM分期、临床病理因素及预后的关系,同时通过小分子RNA干扰(small interfering RNA,siRNA) 技术特异性沉默人CRC细胞中PVT1基因,考察其对CRC细胞增殖、凋亡、侵袭和迁移的影响,以期为CRC的临床治疗提供基础资料。
1 资料与方法
1.1 标本来源选取2006年4月至2011年3月在新乡医学院第一附属医院接受手术切除治疗的CRC患者的癌组织和配对癌旁组织标本各112例,其中男 57 例,女55 例;年龄 40~70 (55.3±8.9) 岁;肿瘤分级:Ⅰ、Ⅱ级 61 例,Ⅲ、Ⅳ级51 例。所有标本经病理学检查证实为CRC,患者术前均未接受放射治疗或化学治疗。所有患者随访至2016年或直至死亡。本研究经新乡医学院第一附属医院伦理委员会批准,且所有患者签署知情同意书。
1.2 细胞、试剂与仪器人CRC细胞系LoVo和RKO购自美国ATCC公司;RPIM1640培养基、青霉素、链霉素、胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司,TRIzol试剂购自美国Ambion公司,细胞裂解液、LipfectamineTM2000脂质体转染试剂盒购自美国Invitrogen公司,反转录试剂盒、聚合酶链反应(polymerase chain reaction,PCR)试剂盒购自日本TaKaRa公司,PVT1和内参引物均由上海生工生物公司设计合成,PVT1 干扰RNA(siPVT1)及阴性对照(siRNA)序列由广州锐博生物科技有限公司合成提供,细胞增殖试剂盒(cell counting kit 8,CCK-8)购自南京凯基生物科技股份有限公司,膜联蛋白V-异硫氰酸荧光素/碘化丙啶(annexin V-flourescein isothiocyanate/propidium iodide,Annexin V-FITC/PI) 凋亡检测试剂盒购自美国BD公司;Transwell小室购自美国Costar公司,酶标仪、凝胶电泳系统购自美国Bio-Rad 公司,倒置相差显微镜购自德国蔡司光学仪器有限公司,实时荧光定量PCR 仪购自美国 ABI 公司,流式细胞仪购自美国BD公司。
1.3 实验方法
1.3.1 细胞培养及分组人CRC细胞系LoVo和RKO细胞接种于含体积分数10% FBS、100 U·mL-1青霉素和100 mg·L-1链霉素的达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM),置于37 ℃、含体积分数5%CO2的加湿培养箱中培养。取对数生长期细胞,2.5 g·L-1胰蛋白酶消化后接种于6 孔板中培养,待LoVo和RKO细胞融合度均达70%以上时,利用 LipfectamineTM2000脂质体对细胞进行转染。在后续实验中,每种细胞随机分为2组:(1)siPVT1组:转染 PVT1干扰序列 5′-CCCAACAGGAGGACAGCUUTT-3′;(2)siRNA-对照序列组:转染阴性对照序列5′-AAGCUGUCCUCCUGUUGGG-3′。转染后继续培养48 h,完成后续实验。
1.3.2 反转录实时荧光定量PCR检测人CRC组织及细胞中PVT1 mRNA的表达用TRIzol试剂从CRC组织和细胞中提取总RNA,总RNA按照反转录试剂盒说明书方法合成cDNA。PCR引物序列:PVT1引物正向序列为5′-CAGCACTCTGGA CGGAC-3′,反向序列为5′-CAACAGGAGAAGC AAACA-3′;磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH) 引物正向序列为5′-ACCACAGTCCATGCCATCAC-3′,反向序列为5′-TCACCACCCTGTTGCTGTA-3′。利用SYBRGreen核酸荧光染料通过ABI 7500 定量PCR系统进行检测。以合成的cDNA为模板进行扩增。PCR反应条件:95 ℃ 10 min,94 ℃ 30 s,58 ℃ 30 s,75 ℃ 25 s,连续循环36次,每个样本设3个平行反应复孔。用2-ΔΔCt计算PVT1 mRNA的表达水平。GAPDH作为PVT1的内参,以PVT1拷贝数与GAPDH拷贝数的比值为PVT1的相对表达量。根据PVT1在112例CRC样本中相对表达量的中位值,将PVT1分为高表达组与低表达组。
1.3.3 CCK-8法检测细胞增殖情况取转染后培养48 h 的LoVo和RKO细胞,2.5 g·L-1胰蛋白酶消化,并调整其密度为2×107L-1,接种于 96 孔板,每孔加入100 μL细胞悬液,每组设 6 个复孔,置于含体积分数10% FBS的DMEM,37 ℃恒温培养,分别于培养 0、24、48、72、96 h时加入CCK-8溶液 10 μL,摇晃均匀,避光孵育,应用酶标仪于450 nm 波长处测定各孔吸光度。
1.3.4 流式细胞术检测细胞凋亡情况取转染后培养48 h的LoVo和RKO细胞,2.5 g·L-1胰蛋白酶消化,并调整其密度为1×109L-1,取1 mL细胞悬液置于离心管内,4 ℃下1 000 r·min-1离心3 min,PBS冲洗后再次离心,弃上清液,于留取的细胞沉淀物中加入100 μL FITC结合缓冲液充分混合,10 μL Annexin V避光条件下孵育 15 min,再加入5 μL PI继续避光反应 15 min。最后再加入结合缓冲液 900 μL,1 h内使用流式细胞仪进行检测,分析细胞凋亡情况。实验重复3 次。
1.3.5 Transwell 小室检测CRC细胞迁移及侵袭能力取转染后培养48 h 的LoVo和RKO细胞,2.5 g·L-1胰蛋白酶消化,分别计数各组细胞,并调整其密度为1×106L-1。取200 μL 细胞悬液直接加入小室上室,500 μL 含体积分数10% FBS的培养液加入下室,于37 ℃条件下培养;将 Matrigel 胶平铺于 Transwell 小室上室,风干后备用。随后取200 μL 细胞悬液加入铺有Matrigel胶的上室,再加入500 μL 含体积分数10%胎牛血清的培养液加入下室,于37 ℃下培养48 h后取出小室,弃去多余的培养液,多聚甲醛对上室内外两侧的细胞进行固定,结晶紫染色后,用棉签将上室内侧散落细胞轻轻除去,利用倒置显微镜观察,每孔均随机取6个高倍视野,计数穿膜细胞。实验重复3次。

2 结果
2.1 CRC组织和癌旁组织中PVT1 mRNA表达比较CRC组织中PVT1高表达率为 61.61% (69/112),低表达率为 38.39% (43/112);癌旁组织中PVT1高表达率为44.64% (50/112),低表达率为55.36% (62/112)。CRC组织中PVT1高表达率显著高于癌旁组织,差异有统计学意义(χ2=6.472,P<0.01)。
2.2 PVT1 mRNA表达与CRC患者临床病理参数及预后的关系结果见表1。CRC组织中PVT1表达与患者的年龄及性别无关(P>0.05),与肿瘤直径、TNM 分期、淋巴结转移及远处转移有关(P<0.05)。PVT1高表达患者和低表达患者的5 a生存率分别为10.3%(6/58)、22.2%(12/54),PVT1高表达患者5 a生存率显著低于低表达患者,差异有统计学意义(P<0.05)。
表1 PVT1表达量与 CRC患者临床病理特征的关系
Tab.1 Relationship between PVT1 expression and clinicopathological features of CRC patients

临床参数nPVT1 mRNA高表达/例(%)低表达/例(%)χ2P年龄 <60岁5025(50.0)25(50.0)0.1150.734 ≥60岁6233(53.2)29(46.8)性别 男5731(54.4)26(45.6)0.3140.575 女5527(49.1)28(51.0)肿瘤直径 ≤5 cm6326(41.3)37(58.7)6.3800.012 >5 cm4932(65.3)17(34.7)TNM分期 I、II期6123(37.7)38(62.3)10.6370.001 III、IV期5135(68.6)16(31.4)淋巴结转移 是6037(61.7)23(38.3)5.0530.025 否5221(40.4)31(59.6)远处转移 是4430(68.2)14(31.8)7.8030.005 否6828(41.2)40(58.8)
2.3 沉默PVT1后CRC细胞系LoVo和RKO细胞中PVT1 mRNA相对表达量比较siPVT1 组和siRNA-对照序列组LoVo细胞中PVT1 mRNA相对表达量分别为0.23±0.12、0.98±0.11,siPVT1组和siRNA-对照序列组RKO细胞中PVT1 mRNA相对表达量分别为0.28±0.06、1.01±0.08;siPVT1组LoVo、RKO细胞中PVT1 mRNA相对表达量均显著低于 siRNA-对照序列组,差异有统计学意义(t=10.05、15.64,P<0.05)。
2.4 沉默PVT1后CRC细胞系LoVo和RKO细胞增殖能力比较结果见表2。培养0、24 h时,siPVT1组与siRNA-对照序列组LoVo细胞增殖能力比较差异无统计学意义(P>0.05);培养 48、72、96 h 时,siPVT1 组LoVo细胞增殖能力显著低于siRNA-对照序列组,差异有统计学意义(P<0.05)。培养0 h时,siPVT1 组与siRNA-对照序列组RKO细胞增殖能力比较差异无统计学意义(P>0.05);培养24、48、72、96 h时,siPVT1组RKO细胞增殖能力显著低于siRNA-对照序列组,差异有统计学意义(P<0.05)。
表2 沉默PVT1对LoVo和RKO细胞增殖能力的影响
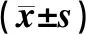

组别细胞增殖能力0 h24 h48 h72 h96 hLoVo细胞 siRNA对照序列组0.34±0.220.95±0.222.33±0.212.80±0.263.27±0.21 siPVT1组0.32±0.150.67±0.101.50±0.16a1.85±0.22a2.35±0.15aRKO细胞 siRNA对照序列组0.31±0.161.23±0.262.26±0.152.83±0.323.36±0.15 siPVT1组0.24±0.110.65±0.22a1.22±0.16a1.93±0.15a2.36±0.11a
注:与siRNA对照序列组比较aP<0.05。
2.5 沉默PVT1后CRC细胞系LoVo和RKO细胞凋亡率比较结果见图1。siPVT1 组和siRNA-对照序列组LoVo细胞的凋亡率分别为(16.47±5.41)%和(5.51±2.38)%,siPVT1 组和siRNA-对照序列组RKO细胞的凋亡率分别为(14.67±4.18)%和(6.01±1.65)%;siPVT1组LoVo、RKO细胞凋亡率均显著高于siRNA-对照序列组,差异有统计学意义(t=4.180、4.313,P<0.05)。
2.6 沉默PVT1后CRC细胞系LoVo和RKO细胞迁移及侵袭能力比较结果见图2。siPVT1 组和siRNA-对照序列组LoVo细胞迁移数分别为64.1±16.5和158.4±20.8,侵袭细胞数分别为47.2±15.8和132.6±17.3;siPVT1组和siRNA-对照序列组RKO细胞迁移数分别为52.0±4.6和151.2±17.9,侵袭细胞数分别为40.0±4.9和126.4±16.5;siPVT1组LoVo、RKO细胞迁移和侵袭细胞数均显著低于siRNA-对照序列组,差异有统计学意义(P<0.01)。

A:siRNA对照序列组LoVo细胞的凋亡;B:siPVT1组LoVo细胞的凋亡;C:siRNA对照序列组RKO细胞的凋亡;D:siPVT1组RKO细胞的凋亡。
图1 沉默PVT1对CRC细胞LoVo和RKO凋亡的影响
Fig.1 Effects of PVT1 knockdown on LoVo and RKO cells apoptosis

A:siRNA对照序列组LoVo细胞的迁移;B:siPVT1组LoVo细胞的迁移;C:siRNA对照序列组RKO细胞的迁移;D:siPVT1组RKO细胞的迁移;E:siRNA对照序列组LoVo细胞的侵袭;F:siPVT1组LoVo细胞的侵袭;G:siRNA对照序列组RKO细胞的侵袭;H:siPVT1组RKO细胞的侵袭。
图2 沉默PVT1对CRC细胞LoVo和RKO迁移和侵袭能力的影响
Fig.2 Effects of PVT1 knockdown on LoVo and RKO cells migration and invasion
3 讨论
CRC是全球范围内最常见的恶性肿瘤之一,其发病率和病死率均较高[1]。因此,探索其发病机制并针对特定目标寻找新的治疗策略越来越受学者的重视。有研究发现,LncRNA PVT1在乳腺癌[11]、卵巢癌、胃癌[7]、肝细胞癌[12]、前列腺癌[13]、膀胱癌、CRC等许多肿瘤中表达均上调[7,9,11-15]。PVT1的表达对肿瘤的发生、发展也有着重要意义,例如,在非小细胞肺癌组织中PVT1表达增加与组织学分级和淋巴结转移密切相关,PVT1是预后的独立因素[16]。PVT1过表达是小细胞肺癌预后不良的生物学标志物[17]。宫颈癌患者中,高表达 PVT1者总体生存率较低[18]。此外,高表达PVT1的胃癌和肝癌患者往往预后不良[7-8]。本研究发现,PVT1促进了CRC的增殖,主要表现为:(1)PVT1 在CRC组织和细胞系中上调;(2)CRC组织中PVT1表达与肿瘤直径、TNM 分期、淋巴结转移及远处转移有关,且PVT1低表达患者的5 a生存率较高;(3)PVT1沉默可抑制CRC细胞增殖并诱导细胞凋亡;(4)PVT1沉默可抑制CRC细胞的迁移与侵袭能力。总之,PVT1是CRC细胞增殖的正向调节因子,以 PVT1为靶向的治疗可能成为CRC的一个有效治疗方案。TAKAHASHI等[10]研究发现,PVT1的高表达与CRC预后不良有关,与本研究结果一致。本研究发现,CRC组织中PVT1表达明显升高,PVT1表达量与肿瘤大小、分级和转移呈正相关,与CRC患者的预后呈负相关,提示PVT1在CRC中有着重要的临床意义。
PVT1在肿瘤生长中起促进作用。据报道,PVT1沉默可抑制卵巢癌和乳腺癌肿瘤细胞增殖并诱导细胞凋亡[6]。PVT1在肝癌细胞中通过稳定NOP2促进细胞增殖、细胞周期循环和干细胞样特性的获取[8]。沉默PVT1可抑制肺癌细胞的迁移和侵袭[16-17],降低宫颈癌细胞增殖、迁移和侵袭,但可增加细胞凋亡[18]。此外,TAKAHASHI等[10]研究指出,转染PVT1 siRNA的CRC细胞增殖和侵袭能力丧失。本研究发现,CRC组织中PVT1高表达率显著高于癌旁组织,沉默LoVo、RKO细胞中PVT1可有效抑制细胞增殖、迁移、侵袭并诱导细胞凋亡。表明沉默PVT1可抑制CRC的攻击行为。
总之,本研究证明了PVT1是CRC发生的正性调节因子,PVT1 表达与CRC患者肿瘤直径、TNM分期、转移和预后不良明显相关。沉默PVT1可抑制CRC细胞的增殖、迁移、侵袭并诱导细胞凋亡。总之,这些发现为以PVT1为靶向的CRC的有效治疗提供了崭新的视角。
