糖尿病大鼠认知功能与氢质子磁共振波谱(1 H-MRS)的相关性研究
2019-11-13陆雪芳丰明乾彭宙锋潘源虎杨文兵
陆雪芳,张 倩,丰明乾,文 之,彭宙锋,龚 威,潘源虎,杨文兵
(1.武汉大学人民医院放射科,湖北 武汉 430060;2.国家康复辅具研究中心附属康复医院影像中心,北京 100176;3.华中农业大学生命科学院,湖北 武汉 4300704;4.华中农业大学动物科技与动物医学院,湖北 武汉 430070)
2 型糖尿病(T2DM)是世界上最常见的慢性疾病之一[1],且在逐年增多[2],它主要是由于胰腺β 细胞分泌的胰岛素不足以满足代谢要求而发展形成的可多系统受累的综合性代谢疾病[3].新的证据表明,T2DM 可直接或作为辅助因子对AD 的发生和/或发展起显著作用[4],在临床上可出现诸如脑白质病变、认知功能障碍等[5]多种糖尿病脑损伤表现.研究证实T2DM 可通过海马结构、神经电生理活动以及神经递质等的改变而导致认知功能下降[6],而海马结构是首当其冲受改变的脑结构之一[7].其可能的病理机制和AD 在分子水平上相似,包括胰岛素抵抗,代谢机制损伤,β-淀粉样蛋白(Aβ)形成,氧化应激和存在晚期糖基化终产物(AGEs),神经元凋亡等[8],且大多数学者认为AD 的重要病理特征是由于Aβ 沉着而诱导星形胶质细胞被激活,从而引发相关的炎症反应和氧化应激[9].然而目前常规的CT、MRI 尚不足以对糖尿病较早期的认知功能损伤以及相应代谢物的具体变化情况进行准确的评价.氢质子波谱(1H-MRS)是一种可在体外检测活体内定位脑组织动态生化代谢变化并进行定量分析的无创检查方法[10].无其它伴随疾病的T2DM 导致人脑损伤的海马标本难以在活体取得,故本研究旨在通过建立具有认知障碍的T2DM 大鼠模型,运用1H-MRS 技术检测T2DM 大鼠及对照组双侧海马代谢物含量,并通过Morris 水迷宫检测大鼠空间学习的能力和记忆的能力.此外,通过病理组织学分析研究T2DM 对神经元的神经病理学影响,即通过“表现—1H-MRS 结果—病理证实”验证2 型糖尿病脑损伤在大鼠双侧海马1H-MRS 代谢物的变化与其认知功能的相关性.
1 材料和方法
1.1 材料
1.1.1 样本
实验动物:40 只8 ~10 周龄的健康雄性Sprague Dawley 大鼠由华中农业大学实验动物中心(中国武汉;HZAURA-2018-007)提供,体质量180 ~220 g,清洁级.饲养于温度为21 ~23 ℃(可控温度)、相对湿度为50 ~70%的无菌塑料笼中(每笼最多4 只大鼠),在12 小时内大鼠的饮水和食物自由供给,暗/明循环.本实验由华中农业大学实验动物伦理委员会审查通过,所有动物实验均严格按照机构指南进行,并遵循华中农业大学(中国武汉)动物使用和护理委员会批准的方案(HZAURA-2018-007).
1.1.2 主要试剂及器材
链脲佐菌素(STZ;目录号S0130)及HE 染色液(目录号S0129)购自上海伟进科技有限公司.血清胰岛素放射免疫测定试剂盒(目录号201803)购自中国人民解放军总医院. Morris 水迷宫系统(XRXM101)购自上海欣软信息科技有限公司.
1H-MRS 检查设备:GE(Discovery 750w)3.0T超导MRI 及配套8 通道线圈.
1.2 方法
1.2.1 T2DM 大鼠模型制
40 只健康的SD 大鼠,随机分为T2DM 实验组(n=20)和对照组(n =20).T2DM 实验组大鼠脑室注射STZ(25 mg/kg),对照组的大鼠注射相同剂量的缓冲液(柠檬酸-柠檬酸钠).随后T2DM 实验组大鼠喂食高脂、高糖和高蛋白饲料(HFSPD,食物比例:碳水化合物25%,蛋白质15.2%,脂肪(猪油)),对照组大鼠喂食普通饲料.每两周称重1 次体质量,观察其生长的基本情况,大约饲养8 周后,测量大鼠尾静脉的随机血糖和血清胰岛素含有量,并通过动态平衡实验(HOMA =(空腹血糖x 空腹胰岛素)/22.5)判断T2DM 的发展情况[9],然后连续按上述方法饲养,每周称体质量1 次.每天检测一次血糖,若连续3 天随机血糖≥11.3 mmol/L 视为T2DM 造模成功,大约历时12 周.
1.2.2 认知功能测试,即Morris 水迷宫测试(Morris Water Maze,MWM)
行为学测试在Morris 水迷宫系统中进行,测试研究大鼠的空间学习和记忆能力[9-11].该试验是在一个圆形的白色水池(直径94 cm,高31 cm)中进行的,水深为30 cm,温度约为25 ℃.逃生平台是一个25 cm2的有机玻璃广场,放置在游泳池一个象限的中心,离泳池边缘15 cm,并浸没在水面下1 cm 处.内容主要包括:
(1)定位航行试验:对大鼠的学习能力进行检测.实验前一天的下午将被检测的大鼠放入水中自由游泳2min,随机选择一个入水点将所有大鼠同一位置面朝池壁放入训练,每天上午及下午2 个时段,各训练4 次,历时4 天.观察大鼠找到平台的时间并记录,即学习潜伏期.
(2)空间探测测试:用于检测大鼠的记忆能力.平台将在训练的最后时段被从池中移除,在B 象限中任意选取一个入水点将大鼠面朝池壁放入,观察受检大鼠120 s 内在各个象限游泳的距离,计算其占总距离的百分比,观测120 s 内大鼠在各象限平台相应位置穿越的次数,也就是记忆潜伏期.
1.2.3 血糖测量
在Morris 水迷宫试验后通过腹腔注射称重并用1%戊巴比妥钠(0.4ml/kg)麻醉大鼠.从尾静脉收集大鼠的血液样品,并通过血糖仪测量血糖.同时测定大鼠血液和/或海马中的葡萄糖以及胰岛素水平.
1.2.41H-MRS 检查方法
海马1H-MRS 采集:行激励回波采集STEAM(Stimulated Echo Acquisition Method)模式,点探针Probe- SV35 序列扫描[10-13],TR:2 000 ms,TE:50 ms,FA:90°,ST:15 mm,FOV:16 mm×16 mm.扫描时间通常为3 min 45 s 至3 min 50 s.沿着海马长轴,在axial、sagittal、oblique coronal plane 多平面定位,尽量保全受检结构而避让非受检结构.扫描过程保持大鼠静止不动,以尽量避免头动伪影的产生.手动修正,并充分抑水、匀场后扫描,每次扫描前均进行质量检测,以确保机器信号的稳定性.
GE(Discovery 750w)3.0T 工作站spectroscopy 软件下进行所测得谱线的相位及基线校准、信号的平均、识别代谢物及谱线的拟合,自动读取双侧海马的NAA、Cr、Cho 及mI 曲线下面积,并计算NAA/Cr、Cho/Cr、mI/Cr、NAA/(Cr+Cho)的比值.
1.2.5 组织学标本
HE 染色观察大鼠海马组织中是否有淀粉样蛋白沉积.固定标本采用中性甲醛溶液进行,制备好厚度5 μm 的石蜡切片进行常规脱蜡50 片(常二甲苯I、II各25 min,100%、95%、90%、80%、75%乙醇及蒸馏水依次各进行5 min).首先浸染约2 min(苏木素染色液),0.5%盐酸乙醇液分化约2 s,充分冲洗(自来水),随后放入浸染约25 min(HE 染色液),迅速脱水2 次(无水乙醇),用二甲苯透明,封固(中性树胶),晾干即可.
1.2.6 统计学分析
体重、血糖、胰岛素、HOMA、1H-MRS 所得检测物及相关比值等所有数据均用均数±标准差(x±s)表示,所有统计分析在SPSS 22.0 软件包中进行,用t检验进行组内及组间差异的检验,用(右侧-左侧)/[(右侧+左侧)/2]×100%进行组内双侧海马的偏侧性检验,结果为正值表示偏向右侧,结果为负值表示偏向左侧[13];利用Pearson 检验进行代谢物与认知功能的相关性分析,所有统计均以p <0.05 表示差异具有统计学意义.
2 结果与分析
2.1 T2DM 实验组与对照组大鼠体重、血糖、胰岛素及HOMA
T2DM 实验组大鼠在注射STZ 且HFSPD 饮食后,与对照组大鼠相比,大鼠的食物和水的摄入量以及尿量逐渐增加,而体重减少,大鼠表现出T2DM 的“三多一少”症状,成功建立了T2DM 大鼠模型16 只,建模不成功4 只,T2DM 实验组大鼠血糖,胰岛素和HMOA显着增加,分别约为3.36 倍、0.92 倍和3.08 倍(P < 0.05=,差异有统计学意义(表1).

表1 STZ 注射且HFSPD 饮食后T2DM 实验组与对照组大鼠血糖、胰岛素及HOMA 比较Table 1 Comparison of blood glucose,insulin and HOMA between T2DM experimental group and control group after STZ injection followed by HFSP diet
2.2 T2DM 实验组与对照组大鼠认知功能
通过Morris 水迷宫测试评估T2DM 组与对照组大鼠的认知功能,初始观察时T2DM 实验组大鼠的学习潜伏期略有增加、记忆潜伏期略有减小,但在SZT注射且HFSPD 饮食后的第1 天未观察到统计学上的显著差异,在第5 天观察到统计学上的显著差异(p <0.05=,表明T2DM 大鼠的认知功能损伤在12 周龄时就已经表现出来了,这和之前的部分研究结果相一致[14](表2).

表2 T2DM 实验组与对照组Morris 水迷宫测试结果Table 2 Morris water maze test results of T2DM experimental group and control group
2.3 T2DM 实验组与对照组进行左侧海马1H-MRS检测值的组间比较
在左侧海马区对T2DM 实验组与对照组两组间波谱的差异性运用t 检验进行统计分析:结果显示T2DM 实验组NAA 值低于对照组,差异有统计学意义(t=0.0964,p <0.05=(图1、表3);NAA/Cr 两组间虽略有差异,但差异无统计学意义(p >0.05);而Cho、Cr、mI、Cho/Cr 及mI/Cr 两组间差异均无统计学意义(P >0.05).
2.4 T2DM 实验组与对照组进行右侧海马1H-MRS检测值的组间比较
右侧海马区T2DM 实验组与对照组两组间波谱的差异性运用t 检验进行统计分析,结果显示T2DM实验组NAA 值低于对照组,差异有统计学意义(t=0.1470,p <0.05(图2、表3);其余观测值(Cho、Cr、mI、NAA/Cr、Cho/Cr 及mI/Cr)在两组间的差异均无统计学意义(P >0.05).
2.5 T2DM 实验组与对照组双侧海马1 H-MRS检测值偏侧性及相关性分析
偏侧性分析显示,NAA 在T2DM 实验组与对照组均偏向于左侧海马(表3).利用Pearson 检验进行相关性分析,T2DM 实验组大鼠Morris 水迷宫测试中学习潜伏期与左侧海马区NAA 呈负相关(r=-0.378,p <0.05),记忆潜伏期与左侧海马区NAA 呈正相关(r=0.401,p <0.05).
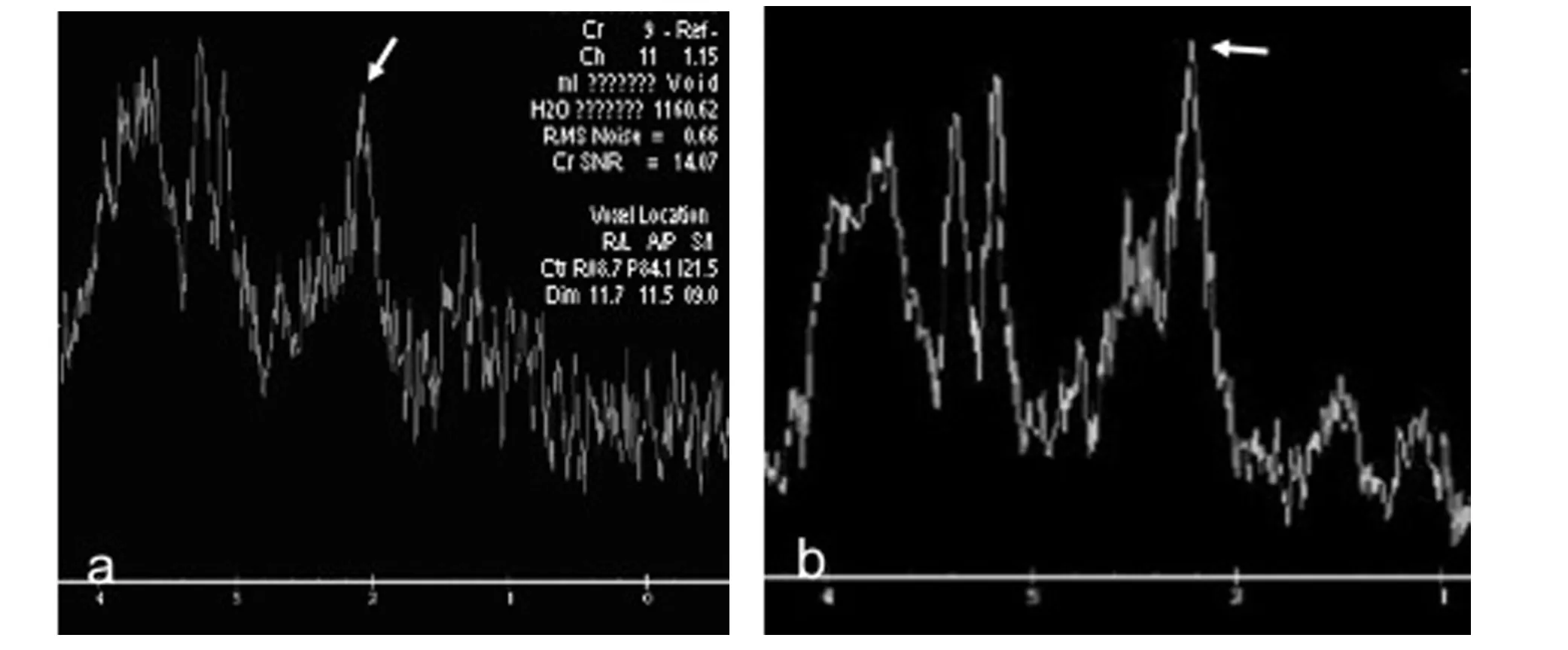
图1 T2DM 实验组和对照组左侧海马1H-MRS a.T2DM 实验组;b.对照组Fig.1 1H-MRS of T2DM experimental group and control groupleft hippocampus a.T2DM experimental group;b.control group
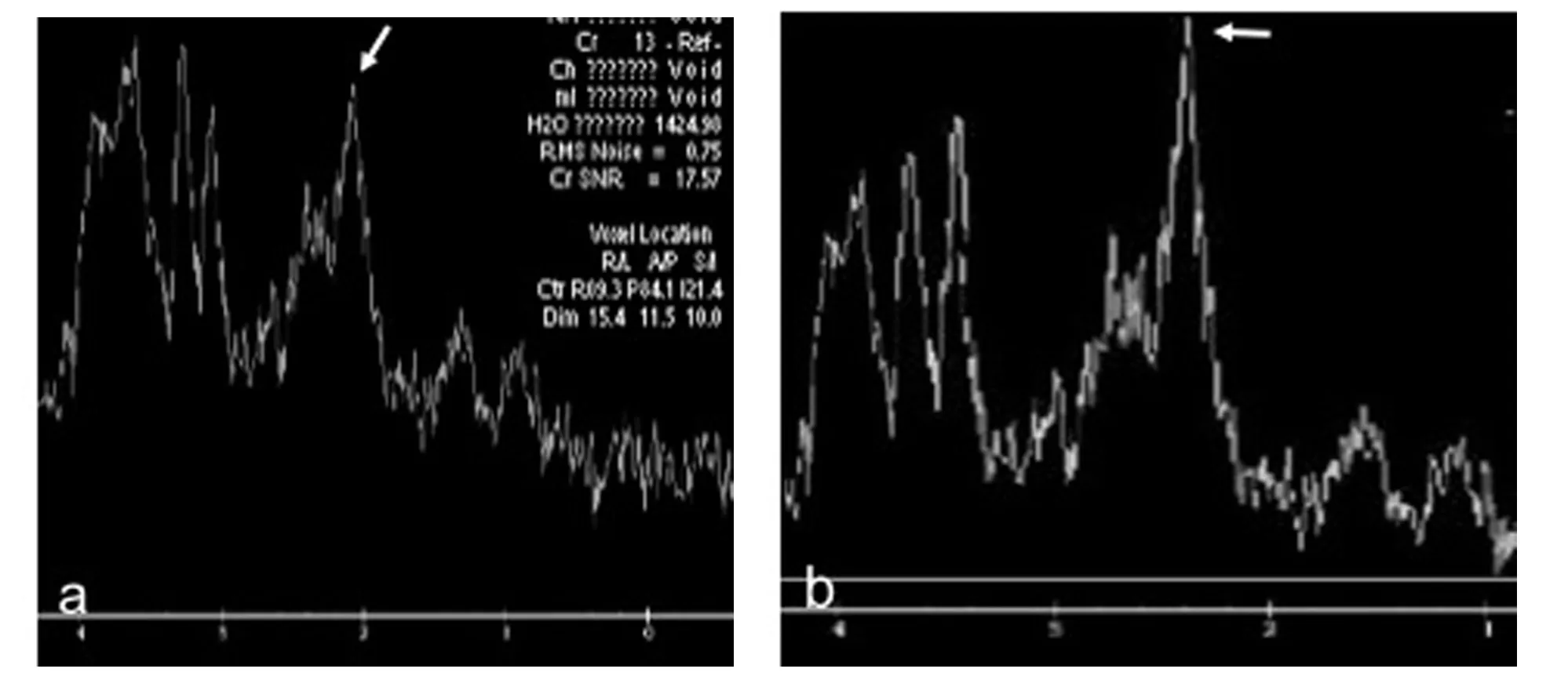
图2 T2DM 实验组和对照组右侧海马1H-MRS a.T2DM 实验组;b.对照组Fig.2 1H-MRS of T2DM experimental group and control group right hippocampus a.T2DM experimental group;b.control group

表3 T2DM 实验组与对照组双侧海马NAA 值曲线下面积(mmol/kg)t 检验Table 3 Area under the curve of NAA value in the hippocampus of T2DM experimental group and control group(mmol/kg)t test
2.6 T2DM 实验组与对照组双侧海马组织学表现
HE 染色可见T2DM 实验组较对照组大鼠海马组织出现大量淀粉样物质沉着,细胞质和间质均有红染(图3).
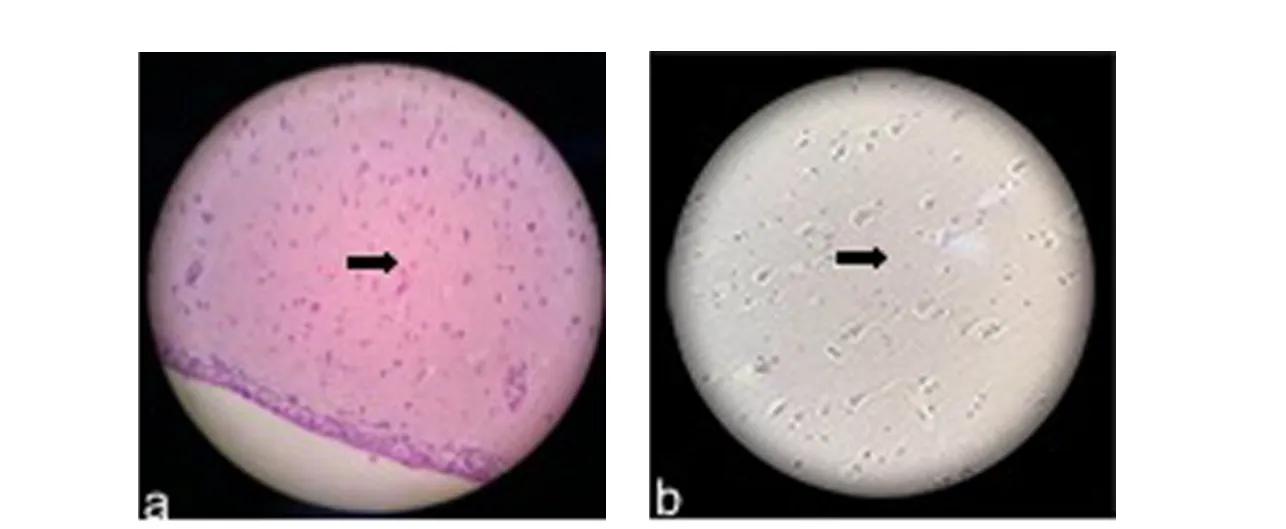
图3 HE 染色下T2DM 实验组大鼠海马组织大量淀粉样物质沉着(20μm)a.T2DM 实验组;b.对照组Fig.3 Under HE staining,a large number of amyloid structures were observed in the hippocampus of the T2DM experimental group(20μm)a.T2DM experimental group;b.control group
3 讨论
T2DM 和AD 都是全球较常见的疾病,其中老年人群中T2DM 和AD 的发病率在快速增加.因此,探讨T2DM 病理基础,发现一种有效、可靠诊断T2DM 的方法不仅对T2DM 的防治具有重要意义,同时也可能是有效预防和治疗AD 的重要策略之一[15].由于老年人群中难以取得单一变量的T2DM 脑损伤海马标本做病理对照,因此本研究通过高水平血糖、胰岛素、HOMA以及大鼠的认知功能受损来验证T2DM 的大鼠模型(表1).该方法具有T2DM 的特征和发病机制,可重复且易于制作,并且与老年患者的T2DM 表现有高度的相似性[16].本研究中T2DM 实验组与对照组大鼠均注射了同等剂量的戊巴比妥[9],以避免戊巴比妥本身有可能导致的记忆障碍,因此结果可信度较高.
NAA 能够反映神经元数量及完整性,其主要存在于神经元及轴突内,与神经元的数量呈正比;已有研究表明神经元或轴突的缺失会导致NAA 的减低,而这种减低独立相关于与T2DM 的发展[17].本研究结果显示,T2DM 实验组较对照组双侧海马的NAA 值均降低,且差异具有统计学意义(p <0.05),与马晓臣等[18]部分结果相似.因此我们推测其可能的机制为:T2DM 导致神经元细胞葡萄糖供给不足,促使NAA 合成不足,诱发神经细胞损伤,进而表现出脑损伤.
能量代谢中起缓存作用的Cr 是磷酸肌酸的标志物,主要为神经细胞提供能量,常作为脑血流量的反映,相对较稳定.本研究结果中双侧海马区的NAA 的变化差异显著,但是NAA/Cr 的变化差异并没有统计学意义(P >0.05),与Manon Brundel[19]等人的研究结果部分一致.表明NAA 可以提示不同病程及病情的T2DM 对神经元损伤程度,而且NAA 相比NAA/Cr,其少了Cr 变量的影响,变化程度少,其表现也更为敏感、直观.本课题前期研究表明,在T2DM 伴/不伴随认知功能障碍、正常对照组三组中,海马区域的NAA 值是依次降低的[13,20-21],表明海马NAA 值也许可作为评价认知受损的重要指标之一,同时其数值的减低也可推测两侧海马神经元数目随着T2DM 患者认知功能的减退而降低.因此,糖尿病脑损伤,尤其是海马区域损伤的早期诊断及其病理机制的探索显得尤为重要.
在本研究中T2DM 实验组大鼠海马NAA 值的变化经偏侧性分析显示其偏向于左侧海马,与Morris水迷宫测试中学习潜伏期呈负相关,与记忆潜伏期呈正相关,且经组织病理学显示,T2DM 实验组大鼠海马组织有大量淀粉样物质沉着,表明在T2DM 实验组大鼠中,海马区域不仅有功能性的改变,还有组织学的改变,与既往文献报道一致[22],Van[15]等的动物实验中也证实T2DM 组动物海马区会有突触的功能重组性改变.且文献报道T2DM 患者的空间学习记忆缺陷[23]也与其有相关性.高血糖所致的Ca2+通道的过度开放、无氧酵解等均可能破坏血脑屏障,从而导致神经、胶质细胞损伤,这种损伤性改变就可由1HMRS 检测中的NAA 特异性的体现.
本研究中Cho/Cr 值变化无统计学意义(P >0.05),与张海燕等[23]的结果一致,但是与马晓臣等[18]和Li YL[24]等的结果不一致.原因可能是Cho、Cho/Cr反映细胞膜代谢的相关情况,细胞膜的崩解常伴随着细胞膜卵磷脂分解-合成过程.当血糖浓度较高时,脑组织的损伤仅为细胞内破坏,或脑组织不可逆性损伤被脑细胞抵抗或修复时,脑细胞的细胞膜并未出现大量崩解,此时Cho、Cho/Cr 值的变化就不明显.
已有研究表明,神经细胞相对较晚期的表现之一为神经细胞胶质增生,而mI 及mI/Cr 可以反映神经细胞胶质增生的水平[24],mI 在T2DM 受试者在不同脑区可出现不同的改变[25],其原因可能为mI 对机体高血糖环境所作出的应激反应,进而出现不同区域的血管基底膜破坏,从而表现出上述改变.本研究显示T2DM 实验组双侧海马mI、mI/Cr 值较对照组有差异,但是差异无统计学意义(P >0.05),与Makimattila[26]等的报道相似.本实验观察发现这种变化提示mI 呈升高到转归的趋势,可以在今后的研究中纵向对比观察.
综上所述,长期的高糖环境、小血管异常及缺血性改变等会导致淀粉样物质沉积,进而引起神经元、神经递质的受损,最终出现脑认知功能障碍,这可能正是T2DM 患者认知功能障碍的病理过程之一.作为一种生物学指标,双侧海马区的NAA 值可准确、直观的对T2DM 大鼠脑损伤及其程度作出评估.在今后的临床工作中,1H-MRS 亦可作为诊断T2DM 患者脑损伤的一种有效影像学手段.
