血小板衍生生长因子受体抑制剂CP-868596对A549细胞毒性的影响及机制
2019-11-13刘冰杨智承袁芳
刘冰 杨智承 袁芳
广东药科大学药学院(广州510006)
肺癌类型包括非小细胞肺癌(non-small cell lung cancer,NSCLC)和小细胞肺癌(small cell lung cancer,SCLC),其中NSCLC 占80% ~85%[1]。针对NSCLC,由于肺癌患者遗传背景的复杂性,以及现有靶向药物耐药等问题,导致目前治疗效果仍然不佳[2]。血小板衍生生长因子受体(platelet-derived growth factor receptor,PDGFR)在大多数细胞中均有表达,特别是在间质细胞高度表达和活跃,如成纤维细胞和平滑肌细胞。PDGF/PDGFR 信号通路可调控肿瘤细胞的增殖、分化和迁移,然而其抑制剂的抗NSCLC 作用研究仍然匮乏[3]。本研究在非小细胞肺癌A549 细胞上,探讨PDGFR 抑制剂CP-868596 的细胞毒性作用及其分子机制,以期为其临床使用提供实验依据。
1 材料与方法
1.1 材料实验中所用的培养基和胎牛血清(fetal bovine serum,FBS)均购自Gibco 公司;CP-868596购自selleck 公司;细胞转染试剂Lipofectamine 2000 购Invitrogen 公司;兔抗人Nrf2 一抗、磷酸化Akt 一抗、内参β-tubulin 购自Abcam 公司以及羊抗兔二抗购自Proteintech 公司;DCFH-DA、MTT 均购于Sigma 公司;其余试剂均为国产分析纯。
1.2 细胞培养A549 细胞和BEAS-2B 细胞购于ATCC 细胞库。将A549 细胞在含有10%胎牛血清的DMEM 培养基中培养,并将BEAS-2B 细胞在含10%胎牛血清的1640 培养基中培养,培养在37 ℃,含5%CO2的细胞培养箱内。
1.3 MTT 实验将对数生长期的细胞接种于96 孔板中,待24 h 贴壁后依次加入浓度梯度为0~200 nmol/L 的CP-868596,持续孵育48 h ,每孔加入MTT 溶液(5 mg/mL)10 μL 继续培养4 h,去上清,每孔加150 μL 的DMSO 溶液,待完全溶解后,于570 nm 处检测OD值。
1.4 细胞凋亡检测各组收取CP-868596 浓度为0、10、20 、40 nmol/L 处理24 h 后的A549 细胞,使用在4 ℃冰箱预冷后的PBS 洗涤,重复2 次,将洗涤后的细胞重悬于250 μL 的结合缓冲液中。在5 mL 的流式管中加入100 μL 的细胞悬液,在管中加入Annexin-V FITC 5 μL,之后避光继续加入20 μg/mL 的碘化丙锭溶液10 μL。混合后,在室温下避光孵育15 min,向管中加PBS 400 μL,并通过流式细胞仪分析。
1.5 Caspase-Glo 3/7(Promega)检测A549 细胞以种于96 孔板中培养箱孵育过夜。用CP-868596预处理48 h 后,加入Caspase-Glo 3/7 试剂,在37 ℃恒温孵育90 min,使用荧光分光光度计测得荧光素酶发光强度。
1.6 免疫荧光法检测ROS 的含量生长融合至
70%左右的96 孔板内的A549 细胞经不同浓度CP-868596 或继续处理24 h 后,加入10 μmol/L DCFH-DA,37 ℃避光孵育30 min。PBS 洗涤细胞2 次,并将样品置于荧光酶标仪下检测荧光强度,488 nm 激发和525 nm 发射。
1.7 免疫印迹将A549 细胞接种于6 孔板中待24 h 后用CP-868596 48 h 后收集细胞,并向每孔中加入100 μL 的蛋白裂解液。BCA 试剂盒用于测定和定量蛋白,并计算总蛋白质的量。然后进行电泳、转膜。用5%脱脂牛奶配置TBST,在室温下封闭1 h,并加入稀释好的Nrf2 一抗(1∶1 000),在4 ℃冰箱内孵育过夜。用TBST 洗膜3 次,每次5 min,加4 mL 稀释的羊抗兔二抗(1∶5 000),室温孵育1 h,TBST 洗膜,方法同上。然后加入化学发光液,在X 线片暗室进行显影及定影操作。
1.8 qRT-PCR 检测Nrf2 mRNA 的表达使用
Trizol 试剂从A459 细胞中提取总RNA,然后合成cDNA。实时定量RT-RCT 使用SYBR Green Realtime PCR Master Mix(TOYOBO,日本,QPK-201)。使用ΔΔCT 法扩增基因,并使用GAPDH 作为内参。用于实时定量PCR 引物见表1。
1.9 ARE-萤光素酶报告基因测定使用双荧光素酶报告基因检测法(Dual-Luciferase Reporter Assay System)检测样品对Nrf2-ARE 信号传导途径活性的影响。将处于对数生长期的A549 细胞接种于24 孔板中待24 h 细胞贴壁后,用Lipofectamine2000 转染含有荧光素酶报告基因的ARE-Luc 和pTK -Renilla 内参质粒,继续培养18 h 后用药物孵育2 h,除去上清液,并将细胞在室温下振荡15 min,通过离心收集上清液,并使用双报告基因检测试剂盒测定双荧光素酶活力。
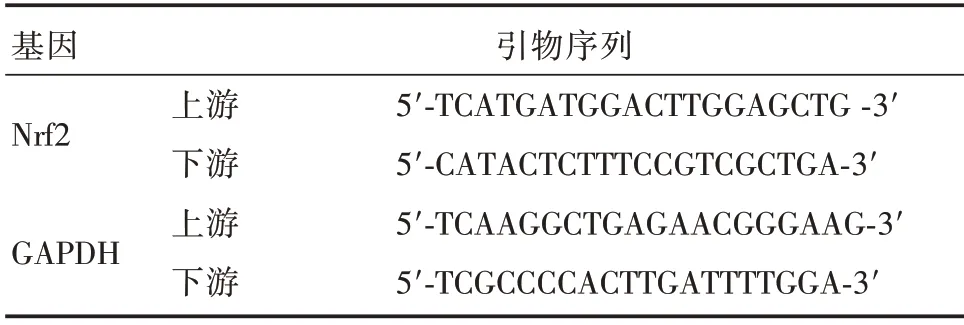
表1 引物序列表Tab.1 Primers sequences
1.10 统计学方法采用JMP 7.0 统计学软件进行统计分析,计量资料表示为均数±标准差,组间比较行独立样本t检验,多组间均数比较采用方差分析,以P<0.05 为差异有统计学意义。
2 结果
2.1 CP-868596 抑制A549 细胞增殖,并诱导细胞凋亡用不同浓度梯度的CP-868596 作用于A549细胞和BEAS2B 细胞48 h,测得CP-868596 抑制A549 的IC50为54.94 nmol/L,抑 制BEAS2B 细胞IC50为166.14 nmol/L(图1A)。图1B 和1C 表明通过流式细胞术和caspase3/7 活性检测法,发现在CP-868596 作用24 h 后,可导致A549 细胞凋亡。
2.2 CP-868596 升高A549 内ROS 的含量CP-868596 可呈剂量依赖性升高A549 细胞内的ROS含量(图2A)。结果表明在给予ROS 清除剂NAC后(25 μmol/L),可逆转CP-868596 对A549 的凋亡诱导作用(图2B、C)。
2.3 CP-868596降低A549细胞中Nrf2的表达与空白对照组比较,用CP-868596 处理的A549 细胞中Nrf2 蛋白表达降低(图3A)。CP-868596 影响A549 细胞Nrf2 的mRNA 水平(图3B)。同样CP-868596 也可抑制A549 细胞中ARE-Luc 的表达(图3C)。此外,CP-868596 减低Nrf2 靶基因HO-1和HQO-1 的mRNA 表达水平(图3D、E)。这些结果表明CP-868596 引起A549 细胞凋亡和ROS 升高是通过抑制Nrf2 而实现的。
2.4 tBHQ(Nrf2 激活剂)可逆转CP-868596 对A549 细胞凋亡和ROS 水平的影响通过ARE 检测,发现tBHQ 呈剂量依赖性增加A549 中Nrf2 的活性(图4A)。tBHQ(20 μmol/L)可逆转CP-868596对A549细胞凋亡和ROS的影响(图4B~4D)。
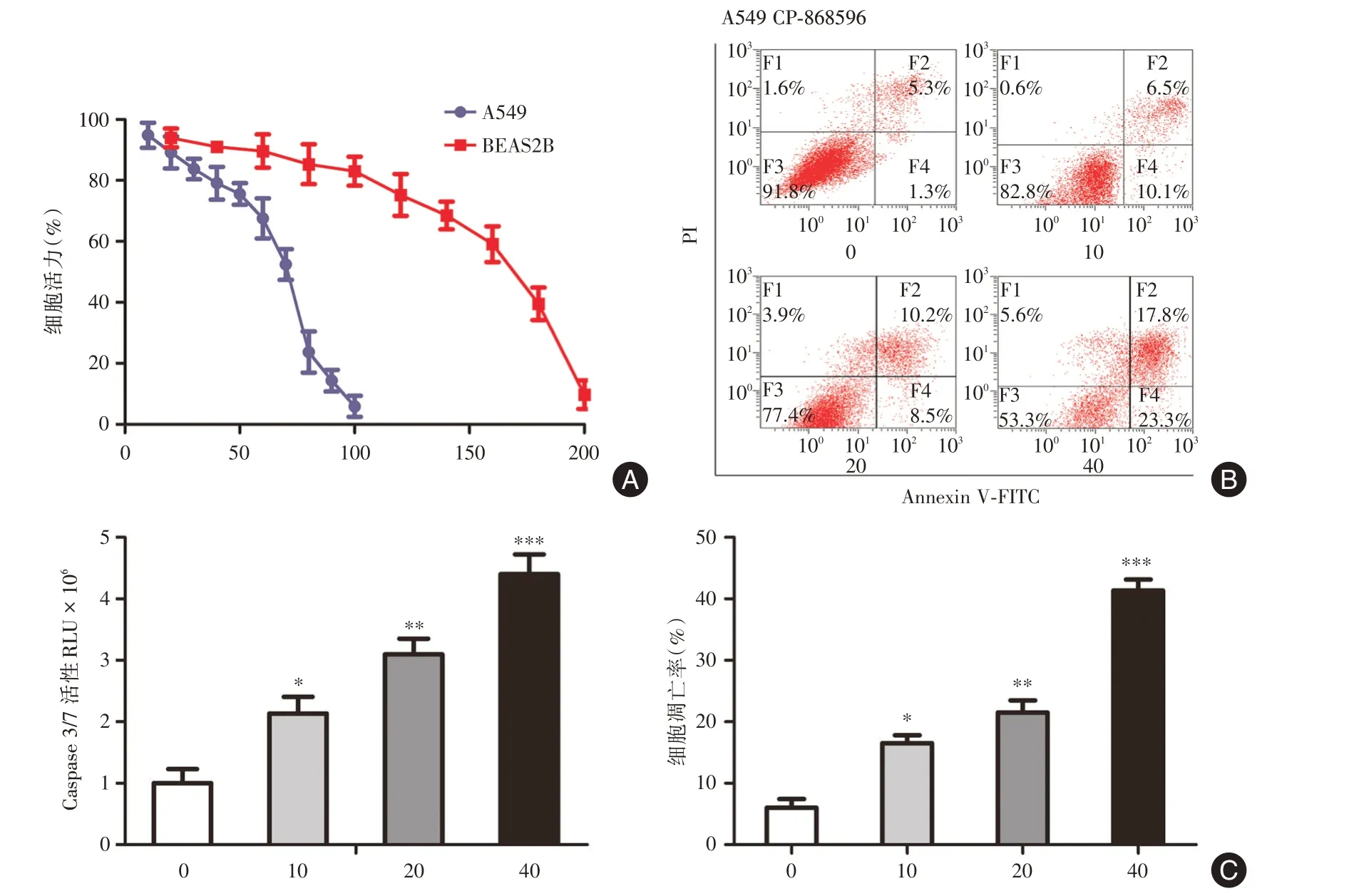
图1 CP-868596 对A549 细胞增殖及凋亡的影响Fig.1 The effects of CP-868596 on proliferation and apoptosis of A549 cells

图2 CP-868596 升高A549 细胞内ROS 的含量导致细胞凋亡Fig.2 CP-868596 induced A549 cell apoptosis via stimulation of ROS production
2.5 CP-868596 通过PI3K/Akt 通路抑制Nrf2 的表达CP-868596 可抑制A549 细胞中磷酸化Akt的表达水平(图5A)。在LY294002(PI3K/Akt 通路抑制剂)作用A549 细胞后,Nrf2 和p-Akt 的表达减低;然而,在用LY294002 抑制PI3K/Akt 通路基础上加药CP-868596,不能进一步减低Nrf2 和p-Akt的表达水平(图5B)。
3 讨论
PDGF/PDGFR 的过表达或PDGFR 的激活突变导致的异常PDGFR 信号传导已被证实在多种肿瘤的发生中起关键作用[4]。在非小细胞肺癌中,PDGFR 由基质细胞以及一部分癌细胞大量表达[5]。以往的实验室研究和临床试验已经证实CP-868596 对胃肠道间质瘤和人急性髓系白血病有较好的治疗作用[6-7]。本研究中发现,CP-868596可诱导A549 细胞凋亡呈剂量依赖性,此外,对正常肺上皮细胞BEAS2B 毒性较低(IC50值较高),该结果表明PDGFR 抑制剂CP-868596 对NSCLC 细胞有较好的选择性杀伤作用。

图3 CP-868596 抑制A549 细胞中Nrf2 的表达Fig.3 CP-868596 inhibited Nrf2 expression in A549 cells

图4 tBHQ 可逆转CP-868596 对A549 细胞凋亡和ROS 水平的影响Fig.4 CP-868596 inhibited Nrf2 expression through suppression of PI3K/Akt pathway

图5 CP-868596 通过PI3K/Akt 通路抑制Nrf2 的表达Fig.5 CP-868596 inhibited Nrf2 expression through suppression of PI3K/Akt pathway
研究表明ROS 的过量产生介导了许多药物诱导癌细胞凋亡、坏死和自噬等效应[8-9]。因此,本研究首先检测CP-868596 是否可诱导NSCLC 细胞内ROS 生成。结果表明CP-868596 可使A549 细胞内ROS 的含量随着药物浓度的增加而明显升高。此外,使用抗氧化剂NAC 消除ROS 可显著拮抗CP-868596 诱导A549 细胞凋亡的作用。上述结果表明CP-868596 促进A549 细胞中ROS 大量生成,介导了其诱导癌细胞凋亡作用。
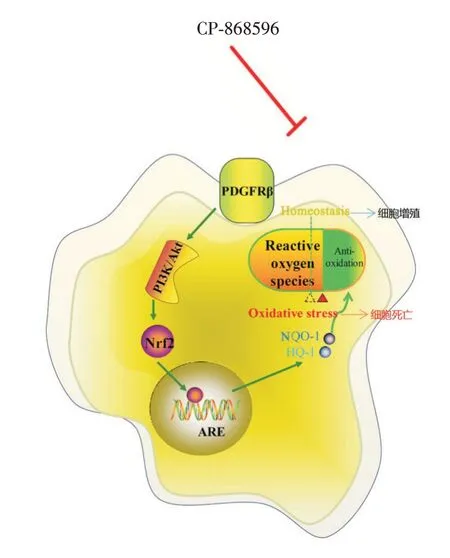
图6 本研究机制通路图Fig.6 The mechanical graphic abstract of this study
Nrf2 是细胞中调控抗氧化反应的重要转录因子,可减低细胞内ROS 水平以维持细胞内氧化还原平衡[10]。PDGFRβ属于受体酪氨酸激酶(RTKs)家族成员,RTKs中许多成员,如表皮生长因子受体,通过激活Nrf2 调控癌细胞中ROS 产生[11]。因此,笔者推测抑制PDGFR 可能通过抑制Nrf2 升高细胞内ROS 水平。本研究发现CP-868596 可显著减低Nrf2 的表达(包括mRNA 和蛋白水平),Nrf2 激动剂tBHQ 可逆转CP-868596 对细胞内ROS 的激发作用;进一步研究发现Nrf2 激动剂tBHQ 可拮抗CP-868596 的诱导凋亡效应。上述结果表明CP-868596 通过抑制Nrf2 的转录表达从而上调癌细胞内ROS 水平,从而诱导癌细胞凋亡。
PI3K/Akt信号是公认的PDGFR下游效应子[12],且有研究表明PI3K/Akt 信号激活可诱导细胞中Nrf2 表达并增强其活性[13-14]。本研究发现CP-868596 抑制A549 细胞中PI3K/Akt 通路活性;PI3K/Akt 通路抑制剂LY294002 可抑制Nrf2 表达,产生类似CP-868596 的作用,此外,当用LY294002 抑制PI3K/Akt 通路后,CP-868596 不再产生额外抑制Nrf2 表达作用。这些结果充分表明了CP-868596通过抑制A549 细胞中PI3K/Akt 通路抑制Nrf2表达。
综上,本研究表明,PDGFR 抑制剂CP-868596可通过抑制A549 细胞中PI3K/Akt/Nrf2 轴,使得抗氧化信号受阻,进而导致ROS 在A549 细胞中大量累积,最终导致细胞凋亡(图6)。因此,CP-868596可能是潜在有效的抗NSCLC 的辅助治疗药物。
