吸烟对慢阻肺患者血清S100A8/A9、8-异前列腺素F2α、组织蛋白酶S及其它炎症因子表达水平的影响*
2019-11-12张军营
张军营
陕西省商洛市中心医院呼吸内科(商洛726000)
慢性阻塞性肺疾病(COPD)是呼吸内科常见的以气流持续性受限为特征的慢性疾病,具有较高的临床患病率及病死率,严重威胁到人类,尤其是中老年人群的身心健康。据统计报告显示,预计截至2020年,COPD将在全球死亡危险因素中位居第3位[1]。关于COPD发病机制尚未完全明确,慢性气道炎症是目前学术界接受度较高的COPD发病机制[2]。烟草中的烟碱等有机成分及吸烟形成的颗粒是导致COPD发生发展的独立危险因素。但关于吸烟在COPD发生发展中的具体机制尚未清楚。但临床存在关于不同组织或器官中钙结合蛋白S100A8/A9、8-异前列腺素F2α(8-iso-PG F2α)、组织蛋白酶S(cath-S)及炎症因子表达水平与COPD发生发展相关性的报道较多[3-5]。而关于吸烟对COPD患者血清中上述因子表达水平影响的研究较罕见。笔者通过测定比较不同群体血清S100A8/A9、8-iso-PG F2α、cath-S及炎症因子表达水平间的关系,旨在探讨吸烟对COPD患者机体相关酶类及细胞因子的影响。
资料与方法
1 一般资料 将2016年5月至2019年1月本院呼吸内科收治的185例COPD患者(观察组)和94例同期体检的健康志愿者(对照组)纳入研究。依据是否吸烟将其分为观察A组(不吸烟者48例)、观察B组(吸烟者137例)和对照A组(不吸烟者29例)、对照B组(吸烟者45例)。对照A组,男21例、女8例;年龄55~83岁,平均(68.41±8.66)岁。对照B组,男34例、女11例;年龄57~85岁,平均(68.52±8.61)岁。观察A组,男33例、女15例;年龄55~84岁,平均(68.32±8.75)岁。观察B组,男97例、女40例;年龄59~81岁,平均(68.83±8.29)岁。四组受试者性别及年龄间差异不存在统计学意义(P>0.05),后续研究具有可比性。纳入标准:COPD符合中华医学会制定的《慢性阻塞性肺疾病诊断标准》[6]中相关内容;对照组肺功能和X线胸片检查结果均显示正常;55岁≤年龄≤85岁;吸烟者即具有10年及以上吸烟史,且期间无戒烟史,平均日吸烟量≥2支;心肝肾功能正常;近3个月内无手术治疗史。排除标准:合并其他慢性呼吸系统疾病;责任护士告知研究意义后不愿参与研究者。
2 研究方法
2.1 样本采集及血清指标测定:受试者均于清晨8~9时空腹状态下抽取其静脉血样5 ml,加入生化管中,3000 r/min离心10 min,收集血清,并存放于-80℃下待测定S100A8/A9、8-iso-PG F2α、cath-S和肿瘤坏死因子-α(TNF-α)、白细胞介素-8(IL-8)、IL-10、IL-17。其中S100A8/A9、8-iso-PG F2α、TNF-α、IL-8、IL-10、IL-17均采用酶联免疫吸附法测定;cath-S选择双抗体夹心法测定。其中S100A8/A9试剂盒购自于上海将来实业股份有限公司;其余试剂盒购自于南京森贝伽生物科技有限公司。
2.2 肺功能检测:所有受试者于采集血样当日清晨进行肺功能检测,切记24 h禁用气管扩张类药物。检查开始前患者静止休息20 min,并取坐位,完成5次用力呼气,观察仪器的流速容量曲线,记录受试者第一秒用力呼气容积(FEV1)、用力肺活量(FVC),并计算FEV1占预计值的百分比(FEV1prep%)和FEV1/ FVC。
3 统计学方法 性别分析采用SPSS 17.0统计学软件中的卡方分析;其余计量资料两组间比较行t检验,多组间分析选择单因素方差分析,两两组间比较行LSD法;相关性分析选择Pearson相关性。P<0.05为差异存在统计学意义。
结 果
1 四组受试者血清S100A8/A9、8-iso-PG F2α、cath-S及肺功能指标比较 见表1。四组受试者血清S100A8/A9、8-iso-PG F2α、cath-S及FEV1prep%、FEV1/FVC间差异存在统计学意义(P<0.01)。两两组间比较,S100A8/A9、8-iso-PG F2α、cath-S水平是对照B组明显高于对照A组 、观察A组明显高于对照B组、观察B组明显高于观察A组(P<0.05);FEV1prep%、FEV1/FVC则是对照B组明显低于对照A组 、观察A组明显低于对照B组、观察B组明显低于观察A组(P<0.05)。
2 四组受试者其它血清炎症因子表达水平比较 见表2。四组受试者血清炎症因子TNF-α、IL-8、IL-10、IL-17水平间差异存在统计学意义(P<0.01)。两两组间比较,TNF-α、IL-8、IL-17水平是对照B组明显高于对照A组、观察A组明显高于对照B组、观察B组明显高于观察A组(P<0.05);IL-10水平则是对照B组明显低于对照A组 、观察A组明显低于对照B组、观察B组明显低于观察A组(P<0.05)。
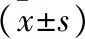
表1 四组受试者血清S100A8/A9、8-iso-PG F2α、cath-S及肺功能指标比较
注:与对照A组比较,*P<0.05;与对照B组比较,△P<0.05;与观察A组比较,▲P<0.05
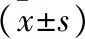
表2 四组受试者其它血清炎症因子表达水平比较
注:与对照A组比较,*P<0.05;与对照B组比较,△P<0.05;与观察A组比较,▲P<0.05
3 COPD患者血清学指标表达水平与吸烟指数和吸烟总量相关性 见表3。Pearson相关性分析显示,血清S100A8/A9、8-iso-PG F2α、cath-S、TNF-α、IL-8、IL-17与吸烟指数、吸烟总量均呈显著正相关(P<0.01);而IL-10与吸烟指数、吸烟总量均呈显著负相关(P<0.01)。
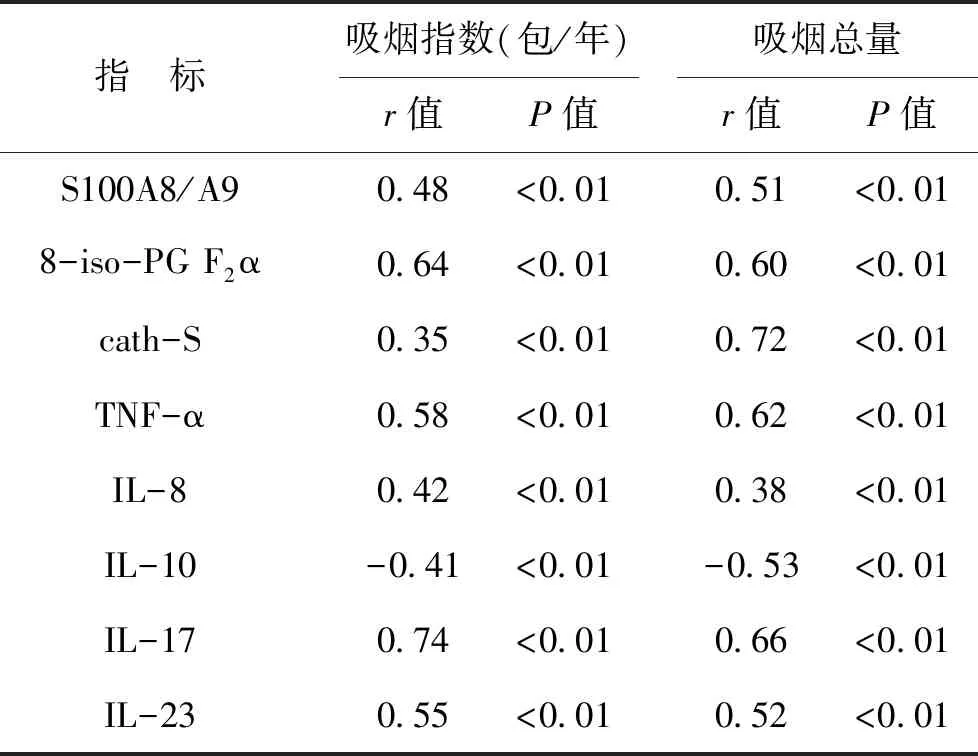
表3 COPD患者血清学指标表达水平与吸烟指数和吸烟总量相关性
讨 论
曹远等调查显示,北京地区15岁以上人群吸烟率达27.5%,65岁以上高达51.2%;男性为43.2%[7];2013年,曹晓晓等[8]对2014年西安市流动人口吸烟状况进行调查分析显示,西安市流动人口标化吸烟率为36.47%,男性高达68.65%;王欢[9]、姜乐等[10]对西安市城区居民吸烟情况进行调查分析,结果显示西安市城区年龄15岁以上人群吸烟率达20.6%~37.8%,男性吸烟率高达40%~58.8%,女性达10.5%。且越来越多报道显示,诸如哮喘、COPD等多种呼吸系统疾病发生发展与吸烟存在相关性,COPD患病人群吸烟率高达66%,且患病率与吸烟指数密切相关[11-12]。
目前,国内针对COPD吸烟患者细胞因子的研究报道较少。以往报道显示,COPD患者气道中的中性粒细胞数目与其吸烟行为密切相关。香烟烟雾中的颗粒性物质可激活人体肺泡组织中的巨噬细胞,促进TNF-α、IL-6、IL-8等趋化介质的合成释放,从而放大机体炎症反应[13-14]。巨噬细胞在COPD患者体内气道炎症、气道阻塞及重建等发生发展中扮演重要角色,肺泡的破坏程度、肺气肿程度等与肺泡璧上的巨噬细胞数目呈显著正相关。此外,Geraghty等[15]报道显示,香烟烟雾通过激活原癌基因c-Src,促进COPD的发生发展。S100A8/A9是主要定位于胞质中的蛋白,其在细胞内具有调节钙平衡、分子磷酸化和细胞周期、细胞生长和迁移等作用;细胞外则是作为机体固有免疫反应成分,通过诱导中性粒细胞趋化及粘附,参与多种炎症反应性疾病的发生发展。陈小菊等[3]报道显示,COPD患者血浆和诱导痰液中S100A8/A9浓度显著高于健康人群,尤其在急性加重期其表达水平更高,且其与患者肺功能呈明显负相关。冷长燕[16]在大鼠实验研究中发现,COPD大鼠肺组织中、血浆和支气管肺泡灌洗液中S100A8/A9水平均明显升高,提示烟熏可刺激S100A8/A9在肺组织中的表达与释放,后者通过上调Toll样受体4(TLR4)和髓样分化分子88(MYD88)表达,启动参与TLR4-MYD88炎症通路,促进COPD发生发展。IL-10属于抑炎因子,通过抑制单核巨噬细胞的增值和粘附,下调TNF-α、IL-8、IL-6、IL-17等促炎因子合成释放,从而下调炎症反应。IL-17由T淋巴细胞亚群CD4+分泌,为诸多炎症因子的起始因子,可诱导上皮细胞、内皮细胞等合成IL-8等,促进炎症反应。Bozinovski等[17]通过小鼠试验研究显示,IL-17A可调节吸烟引起的COPD患鼠体内巨噬细胞的积累。本研究结果显示,COPD患者及健康人群中的吸烟者其血清促炎因子S100A8/A9、TNF-α、IL-8、IL-17水平显著高于同类人群中的非吸烟者,COPD吸烟患者血清S100A8/A9、TNF-α、IL-8、IL-10、IL-17水平显著高于健康体检人群中吸烟者;而抗炎因子IL-10及肺功能指标FEV1prep%、FEV1/FVC变化趋势与促炎因子刚好相反;且促炎因子S100A8/A9、TNF-α、IL-8、IL-17表达水平与其吸烟指数和吸烟总量呈显著正相关,抗炎因子IL-10与吸烟指数和吸烟总量呈显著负相关。表明吸烟加剧COPD患者机体抗炎与促炎因子失衡,加剧机体炎症反应,进一步损伤患者肺功能。该结果与曾金洁等[18]分析吸烟对COPD患者IL-17、IL-23、肽素水平得出结论相吻合。
氧化与抗氧化反应失衡、氧化应激等亦属于COPD重要发病机制。8-iso-PG F2α是花生四乙烯在氧化自由基作用下产生的前列腺素异构体,被认为是反应机体氧化应激程度的良好指标。临床实践发现,COPD急性加重期机体8-iso-PG F2α、过氧化氢等氧化因素水平显著升高,而在恢复期显著下降,提示,在COPD气道病变中存在氧化应激反应[19]。吸烟行为可引起气道氧化应激。刘中生等[20]报道显示,吸烟可使人体血清8-iso-PG F2α水平升高,且其血清含量与吸烟量存在显著相关性。孙丽娟等[21]研究显示,吸烟可使COPD患者痰液中8-iso-PG F2α和TNF-α水平上升,抑制抗炎因子IL-10释放,且8-iso-PG F2α和TNF-α表达水平与患者FEV1、FEV1/FVC呈明显负相关。此外,COPD发生发展与机体内免疫功能紊乱等存在明显相关性。cath-S是细胞溶酶体分泌的半胱氨酸蛋白酶,其在多种细胞及组织内以基础水平存在。cath-S多在表达组织相容性复合物的细胞中表达,可降解细胞外的正常蛋白,在抗原递呈、炎症免疫、损伤等过程中扮演重要角色,与自身免疫性疾病、慢性炎症疾病等多种疾病发生发展及转归息息相关。Martin等[22]发现在囊性肺纤维化患者体内cath-S出现明显异常,且与TNF-α、IL-8等存在明显相关性。徐辉等[5]研究显示,COPD患者血浆cath-S含量显著高于健康人群,且其升高较胱抑素C更为明显,提示,cath-S可作为筛选评估COPD发生及严重程度的潜在生物学标志物。本研究显示,COPD患者及健康人群中的吸烟者其血清8-iso-PG F2α、cath-S水平显著高于同类人群中的非吸烟者,COPD吸烟患者血清8-iso-PG F2α、cath-S水平显著高于健康体检人群中吸烟者;且COPD吸烟患者血清8-iso-PG F2α、cath-S均与其吸烟指数和吸烟总量呈明显正相关。表明,吸烟可通过增强机体氧化应激反应,加剧氧化与抗氧化失衡,促进免疫失衡等多种途径,促进COPD发生发展。
综上所述,吸烟会严重影响COPD患者血清S100A8/A9、8-iso-PG F2α、cath-S及TNF-α、IL-8、IL-10、IL-17的合成释放,损伤患者肺功能,从而促进COPD的发生发展。
