苹果矮化砧木品种Bud9组织培养技术研究
2019-11-11王婷婷胡春宏常苹季翔
王婷婷 胡春宏 常苹 季翔

摘 要:于晴朗的早春上午采取苹果矮化砧木品种‘Bud9当年生顶芽作为外植体,通过消毒、萌芽、增殖、生根过程建立组织培养体系。试验结果显示最适宜‘Bud9组培苗增殖的培养基为改良MS(NH4NO3和KNO3减半)+6-BA(0.5mg/L)+KT(0.5mg/L)+GA3(1.0mg/L)+蔗糖(30g/L)+琼脂(7g/L),增殖倍率可以达到3.23。增殖后的组培苗转入生根培养基WPM+IBA(1.2mg/L)+蔗糖(20g/L)+琼脂(7g/L)中进行生根培养,生根率可以达到95.14%。
关键词:苹果矮化砧木;Bud9;组织培养
中图分类号:S661.1
文献标识码:A
DOI:10.19754/j.nyyjs.20191015012
苹果矮化砧木品种‘Bud9(Budagovsky 9或者B.9)是前苏联从M.8 x Red Standard(Krasnij Standart)杂交而来的一种新的矮化砧木,因其耐寒性而在俄罗斯中部平原的米彻林斯克学院发展起来。该品种叶子呈现出独特的红色,我国石家庄于1993年引进试种,‘Bud9砧木树种体型相当于乔砧的45%,花期和果期较早,嫁接红富士着色好[1]。
矮化密植是世界苹果发展的趋势和方向,现代农业果园通过种植矮化砧木,有利于果树提早结果,增加产量,以及改善果实的品质[2-3]。通过将高产的接穗嫁接于矮化砧木来控制苹果树形的方法用于苹果生产已经有2000多年的历史,矮砧栽培在我国引入较早,但发展缓慢,目前我国矮砧栽培面积占总栽培面积的不足10%,矮化砧木具有广泛的应用前景。
利用组织培养方式对苹果砧木‘Bud9进行工厂化繁殖,可以不受季节限制在短时间内得到性状一致长势整齐的植株[4-5]。目前国内对于苹果砧木品种‘Bud9组培体系建立的研究还处在空白阶段。本试验建立了系统高效的‘Bud9组培快繁体系,同时为之后进行的苹果矮化砧木组培苗脱病毒试验奠定基础,在不远的将来为国内市场提供大量的优质脱病毒组培苗。
1 材料与方法
1.1 试验材料
苹果矮化砧木品种‘Bud9外植体采自于温室盆中两年生的扦插苗,在取材前需要对母本喷洒一定质量浓度的杀虫杀菌剂以减轻消毒难度,同时需要對母本进行适当的修剪施肥以促进植株长势[6]。试验于2017年4月开始,试验地点为江苏省无锡市高科技农业示范园内的组培研发室。
于晴朗的早春上午,选取生长旺盛无病虫害的母株作为母本,剪取枝条顶端2~3cm的带顶芽茎段,去掉叶片后放入密封袋中保存。剪取外植体当天早上应停止浇水,防止因湿度太大造成的外植体污染。
1.2 外植体消毒
剪取的外植体首先在超净工作台上用75%酒精浸润过的脱脂棉擦除表面灰尘,然后用20%的消毒试剂(市售漂白水,有效成分为次氯酸钠)浸泡40min,使用无菌去离子水洗涤4~5次,直至水较为清澈为止,最后使用添加有300mg/L的抗坏血酸溶液浸泡3min左右,以最大程度的减轻外植体褐化现象。
1.3 组培体系的建立
1.3.1 不定芽萌发
消毒后的外植体在超净工作台上切去末端被消毒试剂腐蚀的部分,保留顶芽及其下部1节的外植体,接种到装有MS+6-BA(0.7mg/L)+IBA(0.1mg/L)+ GA3(1.0mg/L)萌芽培养基的培养瓶中,每瓶一个顶芽。接种成功的培养瓶首先置于9 ℃培养箱中避光培养1d,之后的3d内将温度逐渐提高至15 ℃,待植物适应培养基环境后转入培养室中进行后续培养。
1.3.2 不定芽增殖
采用2因素3水平的完全随机试验方法,研究不同植物生长调节剂配比对组培苗不定芽增殖的影响。所用的基础培养基为改良MS(NH4NO3和KNO3减半)+ GA3(1.0mg/L)+蔗糖(30g/L)+琼脂(7g/L),附加不同质量浓度的植物生长调节剂。所选用的植物生长调节剂为6-BA和KT,其中6-BA设置0.3mg/L、0.5mg/L、0.8mg/L3个水平,KT设置0、0.3mg/L、0.5mg/L3个水平。共设置9种试验组合,每个试验组为6个培养瓶,每个培养瓶放置16株苗,试验设置3个重复。培养30d后统计增殖倍数以及增殖后苗丛的玻璃化程度。增殖倍数=有效苗(株高1cm以上,至少有2片叶子展开)个数/接种的组培苗个数。增殖后苗丛的玻璃化程度分为3个等级:1级,组培苗生长健壮,叶片开展,玻璃化苗控制在5%以下;2级,大部分组培苗生长正常,玻璃化苗比例在5%~20%之间;3级,组培苗严重玻璃化,玻璃化苗比例大于20%,叶片卷曲呈水渍状,无法继续生长。
1.3.3 生根诱导及移栽
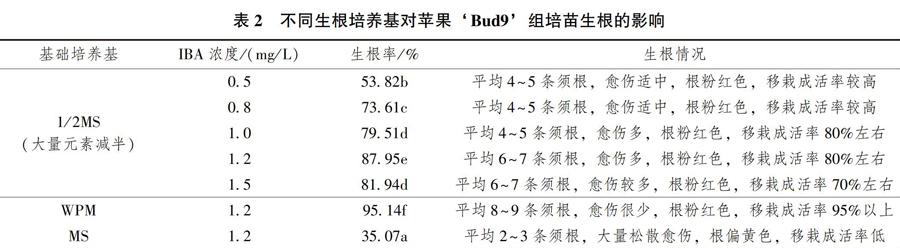
继代培养1个月左右,挑选株高2~3cm左右,生长健壮的组培苗进行生根诱导试验,研究生长素浓度和基础培养基对生根的影响。根诱导所用的生长素为IBA,其浓度设置为0.5、0.8、1.0、1.2、1.5mg/L共5个水平。基础培养基的选择有MS,1/2MS(大量元素减半)以及WPM培养基3个水平。每个试验组设置6个培养瓶,每个培养瓶内放置16株苗,试验设置3个重复。培养30d后统计植株的生根率以及生根情况。生根率=(生根的组培苗数/接种的组培苗总数)×100%。
将生根后的组培苗进行炼苗移栽,炼苗的季节最好选择在4—6月份。瓶苗首先在大棚条件下放置15d左右,逐渐拧开瓶盖使瓶苗适应大棚内坏境。之后将组培苗从组培瓶中夹出,洗净根部残留的培养基,种植于泥炭土:蛭石=1:2的基质中。每天喷水3次,保持空气湿润。
1.4 培养条件
培养室内环境条件如下:光照强度为4000~6000Lx,光周期为16h/d,温度保持在25±2℃左右。
1.5 试验数据分析
利用SPSS软件进行单因素方差分析,并采用Duncan法进行显著性检验。
2 结论与分析
2.1 不定芽增殖
将萌发后的顶芽及侧芽切去底部多余的外植体接种于增殖培养基中进行增殖,一般7~10d左右底部长出绿色圆形致密的愈伤组织,15d左右基部的腋芽开始萌发,30d左右萌发的腋芽长至2cm左右,可以转入增殖培养基中进行重复增殖。
不同植物生长调节剂配比对组培苗不定芽增殖的影响结果见表1所示。
增殖结果显示,随着培养基中6-BA浓度的增加,不定芽的增殖倍数逐渐上升,最高可达3.58。同时增殖后组培苗的玻璃化程度也在逐渐增加,当6-BA的浓度增加到0.8mg/L的时候,无论KT浓度是多少,组培苗玻璃化程度都是3级。当6-BA浓度为0.3mg/L的时候,组培苗增殖倍数在2倍左右,且随着培养基中KT浓度的增加,增殖倍数逐渐升高,组培苗生长健壮,玻璃化程度最低。当6-BA浓度为0.5mg/L的时候,同时在培养基中添加一定质量浓度的KT ,均可增加组培苗的玻璃化程度,同时增殖倍数也可以从2.01增加至3.23。综合增殖倍数和组培苗玻璃化程度考虑,最适宜苹果‘Bud9组培苗不定芽增殖的培养基为6号组别:MS(NH4NO3和KNO3减半)+ 6-BA(0.5mg/L)+ KT(0.5mg/L)+ GA3(1.0mg/L)+ 蔗糖(30g/L)+琼脂(7g/L),在此培养基中培养的组培苗,其增殖倍数可以达到3.23,组培苗生长较为健壮,玻璃化程度为2级。
2.2 生根诱导
2.2.1 不同IBA质量浓度对苹果‘Bud9组培苗生根的影响
不同IBA質量浓度对苹果‘Bud9组培苗生根诱导的试验结果表明,当培养基中IBA浓度小于等于1.2mg/L的时候,随着培养基中IBA浓度的增加,组培苗的生根率也在逐渐增加。但是当培养基中IBA浓度上升到1.5mg/L的时候,组培苗的生根率不增反降(见表2)。因此,最适宜苹果‘Bud9组培苗生根的IBA浓度为1.2mg/L。
2.2.2 不同基础培养基对苹果‘Bud9组培苗生根的影响
在培养基中IBA质量浓度为1.2mg/L的条件下,
3种基础培养基中,WPM培养基最适宜‘Bud9组培苗生根,其生根率可以达到95.14,同时生根情况也最好,苗末端愈伤组织少,根数多,移栽成活率可以达到95%以上(见表2)。
综上所述,苹果组培苗‘Bud9最适宜的生根培养基为WPM+IBA(1.2mg/L)+蔗糖(20g/L)+琼脂(7g/L)。
3 结论与讨论
由于大部分苹果苗都极其容易褐化,因此防止外植体在消毒过程中褐化是提高外植体消毒成功率的关键之处[7-9]。在外植体消毒的最后阶段使用添加300mg/L的抗坏血酸溶液浸泡3min左右,并在外植体消毒后迅速低温9℃贮藏3d可以最大程度的减轻外植体褐化现象。
在组培苗增殖试验中发现,苹果‘Bud9组培苗在增殖过程中非常容易发生玻璃化的现象,使用改良MS(NH4NO3和KNO3减半)培养基可以有效地减缓组培苗的玻璃化程度。不同质量浓度激素配比对于苹果‘Bud9组培苗增殖影响的试验结果表明,随着培养基中6-BA浓度的增加,不定芽的增殖倍数也随之升高,但是同时组培苗的玻璃化程度也在逐渐增加,丛生芽的玻璃化程度和培养基中细胞分裂素浓度呈正相关[10-11]。因此在选择最佳增殖培养基的时候要综合考虑增殖倍率和组培苗玻璃化程度2个因素。
生根培养结果表明,培养基中IBA浓度以及基础培养基类型对组培苗生根影响很大。随着IBA浓度的升高,组培苗的生根率呈现先升高后下降的趋势,同时组培苗底部的愈伤组织量也逐渐增加。这可能是因为高浓度的IBA会抑制组培苗根的发生,同时过多的愈伤组织会导致根松散易断,后续的驯化移栽成活率降低。使用不同的基础培养基进行生根诱导,结果显示最适宜的生根培养基为WPM,这可能是由于WPM培养基中含有较低的无机盐浓度,有利于根的形成[12]。
参考文献
[1] 鄢新民. 介绍几个苹果矮化砧木品种[J]. 现代农村科技, 2012(3):76-77.
[2]李丙智, 韩明玉, 张林森, 等. 我国苹果矮化砧木应用现状及适应性调查[J]. 果农之友, 2010(2):35-36.
[3]朱树华, 郁松林, 权俊萍. 苹果矮化砧木研究及应用现状[J]. 石河子大学学报(自然科学版), 2003, 7(4):327-332.
[4]齐春华. 植物组织培养技术发展现状及方向[J]. 农业科技与装备, 2011(4):10-11.
[5]吴多. 植物组织培养技术在林业生产中的应用[J]. 民营科技, 2015(3):229.
[6]梁称福. 植物组织培养研究进展与应用概况[J]. 经济林研究, 2005,23(4):99-105.
[7]陈蕾, 曹后男, 宗成文,等. 降低苹果梨组培过程中外植体褐化的研究[J]. 北方园艺, 2008(10):139-142.
[8]高兵, 孙俊, 章镇. 嘎拉苹果单芽系组培苗的获得[J]. 北方园艺, 2010(6):5-7.
[9]刘永军, 沈善超, 周彩琴,等. 解决苹果矮化砧M9外植体褐化现象的研究[J]. 山东林业科技, 2016, 46(5):71.
[10]Kataeva N V , Alexandrova I G , Butenko R G , et al. Effect of applied and internal hormones on vitrification and apical necrosis of different plants cultured in vitro[J]. Plant Cell Tissue and Organ Culture, 1991, 27(2):149-154.
[11]Lu Y F, Zhang L R, Wang Y R, et al. Establishment of an efficient in vitro plantlet regeneration system from leaf explants of ornamental crabapple (Malus spp.)[J]. Journal of Pomology & Horticultural Science, 2015, 90(5):585-592.
[12]Druart P. Optimization of culture media for in vitro rooting of Malus domestica Borkh. cv. Compact Spartan[J]. Biologia Plantarum, 1997, 39(1):67-77.
作者简介:
王婷婷(1989-),女,硕士。研究方向:木本植物组织培养。
