HIV/HBV共感染者HBV前C区肝病进程相关的变异分析
2019-11-11莫思柏罗贤鑫陈廷宪陈勇毅陈建仁
莫思柏,罗贤鑫,陈廷宪,陈勇毅,陈建仁
(阳江市公共卫生医院,广东 阳江 529500)
由于传播途径相似,HIV、HBV共感染常见。据报道,全球HIV/HBV共感染率约为5%~20%[1],我国共感染率则为4.2%~19.4%[2]。HIV感染可加速HBV所致的肝硬化、肝癌等终末性肝病进程,肝脏疾病已成为HIV感染者死亡的首要原因,但具体机制不明[3, 4]。研究报道,在HBV单一感染中,HBV基因组前C区的G1613A、C1653T、A1762T、G1764A、A1846T、G1896A、G1899A变异,尤其是A1762T、G1764A变异,与HBV所致的肝病进程相关[5]。来自美国的Audsley J等报道[6],HIV/HBV共感染者中HBVA1762T、G1764A变异较单一感染常见,但该研究人群以白种人和HBV基因A型为主,与我国人群HIV/HBV共感染人群特点存在明显差异。截止目前,在中国尚缺乏相关的前C区变异数据报道,共感染者肝病进程加速是否与上述的位点变异相关有待深入探讨。因此,本研究拟以直接碱基测序法,对HIV/HBV共感染者前C区进行DNA扩增,并以HBV单一感染者为对照,研究HIV/HBV共感染者前C区的肝病进程相关的变异,为深入探讨HIV/HBV共感染者疾病进展和转归的致病机制提供参考。
1 资料与方法
1.1 一般资料
选取2015年1月至2017年12月我院收治的慢性HBV感染者,依据治疗前HIV抗体检测结果分为HIV/HBV共感染组和HBV单一感染组。艾滋病和慢性HBV感染的诊断见参考文献[7, 8]。排除标准:抗HIV和HBV治疗;肝硬化、肝癌等终末性肝病;有其他肝炎病毒的感染和AIDS相关性的明显的机会性感染。本研究经医院伦理委员会同意,患者已知情、签订知情同意书。
1.2 方法
血清HBV DNA提取:采集患者抗病毒治疗前血液,用EDTA抗凝管收集,3 000 r/min,离心10 min,取上清液。采用QIAamp DNA mini Kit(250)试剂盒从200 μl血清中提取HBV DNA。按试剂盒说明书进行操作。
HBV前C区PCR扩增:巢式PCR法扩增HBV前C区,均采用50 μl反应体系。第一轮PCR取15 μL HBV DNA纯化产物作为模板,PCR第一轮反应:上游引物5’-TCGCATGGAGACCACCGTGA-3’;下游引物5’-ATAGCTTGCCTGAGTGC-3’,扩增条件:94℃预变性1 min;95 ℃ 变性15 s,退火68 ℃ 45 s,延伸72℃ 3 min 20 s (循环30次)。第二轮PCR采用第一轮产物1 μL,PCR第二轮反应:上游引物5’-CATAAGAGGACTCTTGGACT-3’;下游引物5’-GAAAGAAGTCAGAAGGC-3’,扩增条件:94 ℃预变性1 min;95℃ 变性15 s,退火68 ℃ 45 s ,延伸72 ℃ 7 min (循环30次)。
1.3 基因测序和分析
PCR产物经琼脂糖凝胶电泳后条带清晰、大小正确后送上海生物工程技术服务有限公司进行测序,测序方法为Sanger双氧链末端终止法测序。采用Vector NTI Suite9.0软件对基因序列与参考序列进行比对,计数含有位点变异的序列数。参考株序列号:B1 D00329;B2 AF121249;B3 M54923;B4 AY033072;B5 AB219429;C1 AY057947;C2 AY217378;C3 X75665;C4 AB048705;C5 AB241111。
1.4 统计学方法
采用SPSS19.0软件进行统计学分析。定量资料以K-S法进行正态性检验,符合正态分布的数据采用均值±标准差描述集中趋势,比较采用t检验,不符合正态分布的数据采用中位数(四分位数间距)描述集中趋势,比较采用Wilcoxon秩和检验。定性资料采用卡方检验或Fisher精确概率检验。P<0.05表示差异有统计学意义。
2 结果
2.1 入组患者基本信息
成功扩增前C区的抗病毒治疗前的慢性HBV感染者共126例,其中HIV/HBV共感染者74例,HBV单一感染52例。CD4+T淋巴细胞(简称CD4细胞)计数38.6(14.5-88.65)(/μl)(以中位数加四分位间距描述,以下同),CD8+T淋巴细胞(简称CD8细胞)计数623.5(326.25-779)(/μl),CD4+T/CD8+T比值0.067(0.033-0.161)。两组患者性别组成、年龄、HBV基因型、HBeAg状态、谷丙转氨酶(ALT)、谷草转氨酶(AST)、总胆红素(TBIL)比较均无差异(P值均>0.05),基线信息具有可比性,检测结果见表1。
2.2 HIV/HBV共感染组与HBV单一感染组患者前C区的肝病进展相关变异发生比较
74例HIV/HBV共感染组中,发生G1613A、C1653T、A1762T、G1764A、A1846T、G1896A、G1899A分别有13例(17.5%)、4例(5.4%)、27例(36.5%)、27例(36.5%)、16例(21.6%)、22例(29.7%)、7例(9.5%);52例HBV单一感染组中,发生G1613A、C1653T、A1762T、G1764A、A1846T、G1896A、G1899A分别有6例(11.5%)、2例(3.8%)、10例(19.2%)、10例(19.2%)、9例(17.3%)、19例(23.1%)、3例(5.8%)。HIV/HBV共感染组所有的上述位点变异整体偏高于HBV单一感染组,其中A1762T、G1764A具有统计学意义(χ2=4.384,P=0.035;χ2=4.384,P=0.035)。变异发生率比较见图1。
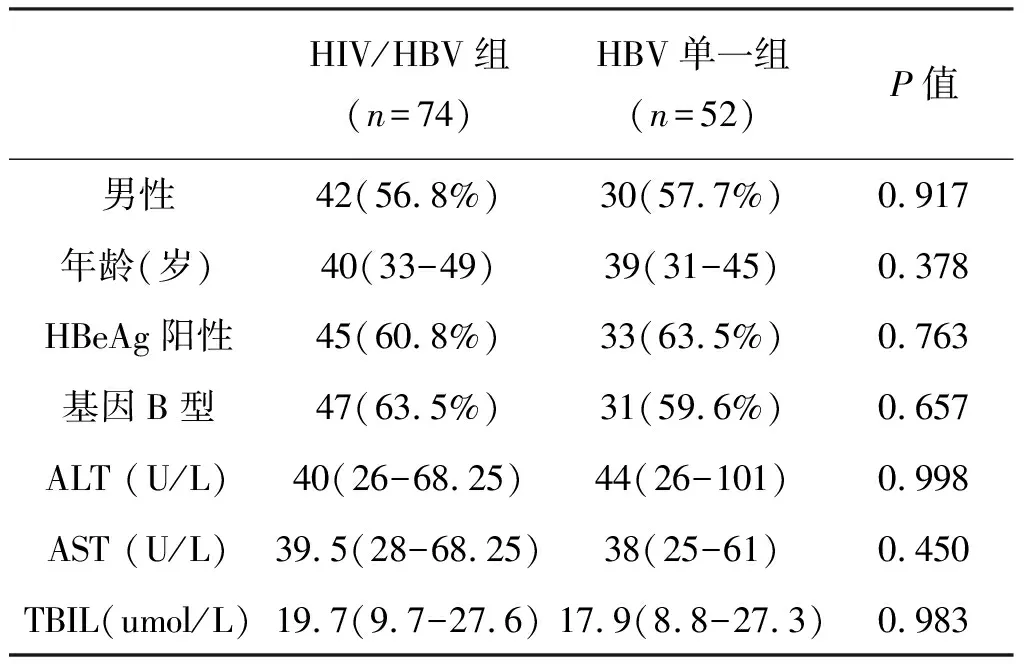
表1 两组患者基本资料比较
注:年龄、ALT、AST、TBIL以中位数(四分位数间距)描述
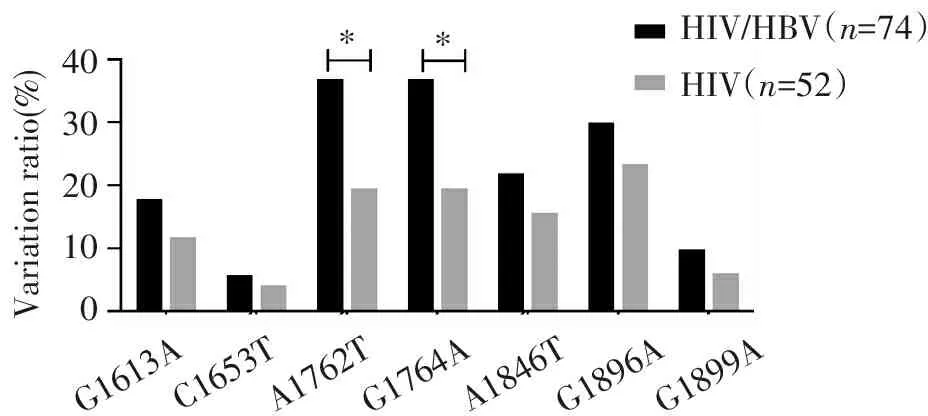
HIV/HBV(n=74)HIV(n=52)**403020100Variationratio(%)G1899AG1613AC1653TA1762TG1764AA1846TG1896A
图1 两组变异发生率的比较
3 讨论
由于HIV和HBV有共同相似的传播途径(性接触、血液传播、垂直传播),HIV感染者常合并HBV感染。目前用于治疗HIV的HAART虽可同时抑制患者HIV和HBV复制,但HIV/HBV共感染者长期终末性肝病的风险仍明显增加,HBV所致的终末性肝病成为世界HIV/AIDS患者死亡的首要原因[3, 4]。我国流行HBV基因型以B型、C型为主,易致肝硬化及肝癌,相对A型、D型预后更差,HBV相关的终末性肝病导致的死亡在我国尤为严重[2, 9]。因此,研究HIV/HBV共感染人群也应充分考虑到各国人群的独特性。
在本部分研究中,HIV/HBV共感染者与HBV单一感染者患者的基本信息匹配,其中包括HBeAg、基因型、性别等可能与基因变异发生率相关的因素,有效的排除了混杂因素的影响。研究结果发现,HIV/HBV共感染者所有已报道的前C区的位点变异发生率偏高于HBV单一感染者。在HBV单一感染的研究中,HBV前C区突变可直接影响到病毒复制能力和HBeAg的表达,与肝病进程密切相关[10]。在未经治疗的HIV感染者胃肠道CD4+T淋巴细胞的消耗导致微生物易位增加,引起循环中脂多糖水平升高,进而可结合toll样受体4并激活核因子kB等其他通路,导致促炎症细胞因子产生和免疫过度的慢性活化[11, 12]。因此,本研究发现HIV/HBV共感染者前C区变异较高推测可能是宿主免疫压力下作用下选择的结果。
研究结果发现,HIV/HBV共感染者A1762T、G1764A变异发生率明显高于HBV单一感染者,具有统计学意义,这与既往来自美国的Audsley J等报道结果是一致[6]。A1762T、G1764A双突变是前C区最常见的突变,A1762T、G1764A导致肝病进展的研究比较多,有研究认为A1762T、G1764A通过调节前C区或肝细胞核转录因子水平增加HBV复制能力而导致肝癌,也有研究认为A1762T、G1764A通过改变HBxAg来促进免疫耐受,影响机体对HBV的免疫清除[13, 14]。
综上所述,本研究通过分析HIV/HBV共感染组与HBV单一感染组HBV的前C区肝病进程变异差异,提示合并HIV感染更差发生肝病进程相关的变异,尤其是A1762T、G1764A,具体作用机制有待深入研究。
