烟草miRNA169 基因家族及启动子的生物信息学分析
2019-11-11蔡健宇贾蒙骜张孝廉郭玉双
蔡健宇,贾蒙骜,张孝廉,3,余 婧,李 勇,雷 波,郭玉双*
1.贵州省烟草科学研究院 烟草行业分子遗传重点实验室,贵阳市观山湖区龙潭坝路29 号 550081
2.浙江省宁波市宁海县农业农村局,浙江省宁波市宁海县桃源中路118 号 315600
3.贵州大学生命科学学院,贵阳市花溪区花溪大道南段2708 号 550025
4.东北农业大学生命科学学院,哈尔滨市香坊区木材街59 号 150030
烟草早花使烟株提前进入生殖生长期,导致烟叶产量和品质明显下降,造成巨大经济损失[1]。引起烟草早花的因素复杂多样,其中温度是最主要的影响因素之一[2]。低温胁迫可以改变作物的花期,从而影响作物产量和品质[3]。在中国南部烟区,低温、胁迫诱导的烟草早花现象严重影响了烟叶生产和农民增收[4]。目前生产上主要采取加强田间管理、地膜覆盖和打顶等补救措施来抑制烟草早花[5],而真正解决低温胁迫诱导早花的根本途径则是明确低温胁迫诱导烟草早花的分子机制,培育出耐低温、抗早花的烟草新品种。然而目前对植物早花相关分子机制的研究主要集中在拟南芥(Arabidopsis thaliana)上[6],低温胁迫诱导烟草早花的分子机制仍不明确。
microRNA,简称miRNA,是一类长度约为22个核苷酸(nucleotide,nt)的内源单链非编码小分子RNA[7]。2002 年首次从模式植物拟南芥中发现miRNA,揭 开 了 植 物miRNA 研 究 的 序 幕[8]。miRNA 等调控小分子RNA 这一发现,使人们对RNA 调控基因表达的功能有了全新认识。这类调控小分子RNA 在植物生长素信号、叶片发育、花器官形成等生命活动中,以及响应干旱、低温、盐胁迫、磷胁迫、硫酸盐胁迫等逆境生理代谢中均发挥着重要作用[9]。miRNA169 家族是拟南芥中最大的miRNA 家族,其在干旱[10-11]、低温[12-13]、高盐[14]、氮缺乏[15]以及紫外线辐射[16]条件下表达量均上调,可见其在植物非生物胁迫应答中的重要作用,目前研究人员仅对少数成员进行了功能注释,但对其功能的研究仍较少。有研究表明,miRNA169d是介导拟南芥低温早花的关键因子,低温胁迫能够诱导miRNA169d 表达量上调,再通过一系列信号转导,最终导致花期提前[17]。前期的研究发现,低温也能够诱导烟草miRNA169 表达量上调,这意味着烟草miRNA169 在低温诱导烟草早花的过程中可能也起着关键作用。然而,目前的研究主要集中于miRNA 的形成机制上,对于转录水平上如何调控miRNA基因表达的报道很少,尤其是调控烟草miRNA169 家族表达的分子机制研究仍为空白[18]。因此,对烟草miRNA169 家族的表达在转录水平上的调控研究,将有助于解决烟草早花的问题。
启动子是一段可以和RNA 聚合酶以及一些影响转录的反式作用因子结合而准确有效地起始转录的DNA 序列。启动子在植物基因表达调控过程中起着关键作用。基因的启动子中含有一系列特异的蛋白结合位点,通常这些位点称为顺式作用元件(cis-element),与顺式作用元件相结合的蛋白质被称为反式作用因子(trans-acting element)。DNA上的顺式元件与反式作用因子等多种因素通过相互作用来调控基因的转录,即转录的组合控制。非生物胁迫,如干旱、高盐、低温和高温等可以诱导植物体内相关基因表达,其转录调节的主要机制之一是逆境胁迫有关的转录因子(调节蛋白)与基因上游启动子中关键顺式元件特异性结合,增强了启动子的活性,从而提高目的基因的表达量[19]。而研究基因的启动子及其顺式作用元件将有助于了解基因在转录水平上的调控机制,因此,利用生物信息学方法对miRNA 序列数据库(miRBase)[20]中登录的普通烟草miRNA169 基因家族进行分析,并对其启动子的序列、理化性质、调控元件等进行预测,旨在明确烟草miRNA169 的调控机制,为培育耐低温抗早花的烟草新品种奠定基础。
1 材料与方法
1.1 数据来源
普通烟草(Nicotiana tabacum)miRNA169 序列及其前体序列和拟南芥(Arabidopsis thaliana)pre-miRNA16 9 序列均来源于miRNABase 数据库(http://www.mirbase.org/):nta-miRNA169a(MIMAT0024667;MI002 1357)、nta-miRNA169b(MIMAT0024668;MI0021358)、nta-miRNA169c(MIMAT0024669;MI0021359)、nta-miR NA169d(MIMAT0024670;MI0021360)、nta-miRNA169e(MIMAT0024671;MI0021361)、nta-miRNA169f(MIMA T0024672;MI0021362)、nta-miRNA169g(MIMAT00246 73;MI0021363)、nta-miRNA169h(MIMAT0024674;MI 0021364)、nta-miRNA169i(MIMAT0024675;MI002136 5)、nta-miRNA169j(MIMAT0024676;MI0021366)、ntamiRNA169k(MIMAT0024677;MI0021367)、nta-miRNA 169l(MIMAT0024678;MI0021368)、nta-miRNA169m(MIMAT0024679;MI0021369)、nta-miRNA169o(MIM AT0024680;MI0021370)、nta-miRNA169p(MIMAT0024 681;MI0021371)、nta-miRNA169q(MIMAT0024682;MI0021372)、nta-miRNA169r(MIMAT0024683;MI0021 373)、nta-miRNA169s(MIMAT0024684;MI0021374)、nta-miRNA169t(MIMAT0024685;MI0021375);ath-miR NA169a(MI0000212)、ath-miRNA169b(MI0000976)、ath-miRNA169c(MI0000977)、ath-miRNA169d(MI0000 978)、ath-miRNA169e(MI0000979)、ath-miRNA169f(MI 0000980)、ath-miRNA169g(MI0000981)、ath-miRNA169 h(MI0000982)、ath-miRNA169i(MI0000983)、ath-miRN A169j(MI0000984)、ath-miRNA169k(MI0000985)、athmiRNA169l(MI0000986)、ath-miRNA169m(MI000098 7)、ath-miRNA169n(MI0000988)。普通烟草全基因组数据来源于中国烟草基因组数据库。
1.2 烟草miRNA169 基因的生物信息学分析
使用DNAMAN6.0 和MEGA5.0 软件对烟草miRNA169 家族前体序列进行比对分析,并将其定位在相应的烟草基因组上。其次,截取pre-miRNA169 起始位点上游2 000 bp 序列作为预测启动子,利用在线分析软件对潜在的启动子区域及CpG 岛[CpG 岛是富含CpG(胞嘧啶-磷酸-鸟嘌呤)二核苷酸的一些区域,通常位于基因启动子的核心序列和转录起始点附近]等进行预测。最后,综合运用PlantPAN2.0 数据库和PlantCARE 数据库对烟草miRNA169 启动子进行结构分析,预测可能存在的顺式作用元件。采用的软件见表1。
2 结果与分析
2.1 烟草miRNA169 及其前体序列分析
对miRBase 数据库中的烟草miRNA169 及其前体序列进行整理,共19 个成员,均由21 个碱基组成。其中,nta-miRNA169q、nta-miRNA169r、nta-miR NA169s 的序列完全一致,除nta-miRNA169t 外的其他15 个成员序列完全一致,见表2。
对烟草miRNA169 前体序列进行比对发现:除nta-miRNA169j、nta-miRNA169q 外,其他家族成员前体序列均能完全匹配到烟草基因组上。其中,nta-miRNA169a、nta-miRNA169c、nta-miRNA169i 和nta-miRNA169k 的前体序列基本一致,nta-miRNA16 9b、nta-miRNA169e 和nta-miRNA169g 的前体序列基本一致,nta-miRNA169d 和nta-miRNA169l 前体序列基本一致,nta-miRNA169f 和nta-miRNA169o 的序列完全相同。通过构建系统发育树(图1)可以看出,烟草miRNA169 前体序列与拟南芥miRNA169 前体序列明显分化成为两个进化分支。除nta-miRNA1 69t 前体序列与拟南芥miRNA169 前体序列存在较高同源性外,其他序列与拟南芥之间的同源性均很低,但烟草miRNA169 前体序列之间存在很高同源性,因此推测烟草miRNA169 的调控机制可能与拟南芥miRNA169 的调控机制存在差异。

表1 生物信息学分析及使用软件Tab.1 Bioinformatic analysis and corresponding software
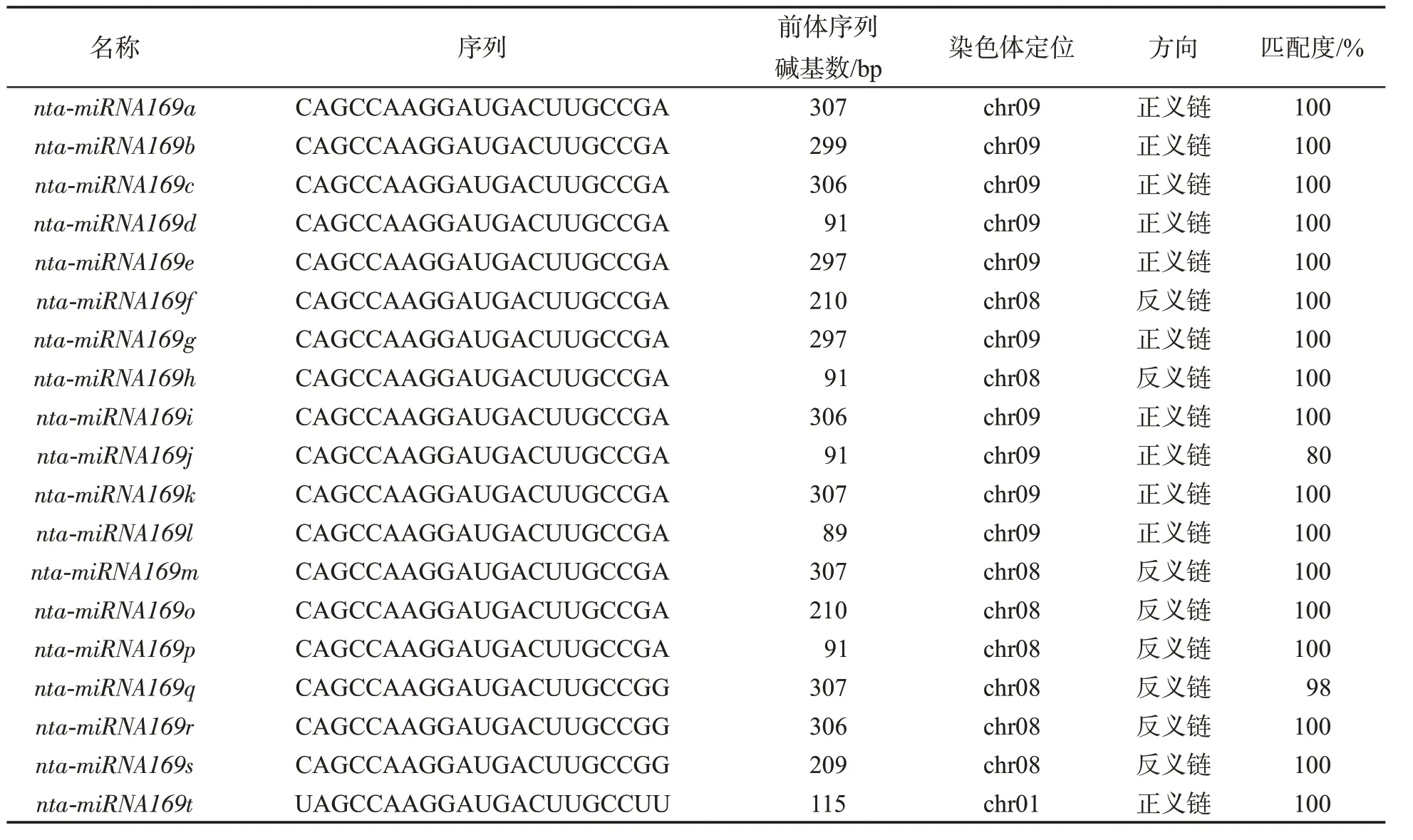
表2 烟草miRNA169 及其前体的序列特征Tab.2 Sequence characteristics of miRNA169 and pre-miRNA169

图1 烟草pre-miRNA169 家族系统发育树Fig.1 Phylogenetic tree of pre-miRNA169 family
对烟草miRNA169 前体序列进行染色体定位发现:烟草miRNA169 前体序列主要分布在chr01、chr08 和chr09 这3 条染色体上。其中,chr09 上的pre-miRNA169 主要分为两个转录起始位点,chr08上的pre-miRNA169 转录起始位点呈现多样化,而chr01 上 只 有1 个pre-miRNA169t。此 外,大 部 分miRNA169 均存在多种前体序列,推测有某种机制将同一段序列加工成不同的pre-miRNA,见图2。最后,根据转录起始位置的不同将烟草pre-miRNA169 划分为8 组,见表3。
2.2 烟草miRNA169 启动子区域预测
截取上述8 组pre-miRNA169 序列5’侧翼区2 000 bp 的序列作为启动子预测区域,利用启动子在线分析软件Promoter 2.0 Prediction Server、Neural Network Promoter Prediction(截断值0.8)、Softberry(TSSP)进行启动子预测。综合3 种软件的预测结果及各miRNA169 前体序列的分布位置,推测出烟草miRNA169 启动子最有可能存在的位置,结果见表4。其中,Promoter 2.0 Prediction Server 只预测到nta-miRNA169s 在800 bp 处有很高的可能性存在启动子,Softberry(TSSP)对pre-miRNA169 在反义链上的启动子预测效果不佳。
2.3 烟草miRNA169 启动子CpG 岛预测
CpG 岛的GC 含量大于50%,长度超过200 bp。有研究表明,miRNA 基因启动子区域的CpG岛如果被甲基化,将会阻碍相关转录因子的结合,从而降低miRNA 的表达[21]。
本研究中利用MethPrimer 软件在线分析,采用参数观察值/预测值>0.6、GC 含量>50.0%,对烟草miRNA169 启动子进行CpG 岛预测,结果见图3。所有烟草miRNA169 的启动子区域GC 含量都比较低,未发现明显的CpG 岛。
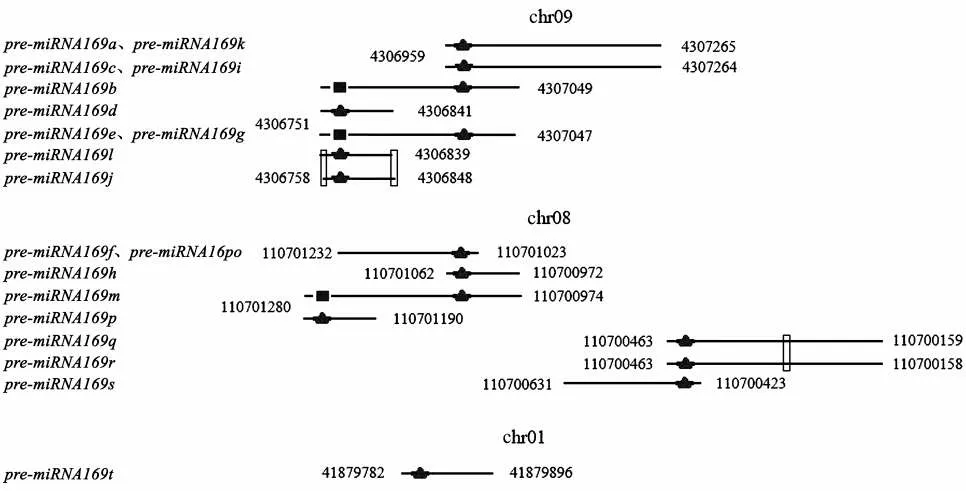
图2 烟草pre-miRNA169 家族染色体定位Fig.2 Chromosomal localization of pre-miRNA169 family

表3 烟草pre-miRNA169 分组Tab.3 Group of pre-miRNA169

表4 烟草miRNA169 启动子区域预测结果Tab.4 Promoter prediction results of pre-miRNA169
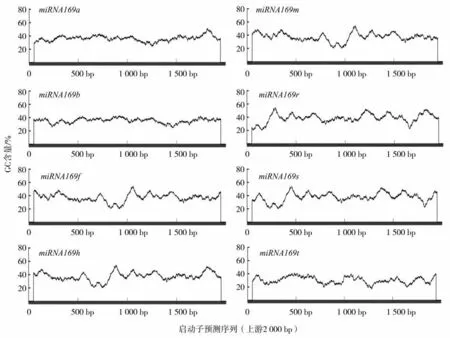
图3 烟草miRNA169 启动子CpG 岛的预测结果Fig.3 Prediction results of CpG island in miRNA169 promoter
2.4 烟草miRNA169 胁迫相关元件的预测
由于部分烟草miRNA169 在染色体上位置及预测的启动子区域基本没有差别,因此将miRNA169a 作为miRNA169a、miRNA169c、miRNA16 9k、miRNA169i、miRNA169b、miRNA169d、miRNA169e、miRNA169g、miRNA169l、miRNA169j 的 代 表,miR NA169r 作 为miRNA169f、miRNA169o、miRNA169h、miRNA169m、miRNA169p、miRNA169r、miRNA169q、miRNA169s 的代表,分别截取上游2 000 bp 序列预测可能存在的胁迫相关元件。
运用PlantPAN2.0 对烟草miRNA169 启动子序列进行分析,结果见表5 和图4。从胁迫相关元件的种类和数量分布来看,这3 条启动子序列存在很高相似性。
运用PlantCARE 对上述烟草miRNA169 启动子序列上的胁迫相关元件进行验证[22],结果见表6。经过筛选,烟草miRNA169a 启动子中存在5 个干旱应答元件MBS 和1 个低温应答元件LTR,烟草miRNA169r 启动子中存在4 个干旱应答元件MBS、1 个低温应答元件LTR 和1 个脱落酸应答元件ABRE,烟草miRNA169t 启动子中存在1 个干旱应答元件MBS、1 个低温应答元件LTR 和5 个脱落酸应答元件ABRE。通过胁迫相关元件的预测分析,已测定烟草miRNA169 基因的启动子序列中都存在干旱应答元件和低温应答元件,表明已测定的烟草miRNA169 基因均参与低温应答和干旱应答,这与上述研究结果相符。
3 讨论
本研究中发现烟草基因组中共有19 个miRNA169 基因,分别分布在1 号、3 号和8 号染色体上,各miRNA169 基因产生的miRNA169 序列基本相同,推测烟草miRNA169 家族各个成员可能参与相似的信号通路。然而,miRNA169 家族的前体序列具有较大的差异,推测可能存在不同的触发机制来形成相应的miRNA169,这与不同的miRNA169 参与植物不同的胁迫反应是相印证的,如在紫外线诱导下miRNA169d、miRNA169j 表达量上升[16],在干旱处理下miRNA169g 表达量上升[23]。
进化分析显示,除miRNA169t 外,烟草miRNA169 与拟南芥miRNA169 的序列同源性并不高,说明烟草miRNA169 与拟南芥miRNA169 在进化上可能来源于两个分支。因此,推测烟草miRNA169 的功能可能有别于拟南芥miRNA169,需要在烟草上进行进一步的试验验证。
miRNA169家族参与了植物抵御干旱、低温等多种非生物胁迫,以及激素应答等多种生理过程[11-16]。本研究中发现,烟草miRNA169 启动子区域中存在多种非生物胁迫应答元件和激素应答元件,证实了烟草miRNA169 在复杂的非生物胁迫调控网络中扮演着重要角色。其中,所有烟草miRNA169 启动子区域都存在低温应答元件LTR[24],说明低温胁迫相关的转录因子通过与烟草miRNA169 启动子区域中的低温应答元件LTR 相结合来诱导烟草miRNA169 的上调表达,这与低温诱导植物miRNA169 上调表达的试验结果相一致[17]。此外,烟草miRNA169 启动子区域中还存在脱落酸(ABA)和茉莉酸(JA)应答元件。由于植物激素在植物抵御各种生物和非生物胁迫过程中发挥着重要的调节作用,而ABA 和JA 是植物体内参与抵御各种生物和非生物胁迫过程最重要的内源激素[25],有研究表明ABA 和JA 均参与植物对低温胁迫的应答[26]。因此,推测烟草miRNA169 对低温胁迫的响应过程可能依赖于ABA 和JA 途径。而在通过转基因技术创制过表达或基因沉默材料,对烟草miRNA169 抵御低温胁迫过程中的功能进行验证,并尝试解析其调控机制方面仍有待进一步深入研究。

图4 烟草miRNA169 启动子区域胁迫相关元件的分布Fig.4 Distribution of stress-related elements in miRNA169 promoter

图4 (续)

图4 (续)

表6 烟草miRNA169 启动子区域胁迫相关元件验证Tab.6 Verification of stress-related elements in miRNA169 promoter
4 结论
烟草基因组中共有19 个miRNA169 基因,分布在1 号、3 号和8 号3 条染色体上,同一染色体上的miRNA169 分布集中。对烟草miRNA169 启动子的分析发现,烟草miRNA169 与拟南芥miRNA169 的序列同源性不高,可能属于不同的进化分支。另外,在所有烟草miRNA169 的启动子上均存在低温胁迫应答元件LTR,以及参与低温应答的激素ABA 和JA 的应答元件。因此,推测烟草miRNA169 对低温胁迫的响应过程可能是LTR、ABA 和JA 途径三者共同作用的结果。
