化学反应纷繁复杂,找准规律拨云见日
2019-11-07冯存良高小艳
冯存良 高小艳


高中学生中流传着这样一句话:“化学繁,物理难,数学的作业做不完。”同学们之所以觉得“化学繁”,是因为化学知识点是零碎的,这就要求大家在复习时由点到面,将知识点架构成知识网络。
本文将从三个方面分析化学反应,帮助同学们熟悉相关知识、找出规律,掌握解题的方法,把必备知识与关键能力、学科素养、核心价值紧密相连,形成具备内在联系的网络,提升解决问题的能力。
一、元素及其化合物的相互转化
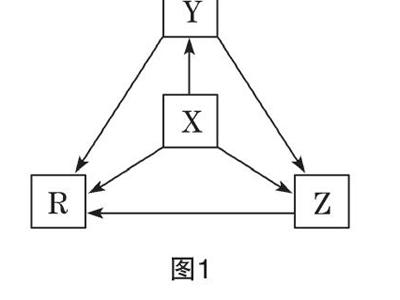
【例1】下列各组物质中,物质之间通过一步反应就能实现如图1所示转化的是( )
选项 X Y Z R
A Al AlCl3 Al(OH)3 NaAlO2
B Na Na2O Na2O2 NaOH
C H2S S SO2 SO3
D N2 NH3 NO NO2
图1
【解析】A项,Al不能经一步反应生成Al(OH)3;B项,Na可以与O2(常温或加热)、H2O经一步反应分别生成Na2O、Na2O2、NaOH,Na2O在O2中加热生成Na2O2,Na2O、Na2O2均能与H2O反应生成NaOH;C项,H2S、S不能经一步反应生成SO3;D项,NH3、N2不能经一步反应生成NO2。
【答案】B
【知识总结】
元素及其化合物转化
(一)常见“串珠”型转化
1.连续氧化型
①NaNa2ONa2O2NaOH
②CCOCO2H2CO3
③S(或H2S)SO2SO3H2SO4
④N2(或NH3)NONO2HNO3
注意:SiO2不能通过一步反应转化为H2SiO3。
2.连续转化型
①铝土矿提取铝
方式一:Al2O3AlCl3Al(OH)3Al2O3Al
方式二:Al2O3NaAlO2Al(OH)3Al2O3Al
②工业提取镁
方式一:Mg2+Mg(OH)2MgCl2
MgCl2Mg
方式二:MgCO3MgCl2MgCl2·6H2OMgCl2Mg
③侯氏制碱法
NaClNaHCO3Na2CO3
(二)常见“三角”转化
【高分锦囊】
元素及其化合物相互转化的易错点
1.Na不能置换出盐溶液中的金属,与熔融的盐反应才可以;向饱和的Na2CO3溶液中通入过量CO2,有NaHCO3 白色晶体析出。
2.Al虽是活泼金属,但因为其与空气中的氧反应,表面生成一层致密的氧化物薄膜,所以Al的抗腐蚀性比较强。
3.Fe与O2、H2O(g)反应的产物都是Fe3O4而不是Fe2O3;制备FeCl2,除了有Fe与盐酸的置换反应外,还有化合反应:2FeCl3+Fe=3FeCl2;制备Fe(OH)3,除了有Fe3+与碱的复分解反应,还有化合反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3。
4.Al、Fe在冷的浓硫酸和浓硝酸中会钝化,但加热后反应会继续。
5.Cu在潮湿的空气中生成铜绿[Cu2(OH)2CO3],不生成CuO;常用灼热的铜粉除去N2中的O2,灼热的CuO除去CO2中的CO。
二、有机化学反应
【例2】下列化学方程式或相应的描述涉及的反应与相应的反应类型不一致的是( )
A.CH3CH2OH+CH3COOHCH3COOCH2CH3+ H2O(取代反应)
B.苯中加入溴水,充分振荡静置后溴水褪色(取代反应)
C.nCH2 =CHClCH2-CHCln(加聚反应)
D.CH2=CH2+Br2→CH2BrCH2Br(加成反应)
【解析】苯中加入溴水,充分振荡静置后溴水褪色,是因为苯萃取了溴水中的溴单质。
【答案】B
【知识总结】
常见有机物或官能團及其性质
种类 官能团 主要化学性质 反应类型
烷烃 — ①在光照下发生卤代反应 取代反应
②不能使酸性KMnO4溶液褪色 —
③高温分解 裂化、裂解
烯烃 ①与X2、H2、HX、H2O等发生反应(X表示卤素单质,下同) 加成反应
②加成聚合反应生成聚合物 加聚反应
③使酸性KMnO4溶液褪色 氧化反应
苯及其同系物
— ①苯环上发生硝化、磺化、卤代反应 取代反应
②与H2发生加成反应 加成反应
③苯的同系物侧链在光照下发生卤代反应 取代反应
④苯的同系物使酸性KMnO4溶液褪色 氧化反应
卤代烃 —X ①在NaOH的水溶液、加热条件下生成醇 水解(取代)反应
②在NaOH的醇溶液、加热条件下生成不饱和烃 消去反应
醇 —OH ①与活泼金属Na等反应产生H2 置换反应
醇 —OH ②催化氧化生成醛、酮 氧化反应
③与羧酸及无机含氧酸反应 酯化(取代)反应
④在浓硫酸、加热条件下生成不饱和烃 消去反应
【高分锦囊】
有机物反应条件及反应类型
1.在NaOH水溶液中能发生酯的水解、卤代烃的水解。
2.在光照、X2条件下发生烷基上的取代反应;在铁粉、X2条件下发生苯环上的取代反应。
3.在浓H2SO4、加热条件下,能发生苯的硝化反应,醇的酯化反应、消去反应等。
4.与溴水或溴的CCl4溶液反应,可能发生烯烃的加成反应。
5.与H2在催化剂作用下发生烯烃、芳香烃加成(还原)反应。
6.在O2、Cu(或Ag)、加热条件下发生醇的催化氧化反应。
7.与新制Cu(OH)2悬浊液或银氨溶液反应,发生—CHO的氧化反应。
8.在稀H2SO4、加热条件下发生酯、低聚糖、多糖等的水解反应。
三、化学工艺流程题中方程式的书写
【例3】三氧化二镍(Ni2O3)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(NiC2O4·2H2O),再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐均难溶于水。工艺流程如图2所示:
图2
请回答下列问题:
(1)加入H2O2发生的主要反应的离子方程式为。加入碳酸钠溶液调pH至4.0~5.0,其目的为。
(2)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧,可制得Ni2O3,同时获得混合气体,该混合气体的主要成分为(水除外) 。
(3)工业上还可用电解法制取Ni2O3,用NaOH溶液调NiCl2溶液的pH至7.5,加入适量Na2SO4后利用惰性电极电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。ClO-氧化Ni(OH)2生成Ni2O3的离子方程式为 ,a mol二价镍全部转化为三价镍时,外电路中通过电子的物质的量为 mol。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时,NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式为,其放电时正极的电极反应式为 。
【解析】(1)加入H2O2的目的是将Fe2+氧化成Fe3+,发生反应的离子方程式为2Fe2++H2O2+2H+===2Fe3++2H2O。加入碳酸钠溶液调节pH至4.0~5.0,可促进Fe3+水解,除去所生成Fe(OH)3沉淀。
(2)NiC2O4·2H2O在热空气中干燥脱水后在高温下煅烧可制得Ni2O3,Ni元素的化合价升高,则必有元素化合价降低,故生成CO,又因为生成的是混合气体,所以必有CO2生成。
(3)ClO-具有强氧化性,将Ni(OH)2氧化成Ni2O3,自身被还原为Cl-,发生反应的离子方程式为ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O。由离子方程式可知,a mol二价镍全部转化为三价镍时,消耗0.5a mol ClO-,再由Cl2+2OH-=Cl-+ClO-+H2O可知,电解产生的Cl2的物质的量为=0.625a mol,再由2Cl--2e-=Cl2↑可知,外电路中转移电子的物质的量为0.625a mol×2=1.25a mol。
(4)该电池放电时,NiO(OH)转化为Ni(OH)2,Ni离子由+3价变为+2价,故正极的电极反应式为NiO(OH)+e-+ H2O=Ni(OH)2+OH-,负极的电极反应式为Al-3e-+ 4OH-=AlO2-+2H2O,该电池总反应的化学方程式为Al+ 3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2。
【答案】(1)2Fe2++H2O2+2H+=2Fe3++2H2O 促进Fe3+水解,除去沉淀 (2)CO、CO2(3)ClO-+2Ni(OH)2=Cl-+Ni2O3+2H2O 1.25a (4)Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2 NiO(OH)+e-+H2O=Ni(OH)2+OH-
【知识总结】
理清离子反应的相关知识
1.化学工艺流程题中主要涉及的5类离子反应
(1)难溶物溶解的离子反应。
(2)沉淀转化的离子反应。
(3)同种元素在同种价态、不同pH条件下转化的离子反应。
(4)与量有关的离子反应。
(5)涉及氧化還原反应的离子反应。
2.书写离子方程式时需注意的事项
(1)观察离子方程式中的符号是否正确、合理,如“”“↑”“↓”。
(2)拆写是否合理。
①难溶于水、难电离的物质用化学式表示。
②微溶物(如Ca(OH)2等)作为反应物时,若为澄清溶液则写离子符号,若是浑浊液则写化学式;作为生成物时一般写化学式。
③多元弱酸的酸式酸根离子不能拆开写;而多元强酸的酸式酸根离子在水溶液中可完全电离,如NaHSO4在水溶液中的离子为Na+、H+和SO42-。
(3)灵活应用电荷守恒及氧化还原反应中的得失电子守恒,判断离子方程式书写是否正确。
【高分锦囊】
掌握陌生方程式的书写技巧
1.陌生化学方程式的书写思路
首先根据题意写出材料中的部分反应物和生成物的化学式,再根据反应前后元素化合价有无变化判断反应类型:元素化合价无变化则遵循质量守恒定律;元素化合价有变化则除遵循质量守恒定律外,还要遵循得失电子守恒规律;最后根据题目要求写出化学方程式或离子方程式(遵循电荷守恒规律)。
2.陌生氧化还原反应方程式书写的具体步骤
第一步:根据元素化合价的升降,判断氧化剂、还原剂、氧化产物、还原产物;
第二步:按“氧化剂+还原剂===还原产物+氧化产物”写出方程式,根据得失电子守恒配平上述四种物质;
第三步:根据电荷守恒和反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等;
第四步:根据质量守恒配平反应方程式。
