轮钟花组织培养的最佳外植体及培养基筛选
2019-11-07祝久洁吴汉竹孙庆文郭文凯徐文芬
祝久洁, 吴汉竹, 孙庆文, 郭文凯, 徐文芬
(贵州中医药大学, 贵州 贵阳 550025)
轮钟花〔Cyclocodonlancifolius(Roxburgh)Kure.〕为桔梗科(Campanulaceae)轮钟花属(Cyclocodon)多年生草本植物[1],又称蜘蛛果、红果参、山荸荠、算盘果等[2-4],其根入药具有益气补虚、祛瘀止痛及祛痰等功效,是贵州民间常用的特色补益药之一。轮钟花在我国主要分布于贵州、重庆、福建、广东、广西及云南等地,常生于海拔1 500 m以下的路边、林下、灌丛及沟谷,适应性较强。自2012年以来,作者团队在开展贵州中药资源普查及民族民间医药调查的过程中发现,轮钟花在贵州虽然分布广,但产藏量不大。在黔南和黔东南的民间常挖其根作为补药,并采其成熟果实作为野果食用。目前对轮钟花的研究还比较薄弱,仅有少量涉及植物分类、生药鉴定和化学药理等方面的研究报道[5-14],而对种苗繁育和栽培技术的相关研究鲜见报道。
在贵州大健康产业快速发展的今天,刺梨、铁皮石斛等具有保健作用的药用植物得到了空前发展。轮钟花作为一种极具地方特色的药用植物,在药用、食用、保健等方面均具有很好的开发利用前景,尽早对其开展包括引种驯化、种苗繁育、种植技术等研究十分必要。组织培养具有繁殖速度快、不受季节和环境条件限制、容易获得脱毒苗等优点,已是植物生产过程中快速培养优质种苗的重要技术手段,具有广阔的商业化前景[15]。建立轮钟花的组织培养方法,为轮钟花进一步开发利用提供依据,通过外植体筛选、培养基优化来实现轮钟花愈伤组织的诱导和增殖培养,初步建立相应的组织培养技术体系,以期为今后开展轮钟花的规范化、规模化种植提供技术支持。
1材料与方法
1.1材料
1.1.1供试材料轮钟花茎段、叶及种子,采集于贵州中医药大学“国家基本药物所需中药材种子种苗繁育(贵州)基地”,经贵州中医药大学药学院鉴定为桔梗科(Campanulaceae)轮钟花属(Cyclocodon)植物轮钟花〔Cyclocodonlancifolius(Roxburgh) Kurz.〕。种子采收于2017年12月,保存于4~5℃冰箱;茎段、叶片采收于2018年11月。
1.1.2仪器YXQ-LS-100SII立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂),SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司),STD-RUP10纯水机(成都浩康科技有限公司),FA1004B电子天平(上海佑科仪器仪表有限公司),AUW120D电子天平(上海佑科仪器仪表有限公司),BSA224S分析天平(赛多利斯科学仪器有限公司),DK-98-ll电子万用炉(天津市泰斯特仪器有限公司),KFR-72LW(72591)FnhAa-A3空调(珠海格力电器股份有限公司),BCD-331WDGQ冰箱(青岛海尔股份有限公司),KG316T时空开关(德力西集团有限公司),KG316T微电脑时空开关(德力西集团有限公司),KG316T培养架(德力西集团有限公司)。
1.1.3试剂MS培养基(上海微博生物科技有限公司),1/2MS培养基(青岛高科园海博生物技术有限公司),氢氧化钠(天津市恒兴化学试剂制造有限公司),氯化汞(贵州省铜仁银湖化工有限公司),琼脂(北京索莱宝科技有限公司),萘乙酸,简称NAA(广州市林国化肥有限公司),6-苄基腺嘌呤(6-BA)(广州市林国化肥有限公司),2,4-二氯苯氧乙酸(2,4-D)(广州市林国化肥有限公司),无水乙醇(分析纯 国药化学试剂有限公司),蒸馏水和蔗糖。
1.2方法
1.2.1外植体处理茎段、叶片用肥皂水浸泡5 min,流水冲洗30 min。种子用蒸馏水浸泡5 min,取出沉淀于杯底的饱满种子。经处理后茎段、叶片和种子在洁净工作台上分别用75%乙醇浸泡30 s、0.1% HgCl2消毒10 min,无菌水冲洗5~6次,无菌滤纸吸干表面水分,无菌条件下接种于不同的诱导培养基上。
1.2.2培养基及培养条件以MS和1/2MS为基本培养基,添加不同浓度的激素(6-BA浓度:0.2 mg/L、0.5 mg/L、1.0 mg/L、1.5 mg/L、1.8 mg/L;NAA浓度:0.1 mg/L、0.2 mg/L、0.3 mg/L;2,4-D浓度:0.5mg/L、1 mg/L),除不定芽培养基蔗糖浓度为3.0%外,其余蔗糖浓度均为2.0%,全部培养基琼脂浓度为0.8%。培养条件:光照强度1 200~1 500 lx,光照时间12 h/d,培养温度(25±2)℃。培养基及蒸馏水:121℃、30 min条件下高压灭菌。
1.2.3愈伤组织诱导无菌条件下,将轮钟花叶片切成0.5 cm2小块、茎段割成约2 cm的小段及种子接种于添加不同激素浓度配比(表1)的愈伤组织培养基上诱导愈伤组织,30 d后统计愈伤组织诱导结果。
诱导率=出愈数/接种数×100%
表1愈伤组织诱导培养基编号及激素浓度配比
Table 1 Callus induction medium number and hormone concentration ratio

外植体培养部位Explants培养基编号MediumNo.浓度配比Concentration ratio叶、茎JY-11/2MS+0.2 mg/L 6-BA+0.5 mg/L NAA Leaf and stemJY-21/2MS+0.5 mg/L 6-BA+0.5 mg/L NAAJY-31/2MS+1.0 mg/L 6-BA+0.5 mg/L NAAJY-41/2MS+1.0mg/L 6-BA+1.0 mg/L NAAJY-51/2MS+1.5 mg/L 6-BA+1.0 mg/L NAAJY-61/2MS+1.8 mg/L 6-BA+1.0 mg/L NAA种子SeedZZ-11/2MS+1.0mg/L 6-BA+0.5 mg/L NAAZZ-21/2MS+1.5 mg/L 6-BA+0.5 mg/L NAAZZ-31/2MS+1.0 mg/L 6-BA+1.0 mg/L NAAZZ-41/2MS+1.5 mg/L 6-BA+1.0 mg/L NAA
1.2.4愈伤组织的继代培养无菌条件下,将培养的愈伤组织接种于添加不同激素浓度配比(表2)的继代培养基上,55 d后选出继代培养的最适培养基。
表2愈伤组织继代培养基编号及激素浓度配比
Table 2 Callus subculture medium number and hormone concentration ratio

培养基编号Medium No.浓度配比 Concentration ratioJD-11/2MS+0.5 mg/L 6-BA+0.2 mg/L NAAJD-21/2MS+0.5 mg/L 6-BA+0.5 mg/L NAAJD-31/2MS+0.5 mg/L 6-BA+1.0 mg/L NAAJD-41/2MS+1.0 mg/L 6-BA+0.2 mg/L NAAJD-51/2MS+1.0 mg/L 6-BA+0.5 mg/L NAAJD-61/2MS+1.0 mg/L 6-BA+1.0 mg/L NAA
1.2.5不定芽诱导将继代培养的愈伤组织分别接种于添加不同激素浓度配比(表3)的不定芽诱导培养基中,30 d后统计分化率。
分化率=出芽块数/接种数×100%
表3不定芽诱导培养基编号及激素浓度配比
Table 3 Adventitious bud induction medium number and hormone concentration ratio

培养基编号Medium No.浓度配比 Concentration ratio BDY-1MS+0.2 mg/L 6-BA+0.3 mg/L NAABDY-2MS+0.5 mg/L 6-BA+0.2 mg/L NAABDY-3MS+1.0 mg/L 6-BA+0.1 mg/L NAABDY-41/2MS+0.2 mg/L 6-BA+0.3 mg/L NAABDY-51/2MS+0.5 mg/L 6-BA+0.2 mg/L NAABDY-61/2MS+1.0 mg/L 6-BA+0.1 mg/L NAA
2结果与分析
2.1不同外植体愈伤组织诱导的适宜培养基
2.1.1种子由表4可知,诱导轮钟花种子愈伤组织的最适培养基为ZZ-1号培养基(1/2MS+1.0 mg/L 6-BA+0.5 mg/L 2,4-D),其诱导率达80.0%。低浓度2,4-D配合不同浓度的6-BA诱导率效果较好,随着6-BA浓度增加,诱导率降低,表明高浓度6-BA对轮钟花种子诱导愈伤组织存在抑制作用。
2.1.2茎段与叶片由表5可知,2,4-D与6-BA对茎段和叶愈伤组织的诱导效果较好,诱导轮钟花茎段和叶愈伤组织的最适培养基均为JY-4号培养基(1/2MS+1.0 mg/L 6-BA +1.0 mg/L 2,4-D),其诱导率均达80.0%。高浓度6-BA对轮钟花茎段和叶片存在抑制作用,高浓度的2,4-D促进轮钟花茎段、叶片愈伤组织的诱导。

表4不同激素配比轮钟花种子愈伤组织诱导效果

表5不同激素配比轮钟花外植体茎段和叶片的愈伤组织诱导效果
2.2愈伤组织继代培养的适宜培养基
将初代培养的愈伤组织接种7 d后,部分茎段逐渐膨大,大部分为淡黄色、疏松易碎的愈伤组织,少数分泌出红色色素。接种55 d后,茎段在JD-1~JD-3号培养基上为松散干枯的不规则、不完整的黄白色愈伤组织块,说明低浓度(0.5 mg/L)的6-BA不适合轮钟花茎段的继代培养。JD-4号培养基为淡黄色、质地紧密的不规则愈伤组织块;JD-5号培养基为黄色、质地紧密的愈伤组织块且较大;JD-6号培养基为淡黄色不完整的愈伤组织块,且大部分出现褐化现象和较严重污染。表明,JD-5号培养基(1/2MS+1.0 mg/L6-BA+0.5 mg/L NAA)为诱导轮钟花茎段继代培养的最佳培养基。将初代培养的种子接种7 d后,部分初代培养的种子逐渐膨大,接种约20 d后,部分种子外植体长出不定芽,接种55 d后,几乎所有种子都形成黄色、质地紧密的愈伤组织块,其中JD-4号培养基形成的愈伤组织较大,且形成不定芽数多。JD-4号培养基(1/2MS+1.0 mg/L 6-BA+0.2 mg/L NAA)为诱导轮钟花种子继代培养的最佳培养基。将初代培养的叶片接种后,出现大面积的霉菌,且大部分污染严重,说明轮钟花叶片不适合继代培养。愈伤组织继代培养无论颜色还是质地,种子愈伤组织继代培养都比茎段的好(图1、图2)。

注:①~⑥分别为JD-1~JD-6号培养基,下同。
Note:①-⑥ is medium from JD-1 to JD-6 respectively.The same below.
图1茎段继代培养效果
Fig.1 Stem subculture effect

图2种子继代培养效果
2.3不定芽诱导的适宜培养基
由表6可知,适合诱导轮钟花种子不定芽的最适培养基为BDY-1号培养基(MS+0.2 mg/L 6-BA+0.3 mg/L NAA),其分化率为80.0%。表明,6-BA在诱导轮钟花种子不定芽起主要作用,0.2 mg/L 6-BA配合0.3 mg/L NAA使用可以促进轮钟花种子分化不定芽,而高浓度(1.0 mg/L) 6-BA对轮钟花种子诱导不定芽存在抑制作用,随着6-BA浓度增加,分化率显著降低。MS培养基更适合轮钟花种子诱导不定芽;轮钟花茎段与叶片不适合不定芽诱导,茎段与叶片诱导虽培育出愈伤组织,但不定芽分化率均为零,且培养时均无萌发。
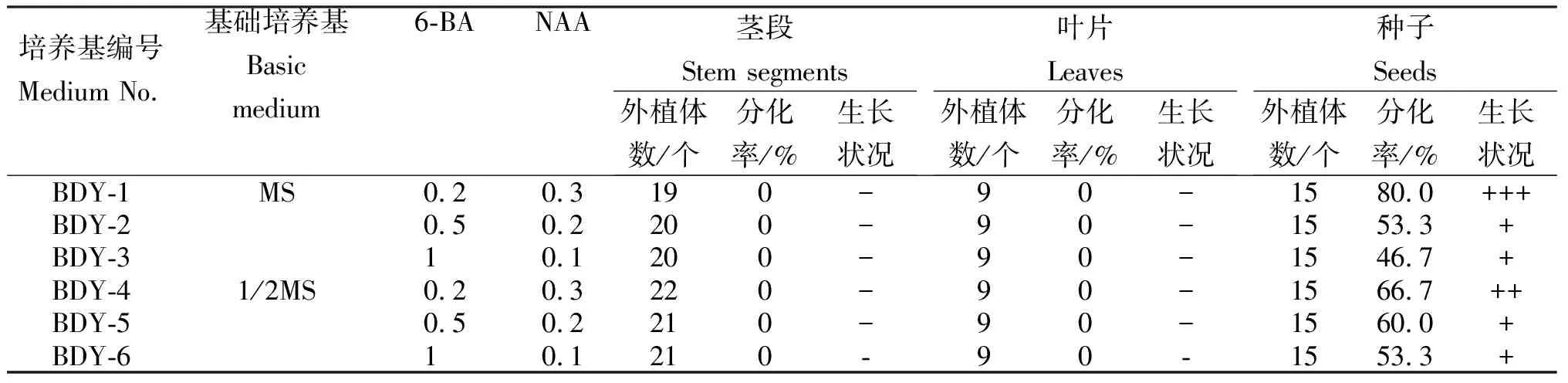
表6不同培养基轮钟花不同外植体不定芽的诱导效果
注:-,无萌发;+,少量萌发;++,长势较旺盛,淡嫩绿色;+++,大量,长势旺盛,嫩绿色。
Note: -, no germination; +, less germination; + +, vigorous growth with light tender green; +++, vigorous growth, tender green.
3结论与讨论
选择合适的外植体类型对诱导产生愈伤组织有很大影响,不同部位的外植体对愈伤组织的诱导也有影响。马丽娜等[16]进行新塔花的组织培养与快速繁殖时发现,以种子萌发的无菌苗茎段为外植体,诱导出的腋芽不仅污染现象较少且易于再生产生新个体。赵杨阳等[17]在研究家独行菜的组织培养与高频再生时发现,家独行菜的茎段更适合作为外植体诱导产生愈伤组织。研究发现,轮钟花的茎段、叶片和种子均能诱导出愈伤组织,但茎段与叶片无分化率,表明,种子更适合作为外植体诱导产生愈伤组织,这可能是由于不同外植体自身的生理结构、分化状态以及脱分化能力的不同所致[18]。
不同浓度的植物生长调节物质对诱导愈伤组织的影响较大。对于多数植物来说,利用适当配比浓度的生长素与细胞分裂素组合是愈伤组织形成的关键[19-20]。研究采用2,4-D和6-BA不同浓度配比组合诱导轮钟花愈伤组织的形成,在配比为1.0 mg/L 6-BA+0.5 mg/L 2,4-D以及1.0 mg/L 6-BA+1.0 mg/L 2,4-D,分别使种子以及茎段与叶片迅速形成大量淡绿色的愈伤组织,诱导率达到80%。其中6-BA诱导作用显著,其不仅能促进细胞的分裂与膨大,更利于茎生长、侧芽产生及芽增殖,但浓度过高(1.0 mg/L)则对轮钟花三种外植体均存在抑制作用。
在进行轮钟花愈伤组织的不定芽诱导时,6-BA作为主效植物生长调节物质,在浓度为0.2 mg/L时诱导效果最好。NAA是一种良好的植物生长刺激素,具有促进细胞分裂与扩大、诱导形成不定根、增加坐果、防止落果、改变雌、雄花比率等作用。在诱导不定芽的产生时,在培养基中添加了不同浓度的NAA,其中0.3 mg/L的NAA对诱导不定芽具有明显效果,增加了芽点,提高了诱导率,产生的不定芽长势健康粗壮。最终筛选的最适合诱导不定芽的生长调节剂配比为MS+0.2 mg/L 6-BA+0.3 mg/L NAA。
轮钟花组织培养研究目前仍处于应用基础研究的初级阶段,还存在许多问题,但组织培养的理论可行性已被证实。随着相关基础理论研究的深入,轮钟花组织培养的关键问题会不断得到解决,相应的技术体系将会得到不断完善,进而大幅提高轮钟花的繁殖和育种工作效率。
