医院生物等效性试验过程中方案偏离的分析与改进
2019-11-07阮姝楠吴旭东
阮姝楠,吴旭东
药物临床试验必须遵循《药物临床试验质量管理规范》(GCP)原则、依从伦理委员会批准的试验方案,任何有意或无意偏离或违反试验方案的行为叫做方案偏离(Protocol deviation)或方案违背(Protocol violation)[1]。在生物等效性试验实际实施过程中,应尽量避免或减少方案偏离的发生。因此,研究者及申办方会制定各环节标准操作规程,建立完善的质量保障体系,涵盖临床试验的全过程,以尽可能减少方案偏离的发生。本文在整理31个生物等效性试验项目中发生方案偏离的基础上,分析造成方案偏离现象的原因,并探讨可能的解决对策。
1 资料与方法
查阅武汉市金银潭医院2018年5月至2019年5月开展的生物等效性试验项目,统计项目中所涉及的方案偏离种类及受试者例次,分析各类方案偏离发生的原因并探讨可能的对策。
2 结果
此次检查武汉市金银潭医院生物等效性试验31个,其中23个项目出现方案偏离,占项目总数的74.19%。本次31个项目,共涉及受试者1 651例,共发生532例次的方案偏离,见表1。
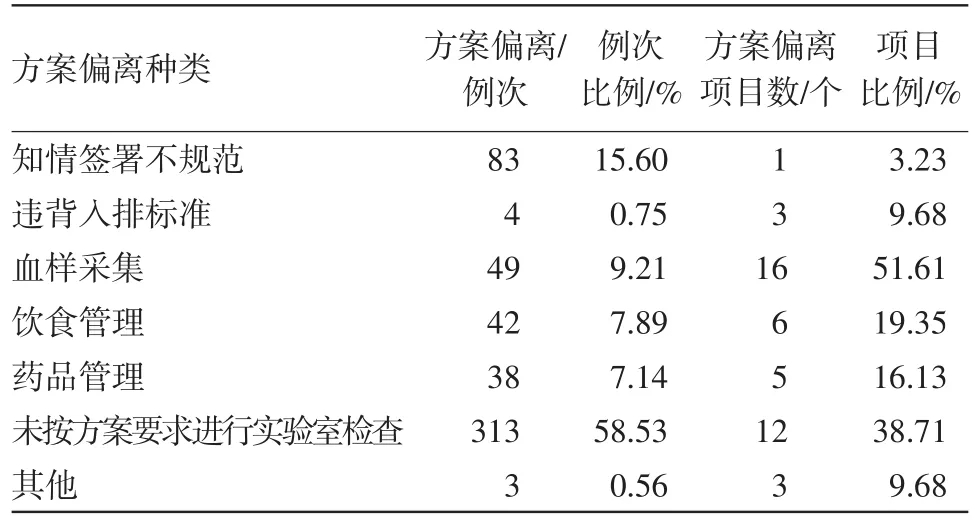
表1 方案偏离种类及数量统计
3 分析
3.1 偏离情况分析
3.1.1偏离情况 在本次抽查的31个生物等效性试验中,有23个项目出现了方案偏离,占项目总数的74.19%。其中:
(1)与血样采集相关的方案偏离发生的项目最多,占项目总数的51.61%,而此类又以采血事件超窗发生频次最多,见表2。
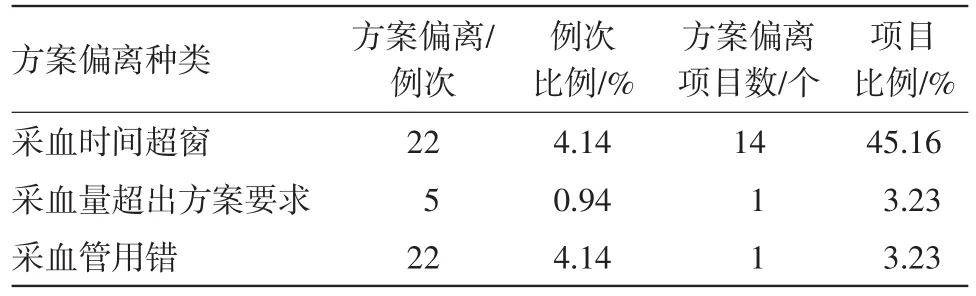
表2 血样采集方面方案偏离数量统计
(2)其次发生项目数多的就是未按方案要求进行实验室检查,占比为38.71%,其中包括未按方案要求的时间进行检查、研究者主动增加实验室检查项等,见表3。
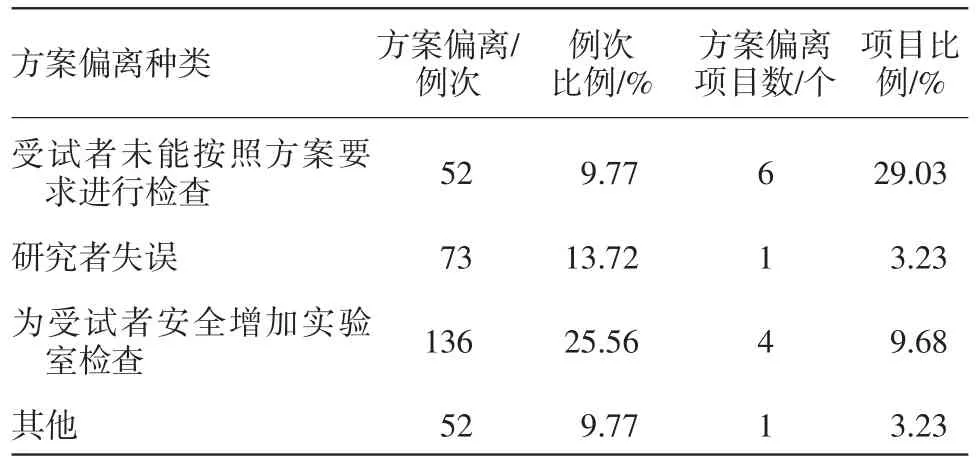
表3 未按方案要求进行实验室检查的偏离数量统计
(3)再次则为饮食管理相关的方案偏离,占比为19.35%。
3.1.2偏离情况分析 (1)血样采集过程相关的方案偏离在生物等效性试验中比较常见,尤其是在采血时间上超窗。因为天气寒冷,或者受试者本身血管情况较细或较深,导致研究护士在采血过程中不能按照时间窗的要求进行采血。对于一般的生物等效性试验,每名受试者单个采血点一般采血量在3~4 mL,在我中心出现过因研究护士未看清采血管刻度而多采0.5~1 mL血量的现象。
(2)另有一个项目,应使用EDTA-K3,但在采血管粘贴标签准备过程中误拿成EDTA-K2,导致22例受试者在采集给药前空白血样时采血管用错,采集过程中研究者发现错误,在时间窗内及时更换采血管,虽未对试验造成后果但致使22例受试者多采4 mL血样,之后针对采血管的准备及核对进行了培训,加强了CRC黏贴标签过程中的核对及研究护士在采血前的相应审核,杜绝了此类问题的再次出现。
(3)饮食管理中的方案偏离主要是未遵守给药后禁食10 h进食晚餐;或是因为方案要求受试者完全进食高脂餐,而受试者因牛奶洒出等原因导致食物不能完全吃下,但进食的总热量满足高脂餐的热量要求故上报了方案偏离[2]。
3.1.3对方案偏离例次的分析 从方案偏离例次进行分析,发生例次最多的是未按方案要求进行实验室检查,占比为58.53%。这方面的方案偏离主要为:
①受试者未能按照方案进行实验室检查造成的方案偏离,如方案要求受试者在门诊筛查当日及出组当日的规定时间留取大便样本,但因受试者不能按时间要求留取,所以仅一个项目就出现45例次方案偏离;另有一常见现象为受试者未按研究者要求空腹进行体检,造成方案偏离。
②研究者失误,某项目中研究者遗漏开具甘油三酯的检查,在监查过程中发现了此次问题后用遗留样本进行了检查,但超出了方案要求的时间,造成73例次受试者出现方案偏离。
③为受试者安全考虑而增加实验室检查。如,方案规定在受试者入组当天进行尿妊娠的检查,而我中心研究医生考虑因尿妊娠较血妊娠敏感度低且血中HCG是判断怀孕的金标准[3],因此经与申办方沟通后,在入组时加做方案未要求的血妊娠检查。
④其他情况,在进行某项目时,测试手指血糖过程中,发现所有受试者血糖均偏高,在更换其他批次血糖试纸后,血糖测试正常,但测试时间超出了方案要求的时间,为避免此类情况再次发生,在需要使用血糖试纸前与实验室血糖值进行校对。
此外,药品管理也较容易发生方案偏离,药品管理包括药品接受、分发及储存过程,具体偏离情况见表4。
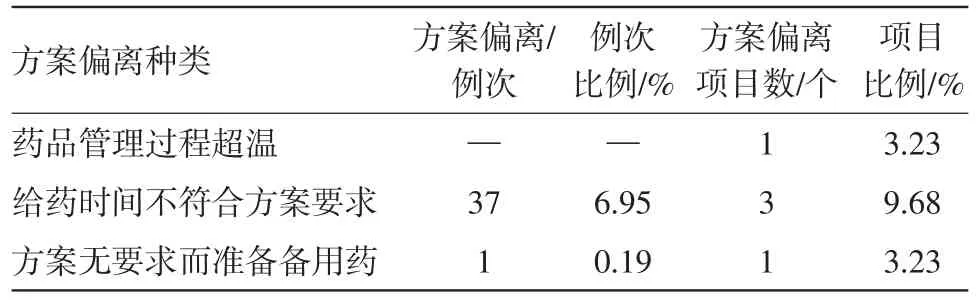
表4 药品管理方面的偏离数量统计
药品管理方面的方案偏离多发生在药品发放环节。某项目中,方案规定受试者统一在8点进行给药,但实际操作难以做到所有受试者同一时间给药,而是依次完成给药,造成方案偏离;另有项目规定在高脂餐后30 min准时进行给药,而在给药过程中,难免出现几秒的误差,造成共37例次的方案偏离。
其余的方案偏离情况见表5。
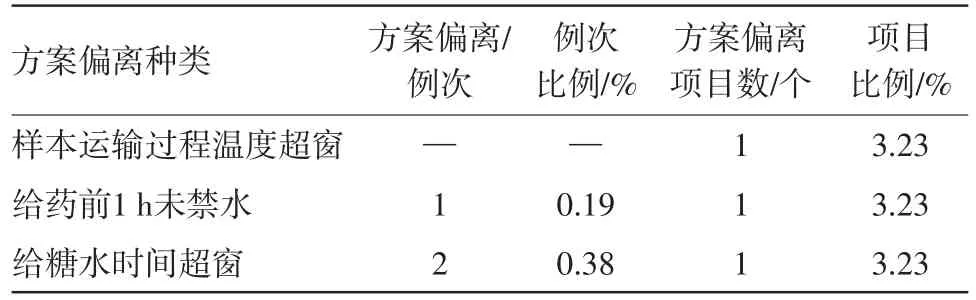
表5 其他方案偏离数量统计
3.2 偏离原因分析
3.2.1方案设计不合理 国家药品监督管理局药品审评中心已针对生物等效性试验发布了包括《以药动学参数为终点评价指标的化学药物仿制药人体生物等效性研究技术指导原则》在内的多个指导原则,规定了方案设计的基本要求。但申办方或合同研究组织在方案撰写过程中,依据一贯习惯而缺乏对研究中心的交流,导致描述不具体且脱离研究中心的实际,方案可执行性差,导致出现前文所述在实验室检查及药品、饮食管理方面的方案偏离。
3.2.2研究者对试验方案不熟悉,未能完全遵循方案 项目的进行需要所有研究者的配合,以及对试验细节的关注。在试验过程中,有研究者不能重视方案细节,造成工作疏漏,出现方案偏离。
3.2.3研究者与合同研究组织间的沟通不及时、合作契合度不高 生物等效性试验需要申办方、研究者、临床监查员(CRA)与临床研究协调员(CRC)的共同努力,及时的沟通必不可少,若沟通不利则容易出现各种问题。如,合同研究组织(CRO)在知情同意书版本升级后未及时告知研究者,且未打印新版知情同意书,导致受试者未签署新版知情同意书。
3.2.4受试者依从性不佳 受试者是参与药物临床试验的评价主体,受试者对试验的依从性直接影响了试验的质量。但是在试验过程中,部分受试者不能完全的遵守试验流程,如出组检查要求受试者空腹检查,但个别受试者未按要求进行完出组检查便自行进餐,经研究者发现后进行其他检查,造成进食后进行检查的方案偏离。
3.2.5不可控因素 试验过程也受到环境的多重影响。我中心出现过因项目中物流故障,发生样本全部超温而不能进行检测而启用备用检测管的事故。
3.3 减少偏离的对策由于临床试验涉及环节较多,参与临床试验主体的差异,方案偏离情况往往难以避免。但过多的方案偏离有可能会影响受试者的权益、影响试验的真实性和科学性,必须采取措施最大可能减少方案偏离的发生,尤其是对于项目中的可控因素,应避免发生方案偏离。
3.3.1优化方案设计 试验设计应该尽量准确、详尽,不产生歧义。尤其生物等效性项目多为单中心,可立项阶段多与研究中心沟通,使方案符合临床实际,既注重科学性,又兼顾可行性。
3.3.2加强项目培训和沟通 确保在试验开展之前所有的研究者得到培训,尤其要强调试验中的关键环节,和易错点,使所有研究者包括临床协调员充分熟知方案后进行相关的操作,避免因研究者的操作发生方案偏离。在项目启动前,建立研究机构与项目方进行沟通的渠道,加强交流协作,避免因沟通不畅造成方案偏离。另外,由于目前合同研究组织存在人员流动大,水平层次不一的问题,在一个项目内部,监查员的内部沟通也是极其重要的,尤其是在有监查员离职的时候需要做好交接工作。
3.3.3建立质量控制体系 申办方和机构均应建立完善的质量控制体系。针对项目中重点环节如入排标准的核对等,应建立双人核对的制度;同时在项目执行过程中,具体工作责任到人,关键环节专人专岗。同时,在监查及内部质控过程,均应按照合同研究组织及机构的标准作业程序(SOP)严格执行,力争在项目早期发现问题,解决问题。
3.3.4做好受试者的管理工作 受试者的依从性是保证试验质量的重要一环。在进行知情同意和宣教的时候,做好受试者的教育管理工作,能更利于受试者配合试验的流程,切勿因研究者的知情讲解不到位,影响项目的进行。
4 讨论
4.1 方案违背和方案偏离本文均以方案偏离进行统计。目前国际国内法规中对方案违背或方案偏离没有明确的区分,《药物临床试验伦理审查工作指导原则》中称之为不依从/违背方案,定义为指对伦理委员会批准试验方案的所有偏离,并且这种偏离没有获得伦理委员会的事先批准,或者不依从/违背人体受试者保护规定和伦理委员会要求的情况[4]。ICH GCP对方案违背和方案偏离并无明确定义,但强调研究者/研究机构应当依从由申办者同意、管理当局(如有要求)批准,并已获得伦理委员会批准的试验方案。如没有和申办者达成一致并事先得到伦理委员会的审查和书面同意,研究者不能有任何偏离方案的行为,除非必须立即消除对受试者的伤害,或只是涉及事务上的或管理方面的变化(如监查员变更,电话号码的变更)[5]。而NIH对方案偏离和方案违背有更加详细的定义,指出方案违背(protocolviolation,PV)是在方案偏离(protocol deviation,PD)的基础上,可能会影响到受试者的权益、健康,并使得试验数据的准确性及可靠性受到影响[6]。笔者认为,方案偏离与方案违背的区别就在对试验数据、对受试者权益及安全的影响。
在此次文件查阅中,笔者发现试验过程中发生的方案偏离,大都比较轻微,与文献的报道比较一致[1,7],部分方案偏离既不影响受试者的安全,也不影响试验的数据,其中仅有4例次违背入排标注为方案违背,其余均为方案偏离。但是对于方案偏离的控制更能体现项目的质量。
4.2 方案偏离的管理对于PV的情况,任何人发现均应立即向伦理委员会提交报告,以便及时处理;对于PD的情况,一般可采取定期报告的方式。此外,为避免研究对受试者的即刻危险,研究者可在伦理委员会批准前,并获得申办方书面同意的情况下不依从方案,事后向伦理委员会提交报告[8],防止严重违反方案,使伦理委员会能够及时介入,真正起到监督的作用。
除了向伦理委员会报告之外,发生如下情况下还须向政府药品监督管理部门报告[9]。包括:①申办者在临床总结报告中要报告不依从方案的具体情况和详细解释;②申办者获知研究者/研究机构发生了重大的PV,中止其继续参与试验后,也须将详细情况上报;③某些地区的药品监督管理部门要求研究者就严重PV的情况进行上报。
国家食品药品监督管理总局发布的《药物临床试验的生物统计学指导原则》[10]认为,对于确证性试验宜同时采用全分析集和符合方案集进行统计分析。当两种数据集的分析结论一致时,可以增强试验结果的可信性。当不一致时,应对其差异进行讨论和解释。所有进行随机的受试者均能进入全分析集,违反随机、入排标准等发生严重方案偏离的受试者不能进入符合方案集。总之,如果符合方案集被排除的受试者比例太大,将影响整个试验的有效性。《药物临床试验数据管理与统计分析的计划和报告指导原则》[11]认为在统计分析报告中需根据依从性定义,报告各受试者完成试验的情况,包括研究时间、药物暴露时间、药物使用量等情况,列表描述依从性差的受试者、依从性差的具体原因及进入分析数据集情况。
5 小结
在生物等效性试验过程中,方案偏离发生是比较常见的。方案偏离发生的原因也各有不同,但大多是可以通过对试验过程的管理而避免的。优化方案设计、加强研究者培训和质控管理等可以减少方案偏离的发生。对于已发生的方案偏离,研究机构和申办方均应努力做到及时处理,以减小对试验的影响。
